间断低压缺氧预处理对MCAO大鼠脑保护作用及对TLR4表达影响
2018-01-18万雅琦吴世政陈晓娟
万雅琦, 吴世政, 侯 倩, 陈晓娟
低氧预处理(hypoxia preconditioning,HP)是指在机体致死性的低氧损伤前,进行短期低强度的低氧刺激,诱导机体缺氧耐受,能在后续的疾病损伤过程中起到一定程度的保护作用。而根据处理方式的不同,低氧预处理又可以粗略分为常压缺氧预处理、低压缺氧预处理以及重复缺氧预处理模型[1,2],根据研究对象的类型又可以分为离体缺氧预处理[3]与在体缺氧预处理[4]。1994年,缺氧预处理的神经保护作用研究已经开始在国际上展开[5]。前期研究发现,短期内间歇性的低压缺氧预处理能够激活不同的信号传导通路,从多方面(神经细胞凋亡、线粒体呼吸、内皮细胞功能)变化诱导大脑缺氧耐受,有效改善单侧大脑缺血动物的神经元受损情况[6]。
本研究从免疫炎症角度进一步剖析了低压缺氧预处理的神经保护作用及对重要炎症相关分子-Toll样受体4(Toll like receptor 4,TLR4)、核因子κB(Nuclear factor-kappa B,NF-κB)的影响,从免疫学角度阐述低压低氧预处理的神经保护作用及分子学机制。
1 材料与方法
1.1 实验动物 健康雄性SD大鼠,体重180~220 g,由西安交通大学医学院实验动物中心提供,合格证号:(No.61001700001958)。
1.2 主要试剂与仪器
1.2.1 主要试剂 2,3,5-三甲基氯化四氮唑(TTC染色剂,美国Sigma公司),尼氏染液(G1430,北京索莱宝科技有限公司),SABC免疫组化试剂盒及DAB染色试剂盒(福州迈新生物技术开发公司)Anti-TLR4小鼠单克隆抗体(ab22048,Abcam公司),Anti-TLR4小鼠单克隆抗体(ab30667,Abcam公司)Beia-actin小鼠单克隆抗体(ab8226,Abcam公司),山羊抗小鼠抗体(SA00001-1,美国Proteintech公司),大鼠NF-κB ELISA 试剂盒(JYM0028Ra,武汉基因美生物科技有限公司),大鼠TLR4 ELISA 试剂盒(JYM0085Ra,武汉基因美生物科技有限公司),大鼠用MCAO线栓(2432-5,北京西农科技有限公司)。
1.2.2 主要仪器 超速离心机(Eppendorf AG 22331 Hamburg,德国),Amersham Imager 600发光显像分析仪(日本),Bio-RAD xMark 10235(日本),青海高原医学研究中心低压氧舱。
1.3 实验分组及MCAO模型、HP模型制备 采用随机数字法将171只大鼠随机分成5组:(1)正常对照(C)组30只,正常食水,不做特殊处理;(2)假手术(S)组26只,分离颈部血管神经后,仔细缝合皮肤及皮下组织,消毒皮肤;(3)单纯低氧处理组35只,置于低压氧舱内,设置海拔5000米,3 h/d,持续7 d;(4)单纯大脑中动脉缺血(MCAO)组43只,经颈总动脉插入线栓制作MCAO模型;(5)缺氧预处理后MCAO组37只,氧舱内连续7 d,每天3 h海拔5000米低压低氧处理,第8天制备MCAO模型。
1.3.1 单侧大脑中动脉缺血(middle cerebral artery occlusion,MCAO)模型制备 选择健康成年雄性SD大鼠,10%水合氯醛麻醉,仰卧位固定,颈正中切口,小心拨开颈部肌肉,分离颈总动脉、颈外动脉,结扎颈外动脉分支及颈总动脉近心端,远心端距CCA分叉部4~5 mm处剪一小口用显微剪剪开一“V”形切口,用0.28 mm的大鼠MCAO专用线栓由切口处插入,直至出现阻力,线拴头端到达大脑中动脉起始处为止,丝线固定线拴,缝合皮肤,常规消毒。
1.3.2 低压低氧模型制备 实验动物于每天固定时间(上午9点)放入氧舱,期间禁食水,模拟高原高海拔环境,以2.5 m/s的速度上升至4900米高度气压水平,设置舱内压力维持在53.5 kPa,温度15.7 ℃,湿度38.7%,平均氧含量维持在12.5%左右,持续3 h后,以2 m/s的速度缓慢降压至2000米,如此间断低压缺氧处理7 d。
1.4 神经功能评分 MCAO术后,采用Longa 5级评分标准进行大鼠神经功能评分,0分:活动自如,无明显神经功能缺损症状;1分:对侧前肢不能完全伸展;2分:行走时出现追尾症状,向对侧转圈;3分:行走时向对侧倾倒;4分:意识丧失,昏迷状态。选择1~3分入组,评分越高,神经功能损伤程度越重。
1.5 TTC染色计算脑梗死体积百分比 大鼠充分麻醉后,断头取完整脑组织,冰生理盐水中漂洗,-20 ℃速冻10 min,取出脑组织,大鼠脑模具中冠状位连续等距(2 mm)切取5个脑组织切片。将脑组织切片平铺于盛有TTC(Triphenyl tetrazolinm chloride,氯化三苯基四氮唑)染液的避光培养皿中,37 ℃孵育20 min,梗死区呈白色,非梗死区鲜红色。染色完全后数码相机拍照采集图像信息,采用 Image J 专业图像分析软件进行图像分析,梗死体积=梗死面积×2 mm,水肿修正后梗死体积=健侧半球体积-(患侧半球体积-患侧半球梗死体积),水肿修正后梗死体积百分比(%)=(水肿修正后梗死体积/健侧半球体积)×100%。
1.6 组织切片的制备、尼氏染色及免疫组织化学法染色 组织以4%多聚甲醛固定后蔗糖多聚甲醛梯度脱水,制作冰冻切片(切片厚度为30 μm),贴片并以尼氏染液染色观察神经元缺损情况及尼氏小体变化;按照免疫组化试剂盒说明书进行冰冻切片TLR4细胞染色,显微镜下观察TLR4的细胞表达情况,一抗浓度稀释比例为1∶300。
1.7 Western blot及ELISA法测定TLR4、NF-κB表达情况 (1)冰上取新鲜左侧额顶叶大脑皮质组织,称重,按照组织(mg):PBS(μl)=1∶10的比例充分匀浆组织至无肉眼可见的组织块,4 ℃,3000 rpm离心20 min,取上清作为待测样品。按照ELISA试剂盒说明书步骤进行后续操作,终浓度(pg/ml)=测定浓度×5(pg/ml)。(2)RIPA法分别提取左侧大脑皮层及海马区脑组织总蛋白,BCA蛋白定量后,每组根据定量浓度等质量加入电泳槽中SDS-聚丙烯酰胺凝胶(PAGE)电泳。转膜、封闭、孵育一抗过夜;洗膜、孵育二抗;洗膜、电化学发光液(ECL)曝光显影。Image J软件半定量分析条带灰度值。一抗及二抗的稀释浓度分别为:Anti-TLR4单克隆抗体1∶1000;山羊抗小鼠抗体1∶10000。

2 结 果
2.1 梗死体积及神经功能损伤程度 比较M组与HM组水肿修正后梗死体积、神经功能评分,神经功能评分低于M组(P<0.05)(见图1a);HM组梗死体积明显小于M组(P<0.05)(见表1、图1b、1c)。
2.2 左侧皮层、海马CA1区神经元缺损情况及TLR4+细胞表达 尼氏染色发现,S组与H组神经元变化不明显,M组神经元缺损情况严重,可见大量细胞坏死碎片,残存神经元极少,轴突断裂、消失。HM组残存神经元增多,神经元形态良好,轴突清晰(见图2a、2b)。TLR4细胞染色可见C组海马及皮质区中胶质细胞胞浆内有一定量的TLR4表达且与S组无异,但神经元TLR4分子染色浅/无;低氧刺激下H组海马CA1区神经元TLR4低表达(+),皮质区除胶质细胞外,神经元也开始表达TLR4,着色浅且均匀;脑梗死发生后M组海马及皮质TLR4染色加深()呈块状浓集;HM组海马CA1区TLR4表达又较M组有所下调(+),部分块状浓集,皮质区虽然TLR4+细胞染色依然部分呈块状浓集,但数目减少且着色浅(见图2c、2d)。
2.3 组织TLR4、NF-κB表达量变化 Elisa法测定大鼠脑组织NF-κB浓度值后分析数据,各组差异具有统计学意义(F=4.18,P<0.01),组间比较发现预处理能够下调脑梗死后NF-κB值(P<0.05)(见图3b)。Western bloting检测各组TLR4蛋白表达发现,皮质区及海马区在低压低氧刺激下,TLR4表达均有所增加(P<0.05)。预处理能够下调MCAO大鼠脑组织(患侧大脑皮质、海马)TLR4表达(P<0.05)(见图3a、3c、3d)。

表1 M组及HM组脑梗死体积百分比(%) (体积百分比经校正后
与M组相比*P<0.05
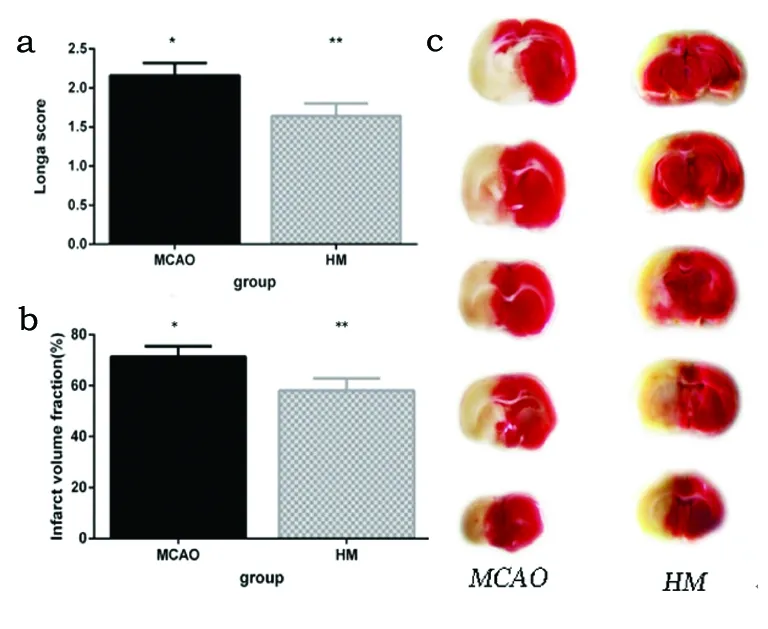
a:Longa评分;b:脑梗死相对体积百分比(%);c:TTC染色。与HM组比较*P<0.05;与MCAO组比较**P<0.05
图1 大鼠Longa评分及脑梗死体积统计分析结果
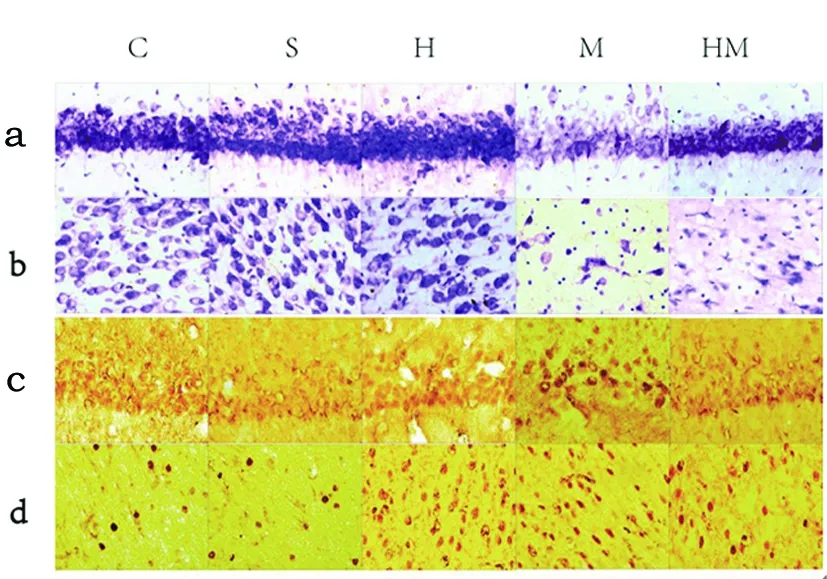
a:海马CA1区尼氏染色;b:皮质尼氏染色;c:海马CA1区TLR4+细胞染色;d:皮质TLR4+细胞染色
图2 各组尼氏染色及TLR4+细胞染色

与C组比较*P<0.05;与M组比较**P<0.05;与HM组比较***P<0.05
图3 各组大鼠皮质及海马区TLR4表达水平(a、c、d)、NF-κB表达水平(b)
3 讨 论
从细胞水平、动物试验及临床研究多个层次的研究当中发现适度的高原缺氧预处理可以上调B细胞淋巴瘤/白血病-2基因及脑血红蛋白及信使核糖核酸表达[8];下调mi R-181c基因表达,间接增强细胞线粒体呼吸功能[9];上调血管内皮生长因子(vascular endothelial growth factor,VEGF)与血管生成素-2(angiogenin-2,Ang-2)表达。在同一血管闭塞条件下,高原人群比平原地区人群更具强大的脑储备力,梗死面积更小,临床症状更轻[10]。有人认为缺氧预处理脑缺血大鼠后,能够刺激海马部位的NeuroD2分子生成,促进神经元再生[11]。我们的研究发现,预处理后MCAO大鼠神经损伤程度要明显低于单纯MCAO大鼠。
以Toll样受体为首的模式识别受体的活化能够诱导神经元凋亡并且放大炎症反应的损伤效应[12,13],Toll样受体共有13种亚型,其中以TLR4在神经系统中的分布最为广泛,目前发现子在脑组织广泛表达TLR4,脑损伤发生后以小胶质细胞为主的细胞表面TLR4激活,下游的炎症因子(IL-1、IL-6、TNF-α)等释放,从而参与了一系列炎症过程[14]。李永旺等人[15]发现停通气缺氧预处理后的MCAO大鼠死亡率降低,脑组织TLR4 mRNA表达较单纯MCAO组有所下降。脑损伤后TLR4信号通路的激活会加重损伤程度,局部TLR4的表达量高低可能影响着脑梗死面积的大小[16,17],阻断TLR4后能够导致小胶质细胞活化减少,致炎因子表达下降[18,19]。但也有人持不同意见,认为TLR4在脑缺血过程中所发挥的作用是双向的,卒中前TLR4的激活有利于卒中后神经系统的抗炎抗凋亡自我保护机制启动,卒中后TLR4受体的激活则主要发挥其激活下游NF-κB,促进细胞释放致炎因子,促进细胞坏死及凋亡的作用[20]。
我们的研究从分子及细胞水平发现低压缺氧预处理能够下调TLR4及其下游信号分子NF-κB的表达,从而对MCAO大鼠起到神经保护作用。正常大鼠神经元不表达或低表达TLR4。低氧刺激下TLR4表达开始增加,脑缺血后神经元及胶质细胞TLR4表达均有大幅度的增加,且以神经元表达增加为主。低压低氧预处理后TLR4表达量的增加程度要明显低于致死性脑缺血性损伤后表达量的变化,这也就说明,TLR4是一把双刃剑,当适度刺激后少量的增加有利于缺氧耐受,当刺激程度加深,TLR4便开始发挥其损伤效应。
[1]Bader AM,Klose K,Bieback K,et al.Hypoxic preconditioning increases survival and pro-angiogenic capacity of human cord blood mesenchymal stromal cells in vitro[J].PloS one,2015,10(9):e0138477.
[2]孙 胜,高钰琪,高文详,等.缺氧预处理保护机制的研究进展[J].国际病理科学与临床杂志,2005,25(4):304-306.
[3]Yu H,Yang Z,Pan S,et al.Hypoxic preconditioning promotes the translocation of protein kinase Cε binding with caveolin-3 at cell membrane not mitochondrial in rat heart[J].Cell Cycle,2015,14(22):3557-3565.
[4]姚寅生,刘家传,杨艳艳,等.缺氧预处理对创伤性脑损伤大鼠Claudin-5表达及血-脑屏障通透性的影响[J].中国微侵袭神经外科杂志,2014,19(4):180-183.
[5]Gidday JM,Fitzgibbons JC,Shah AR,et al.Neuroprotection from ischemic brain injury by hypoxic preconditioning in the neonatal rat[J].Neuroscience Letters,1994,168(1):221-224.
[6]Luo J,Guo Y,Zhang S,et al.Increasing bcl-2 and neuroglubin expression in hypoxic hippocampal neurons under hypoxia preconditioning and in 3-n-butylphalide treated cells under oxygen glucose deprivation/reoxygenation[J].Clinical Immunology Endocrine & Metabolic Drugs,2015,2(1):27-34.
[7]Woodruff TM,Thundyil J,Tang SC,et al.Pathophysiology,treatment,and animal and cellular models of human ischemic stroke[J].Molecular Neurodegeneration,2011,6(1):1-19.
[8]Wu SZ,Zhang SK,Cheng R,et a.Hypoxic preconditioning at high altitude improves cerebral reserve capacity[J].Science,2012,12:31-32.
[9]胡潇方,吴世政,张淑坤,等.MiR-181c对缺氧预处理大鼠卒中的脑保护作用机制[J].中华神经科杂志,2013,46:751-754.
[10]吴世政,吉维忠,才 鼎.高原脑血管病的研究热点及前景[J].中国卒中杂志,2016,11(5):339-343.
[11]Vetrovoi OV,Rybnikova EA,Glushchenko TS,et al.Effects of hypobaric hypoxia in various modes on expression of neurogenesis marker NeuroD2 in the dentate gyrus of rats hippocampus[J].Bulletin of Experimental Biology and Medicine,2016,160(4):510.
[12]Tang SC,Arumugam TV,Xu X,et al.Pivotal role for neuronal toll-like receptors in ischemic brain injury and functional deficits[J].Proceedings of the National Academy of Sciences of the United States of America,2007,104(34):13798.
[13]Arumugam TV,Okun E,Tang SC,et al.Toll-like receptors in ischemia-reperfusion injury[J].Shock,2009,32(1):4.
[14]Yao L,Kan EM,Lu J,et al.Toll-like receptor 4 mediates microglial activation and production of inflammatory mediators in neonatal rat brain following hypoxia:role of TLR4 in hypoxic microglia[J].Journal of Neuroinflammation,2013,10(1):785.
[15]李永旺,金海龙,王保国,等.Toll 样受体 4 信号通路在缺氧预处理诱导的大鼠脑缺血耐受中的作用[J].中华医学杂志,2007,87(35):2458-2462.
[16]Brea D,Blanco M,Ramos-Cabrer P,et al.Toll-like receptors 2 and 4 in ischemic stroke:outcome and therapeutic values[J].Journal of Cerebral Blood Flow & Metabolism,2011,31(6):1424-1431.
[17]梁桂娟,王迎涛,刘艳红,等.新生大鼠缺氧缺血性脑损伤 TLRTLR4 表达及与细胞凋亡的关系[J].分子影像学杂志,2016,2:172-174.
[18]Moraga A,Gmez-Vallejo V,Cuartero MI,et al.Imaging the role of toll-like receptor 4 on cell proliferation and inflammation after cerebral ischemia by positron emission tomography[J].Journal of Cerebral Blood Flow & Metabolism,2016,36(4):702-708.
[19]赵 超,宋书莲,周 洁,等.TLR4 受体拮抗剂对 Aβ1-42 诱导的小胶质细胞炎性因子分泌的影响[J].实用临床医药杂志,2016,20(9):1-5.
[20]Fadakar K,Dadkhahfar S,Esmaeili A,et al.The role of Toll-like receptors (TLRs) in stroke[J].Reviews in the Neurosciences,2014,25(5):699-712.
