拟南芥JAG基因调控花器官中叶绿素a与b比例
2018-01-17余泓漾黄腾波何亨辉张永夏
王 伟,余泓漾,2,黄腾波,何亨辉,张永夏
1 )深圳大学生命与海洋科学学院,广东省植物表观遗传学重点实验室,广东深圳518060; 2) 深圳大学光电工程学院,光电子器件与系统教育部/广东省重点实验室,广东深圳518060; 3) 深圳市公园管理中心,广东深圳 518040
具有C2H2锌指结构的转录因子JAGGED(JAG)在植物发育中发挥着重要的作用,早期的研究表明,JAG基因主要通过促进细胞增殖实现对整个发育过程的调控.在新形成的器官原基以及幼嫩器官的远轴端,JAG基因都有较强的表达[1-2].随着研究的深入,JAG基因越来越多的功能被发现和报道.JAG基因可以直接调控PETALLOSS(PTL)基因的表达,进而影响植物生长素的极性分布,对花瓣远轴端的发育起到调控作用[3];JAG转录因子也直接作用于细胞周期调控因子KIP RELATED PROTEIN 4 (KRP4) 和KRP2,在花瓣和其他组织中,调控细胞分裂活动,从而影响到整个植株的发育过程[4].JAG基因对细胞生命活动的调控作用可能还不仅限于细胞分裂.利用3D模型解析花器官发育的研究中,已经观察到在JAG基因过表达的植株中,细胞的形态和细胞命运都受到了影响[5],这一研究预示着JAG基因所调控的下游基因是一个涵盖非常广泛且十分复杂的网络系统.SCHIESSL等[4]利用染色质免疫共沉淀高通量测序(ChIPseq)技术寻找JAG基因直接作用的靶基因,发现1 600多个基因组片段都在JAG-GFP 直接作用的DNA库中富集.表明JAG基因存在着广泛的靶基因,可能参与到植物生长发育的很多方面的调控.而这些基因中,与叶绿体相关的基因就多达几十个.预示着JAG基因对叶绿体的发育,及叶绿素的代谢过程有着重要的作用.
叶绿体发育和叶绿素代谢过程是绿色植物重要的生命活动,文献[6-8]相继报道和总结了一些重要的叶绿素合成相关酶和叶绿体发育中的关键调控因子.其中,叶绿素a (chlorophyll a, Chla)和叶绿素b(chlorophyll b, Chlb)之间的转化被称为叶绿素循环[9],该循环通过一个关键的氧化酶Chlide a oxygenase(CAO)可把叶绿素四吡咯环上的甲基氧化成为甲酸基,实现从Chla到Chlb的转变.Chlb对植物适应弱光有着重要的作用,在弱光下植物合成较多的Chlb,从而形成较大的光捕获系统来适应弱光环境[9-11].此外,CAO对于Chlb在光系统中的正确排布也起到了作用[12].CAO蛋白的稳定性受蛋白酶chloroplast Clp protease的影响,chloroplast Clp protease复合体中亚组分ClpC1的突变,使得CAO蛋白更加稳定,从而产生更多的Chlb[13].在拟南芥中chloroplast Clp protease的另一个亚组分ClpP4会被U-box蛋白AtCHIP识别而泛素化降解,从而影响Clp复合体的稳定性以及CAO蛋白的含量,最终影响Chlb的水平[13-14].本研究通过分析JAG基因过表达植株中CAO基因的表达量以及Chlb的含量,初步探索JAG基因可能影响到的有关叶绿素功能的调控途径.
1 材料与方法
1.1 材料准备和处理
1.1.1 35S:JAG:GR诱导型过表达植物材料
35S:JAG:GR拟南芥(Arabidopisisthaliana)诱导型过表达植物的种子由英国John Innes Center 的Sablowski Robert教授惠赠.在拟南芥35S:JAG:GR系统中,由于糖皮质激素受体(glucocorticoid reccptor, GR )与JAG融合,过表达生成的大量JAG转录因子蛋白存在于细胞核外,没有糖皮质激素地塞米松(dexamethasone, DEX)处理时并不能进入到细胞核行使转录因子的作用.将DEX溶液滴到拟南芥花器官上进行处理时,GR结合DEX失去对JAG蛋白进核的抑制作用,过表达生成的JAG转录因子大量进入核内.
1.1.2 植物栽培条件和取材时间
使用德国维特种植专用泥炭土(粒径0~5 mm)混合1/4体积珍珠岩种植拟南芥植物,并置于恒温(22 ℃)植物培养室中每日光照15 h、黑暗9 h培养.实验材料拟南芥第1朵花开放时,对实验材料进行处理和后续实验.
1.1.3 DEX诱导JAG过表达实验
对拟南芥35S:JAG:GR材料进行基因过表达诱导处理,条件为10 μmol/L的DEX +体积分数为0.015%的Silvet-L77,记作DEX;对照组处理使用同体积的酒精代替DEX溶液,记作MOCK.处理4 h后,收取整个花序作为基因表达分析中核糖核酸(ribonucleic acid, RNA)提取的实验材料.
1.1.4 抑制蛋白质合成条件下DEX诱导JAG过表达实验
蛋白合成被抑制条件下拟南芥35S:JAG:GR诱导处理条件为10 μmol/L的DEX+10 μmol/L的抑制剂放线菌酮(cycloheximide, CHX)+体积分数为0.015%的Silvet-L77,记作 DEX+CHX.对照组10 μmol/L的酒精+10 μmol/L的CHX+体积分数为0.015%的Silvet-L77,记作CHX.处理4 h后,收取整个花序作为基因表达分析中RNA提取的实验材料.
1.1.5 叶绿素含量测定实验的材料准备
将DEX组和MOCK组材料处理4 h后,用移液枪吸蒸馏水冲洗掉残余的处理液,再把植物放于温室中继续生长.2 d后取植物花序作为提取叶绿素的实验材料.
1.1.6 ChIPseq和micro-array数据的收集
JAG:GFP ChIPseq和JAG过表达micro-array数据从文献[4]及补充材料中整理获得.
1.2 叶绿素含量的测定和计算
取新鲜采摘的植物花器官约0.5 g,在5 mL体积分数为80%的丙酮溶液中浸没6 h,期间缓慢摇晃几次,植物绿色可完全褪去.收集含有叶绿素的丙酮溶液,通过分光光度计测量对应的光密度值D(645)和D(663), 利用式(1)至式(3)[15]分别计算总叶绿素质量浓度ρ(total)、ρ(Chla)和ρ(Chlb), 单位:mg/L.然后,根据式(4)计算对应的叶绿素质量分数.
ρ(Chla)=12.72D(663)-2.59D(645)
(1)
ρ(Chlb)=22.88D(645)-4.68D(663)
(2)
ρ(total)=20.29D(645) + 8.02D(663)
(3)
w(…) =ρ(…)V×n/m
(4)
其中,w(…)表示单位质量花器官材料中含有叶绿素的质量,单位:mg/g;V表示提取液总体积,单位:L;n为稀释倍数;m为材料鲜质量.叶绿素质量分数结果来自6个生物学重复.
1.3 基因表达量的分析
植物样品的总RNA提取采用Trizol法,使用Life 公司Trizol总RNA提取试剂盒(15596026-100mL),操作方法依照试剂盒说明书.1 μg总RNA用于反转录合成cDNA,使用反转录试剂盒(Takara,RR047),依据试剂盒使用说明书进行操作.实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,RT-qPCR)使用Takara SYBR green mix(rr820b)试剂盒,在ABI OneStep Plus 荧光定量PCR仪上运行.RT-qPCR结果来自4个生物学重复,数据分析采用2-ΔCt法,差异表达分析采用t-检测, 其中,P<0.05为显著差异表达基因.RT-qPCR引物如表1.

表1 引物序列Table 1 Primer sequences list
1.4 共同调控基因的维恩(VENN)图分析
使用VENN在线分析工具http://bioinformatics.psb.ugent.be/webtools/Venn/, 采用VENN图寻找JAG ChIPseq和JAG micro-array结果中共同调控的基因交集.
2 结果与分析
2.1 JAG基因过表达使w(Chla)/w(Chlb)减小
在诱导JAG过表达的植株中,花器官形态发生明显改变,经DEX处理2 d后花瓣的发育受到抑制 (图 1),与文献[3]报道结果一致,表明JAG基因诱导型过表达实验成功.

图1 DEX处理2 d后JAG诱导型过表达植物的表型变化Fig.1 Phenotypic changes of flowers of the JAG inducible over-expression lines treated by DEX 2 d
测量并计算叶绿素质量分数,分析结果如图2.由图2(a)可见,经DEX处理2 d后的w(Chla)=0.382 mg/g,与MOCK组w(Chla)=0.408 mg/g相比显著降低,P=0.025. 由图2(b)可见,经DEX处理后w(Chlb)= 0.178 mg/g,与MOCK组相比,w(Chlb)显著提高至0.144 mg/g(P=0.001). 由图2(c)可见,经DEX处理后,w(Chla)/w(Chlb)=2.191, 比MOCK组w(Chla)=2.761 mg/g显著性降低(P=0.000 2). 由图2(d)可见,DEX处理后平均w(total)=0.542 mg/g,与MOCK组w(Chla)=0.556 mg/g相比,没有显著性变化(P=0.245). 以上结果表明,JAG基因过表达2 d后,花器官中叶绿素总量并没有明显变化,但w(Chla)/w(Chlb)显著降低,有更多的Chla转化成Chlb.

图2 叶绿素质量分数的测定 Fig.2 Chlorophyll levels in floral organs
2.2 JAG基因过表达使CAO基因表达水平上调
由于w(Chla)/w(Chlb)的变化与CAO基因的功能密切相关,对诱导JAG过表达4 h后的植物花器官中的CAO基因表达量进行分析.RT-qPCR实验结果显示,CAO基因的表达量在DEX处理后比MOCK组显著提高,如图3(c).该结果与前面观察到的DEX处理后JAG-GR植物中w(Chla)/w(Chlb)下降的现象相符.推测JAG基因过表达后使得调控Chla向Chlb转化的关键基因CAO的表达水平上调,从而有更多的Chla向Chlb转化,表现为w(Chla)/w(Chlb)下降.为说明转录因子JAG对CAO的调控是否是直接作用,进行蛋白合成CHX处理下的JAG诱导型过表达,发现当蛋白合成受到抑制时,JAG的过表达并不能引起CAO转录水平发生变化,如图3(d) .表明转录因子JAG对CAO的调控不是通过直接作用来实现的.对CAO的上游直接调控因子CLPC1的表达分析,发现CLPC1表达量没有变化,如图3(a).CLP复合体的另一个亚基CLPP4的调控因子CHIP的表达量也没有在JAG过表达后发生变化,如图3(b).说明已知的CAO基因的调控途径并没有转录因子JAG的过表达而发生变化,JAG过表达后CAO基因表达的上调可能存在未知的JAG促进CAO表达的机制(图4).
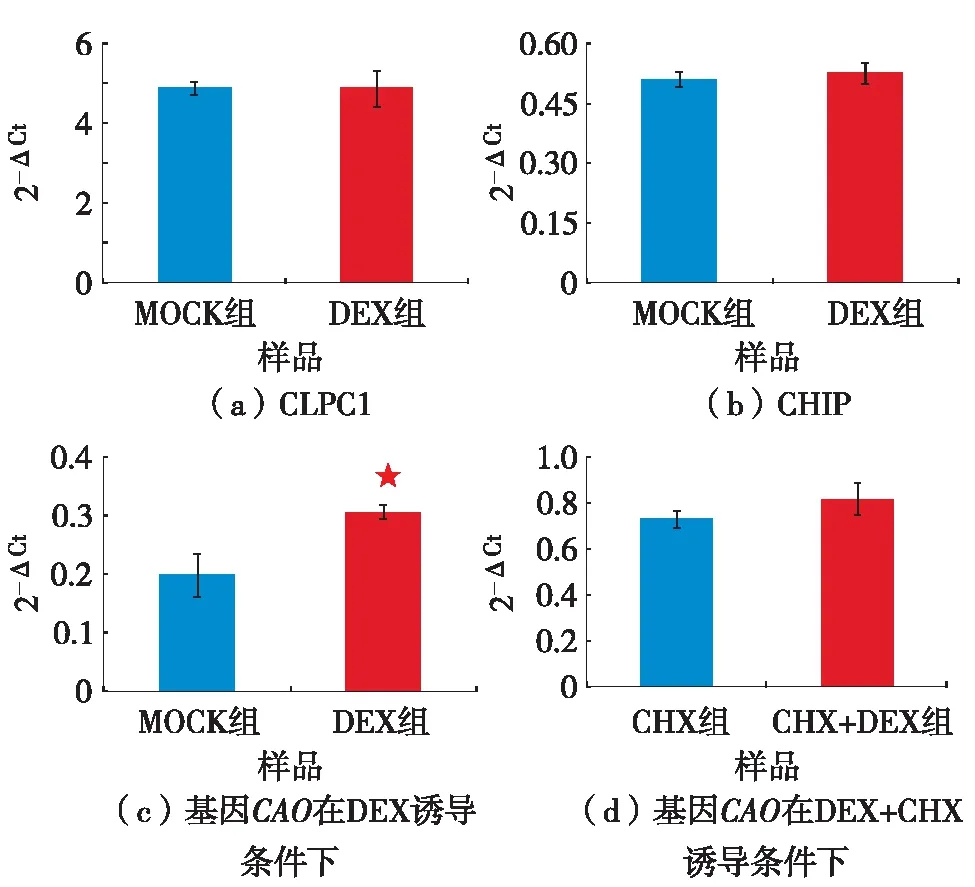
图3 基因表达量的RT-qPCR结果Fig.3 RT-qPCR analysis of gene expression
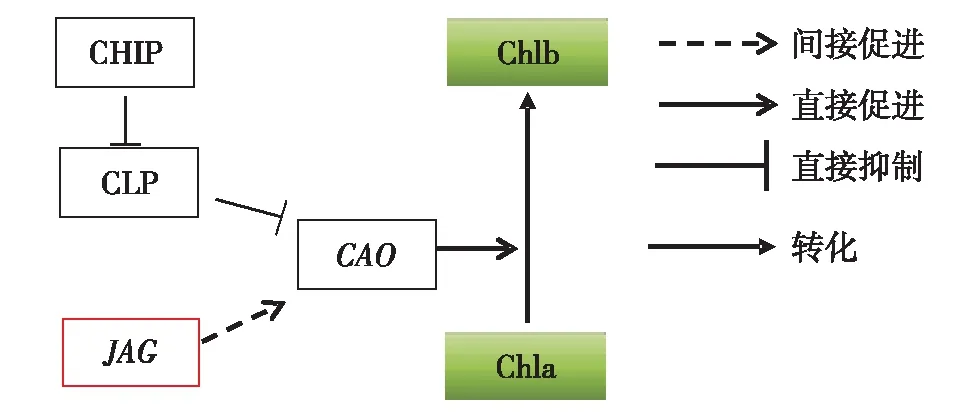
图4 JAG间接调控CAO,参与Chla向Chlb转变的调控示意图Fig.4 Schematic diagram of JAG indirectly regulating CAO, controlling the transition from Chla to Chlb
2.3 探寻JAG促进CAO调控网络中的潜在相关基因
为寻找JAG间接调控CAO通路中的其他基因,利用已发表的JAG ChIPseq和JAG micro-array数据[4],对可能参与的基因进行了预测和分析.首先在JAG ChIPseq数据中,根据基因注释对1 634个JAG直接作用的基因进行筛选,找到75个在叶绿体中表达,或者参与了叶绿体发育的相关基因.根据JAG的micro-array数据,选择了2 995个在JAG过表达是差异表达的基因.利用在线的VENN分析工具,寻找到图5两组数据中的交集中的23个基因.这些基因受到JAG的直接作用,参与到叶绿体的发育,且在JAG过表达植物中差异表达显著,是JAG促进CAO的调控网络中的潜在基因(表2).其中,AT3G07340(GOLDEN2LIKE1,GLK1)是叶绿素合成途径中的关键基因[16-17],很可能是JAG促进CAO的调控网络中重要的参与因子.

图5 JAG ChIPseq和JAG micro-array结果中共同调控基因的VENN图Fig.5 VENN map showing the overlap in JAG ChIPseq and JAG micro-array results
3 讨 论
本研究发现,在JAG基因过表达植物的花器官中,受JAG基因过表达影响有更多的Chlb合成,使w(Chla)/w(Chlb)显著升高(图2),这种变化对于植物适应弱光环境有积极作用[10-11].在以往的研究中,关于JAG调控植物发育的报道,尤其是调控花器官与叶片的发育一直是研究的热点[1-4],本次研究首次发现了JAG影响叶绿素循环这一新的功能.结合已有的JAG高通量测序结果中存在着大量的受到JAG调控的叶绿体发育相关基因[4](表2),预示着在叶绿体发育和叶绿素合成和代谢中,JAG有着重要的作用.

表2 JAG直接作用并且在JAG诱导过表达后差异表达显著的叶绿体相关基因1)
1)基因注释中信息库均为Araport11
本研究发现JAG对叶绿素循环的影响,是通过间接作用于Chla向Chlb转化的关键酶CAO来实现(图3),这种调控作用与已有的报道CAO受到CLP蛋白酶复合体的负调控[13-14]并不在同一条调控通路中(图4),预示着JAG可能通过与其他基因之间的相互作用来实现对CAO基因的调控.本次研究中利用已有的高通量测序数据,包括JAG ChIPseq数据和JAG micro-array数据,相互比较筛选出的一系列候选基因(图5和表1),可能成为进一步深入研究的切入点.后续对JAG影响CAO表达的调控细节的研究,将对进一步剖析C2H2家族转录因子JAG在植物器官生长发育中的功能,起到重要的帮助作用.
利用高通量测序技术及公共数据库,可迅速找到感兴趣基因的下游相关基因和调控网络数据[18-19],这对在众多基因中迅速找到研究的靶点基因有重要的帮助.本研究利用已经发表的高通量测序数据,找到了23个受到JAG调控的叶绿素相关基因,对于进一步研究JAG调控叶绿素合成机理有重要作用.这些候选基因中有很多都还没有进行深入研究.利用RNA在植物细胞中定位的研究方法[20],可具体分析这些候选基因的RNA在亚细胞中的定位,从而推断它们的功能,为下一步的功能分析做出重要判断.深入研究这些受JAG调控的叶绿素相关基因,会对解析JAG在植物发育中的功能做出重要的理论贡献,也会对深入了解叶绿素合成的调控机理提供新的观点[21-25].
结 语
在JAG调控的下游基因网络中,有关调控叶绿素a向b转化通路的研究较少. 本研究发现JAG通过间接影响CAO基因的表达,从而调控叶绿素a向b的转化,预示着JAG在叶绿素合成途径中有重要的作用. 作为植物发育中的一个重要调控因子,JAG调控叶绿素合成的细节值得进一步挖掘和研究.
引文:王 伟,余泓漾,黄腾波,等. 拟南芥JAG基因调控花器官中叶绿素a与b比例[J]. 深圳大学学报理工版,2018,35(1):8-14.
/
[1] DINNENY J R, YADEGARI R, FISCHER R L, et al. The role of JAGGED in shaping lateral organs[J]. Development, 2004,131(5):1101-1110.
[2] OHNO C K, MEYEROWITZ E M. TheArabidopsisJAGGED gene encodes a zinc finger protein that promotes leaf tissue development[J]. Development, 2004, 131(5): 1111-1122.
[3] SAURET-GÜETO S, SCHIESSL K, BANGHAM A, et al. JAGGED controlsArabidopsispetal growth and shape by interacting with a divergent polarity field[J]. PLOS Biology,2013,11(4):e1001550.
[4] SCHIESSL K M, SABLOWSKI R.ArabidopsisJAGGEDlinks floral organ patterning to tissue growth by repressing Kip-related cell cycle inhibitors[J]. Proceedings of the National Academy of Sciences of the United States of America,2014,111(7):2830-2835.
[5] SCHIESSL K, KAUSIKA S, SOUTHAM P, et al.JAGGEDcontrols growth anisotropy and coordination between cell size and cell cycle during plant organogenesis[J]. Current Biology: CB,2012,22(19):1739-1746.
[6] BOLLIVAR D W. Recent advances in chlorophyll biosynthesis[J]. Photosynthesis Research,2006,90(2):173-194.
[7] MASUDA T, FUJITA Y. Regulation and evolution of chlorophyll metabolism[J]. Photochemical & Photobiological Sciences : Official Journal of the European Photochemistry Association and the European Society for Photobiology,2008,7(10):1131-1149.
[8] CORTLEVEN A, SCHMÜLLING T. Regulation of chloroplast development and function by cytokinin[J]. Journal of Experimental Botany,2015,66(16):4999-5013.
[9] TANAKA A, ITO H, TANAKA R, et al. Chlorophyll a oxygenase (CAO) is involved in chlorophyll b formation from chlorophyll a[J]. Proceedings of the National Academy of Sciences of the United States of America,1998,95(21):12719-12723.
[10] TANAKA R, KOSHINO Y, SAWA S, et al. Overexpression of chlorophyllide a oxygenase (CAO) enlarges the antenna size of photosystem Ⅱ in Arabidopsis thaliana[J]. The Plant Journal: for Cell and Molecular Biology, 2001, 26(4): 365-373.
[11] TYUTEREVA E V, VOITSEKHOVSKAJA O V. On the role of chlorophyll b in ontogenetic adaptations of plants[J]. Biology Bulletin Reviews,2014,4(6):507-514.
[12] HIRASHIMA M, SATOH S, TANAKA R, et al. Pigment shuffling in antenna systems achieved by expressing prokaryotic chlorophyllide a oxygenase inArabidopsis[J]. The Journal of Biological Chemistry,2006,281(22):15385-15393.
[13] NAKAGAWARA E, SAKURABA Y, YAMASATO A, et al. Clp protease controls chlorophyll b synthesis by regulating the level of chlorophyllide a oxygenase[J]. The Plant Journal: for Cell and Molecular Biology, 2007, 49(5): 800-809.
[14] SHEN G, YAN Juqiang, PASAPULA V, et al. The chloroplast protease subunit ClpP4 is a substrate of the E3 ligase AtCHIP and plays an important role in chloroplast function[J]. The Plant Journal: for Cell and Molecular Biology,2007,49(2):228-237.
[15] ZHANG Jinheng, HAN Chao, LIU Zhiheng. Absorption spectrum estimating rice chlorophyll concentration: preliminary investigations[J]. Journal of Plant Breeding & Crop Science, 2009, 1 (1) :223-229.
[16] WATERS M T, LANGDALE J A. GLK transcription factors regulate chloroplast development in a cell-autonomous manner[J].Plant Journal for Cell & Molecular Biology, 2008, 56(3):432-444.
[17] NAKAMURA H, MURAMATSU M, HAKATA M, et al. Ectopic overexpression of the transcription factor OsGLK1 induces chloroplast development in non-green rice cells[J]. Plant & Cell Physiology,2009,50(11):1933-1949.
[18] 岳路明,宋剑波,徐晓峰,等.拟南芥AGO基因家族分析及盐胁迫下的表达验证[J].深圳大学学报理工版,2017, 34(4):352-357.
YUE Luming, SONG Jianbo, XU Xiaofeng,et al. Bioinformatical and experimental analysis ofAGOgenes in response to salt stress[J]. Journal of Shenzhen University Science and Engineering ,2017,34(4):352-357.(in Chinese)
[19] 马 轩,李盛本,莫蓓莘,等.拟南芥ago1-27突变体的RNA-seq分析[J].深圳大学学报理工版,2017, 34(1):27-32.
MA Xuan, LI Chengben, MO Beishen,et al.RNA-seq analysis onArabidopsisago1-27 mutant[J].Journal of Shenzhen University Science and Engineering,2017,34(1):27-32.(in Chinese)
[20] 莫蓓莘.RNA在植物细胞中的定位及其研究进展[J].深圳大学学报理工版,2011, 28(3):230-236.
MO Beixin.RNA localization in plant cells and advances of the research[J].Journal of Shenzhen University Science and Engineering,2011,28(3):230-236.(in Chinese)
[21] 徐 冉,侯和胜,佟少明.藻类叶绿素a/叶绿素b型捕光蛋白复合体结构与功能的研究进展[J].天津农业科学,2016, 22(2):31-34.
XU Ran, HOU Hesheng, TONG Shaoming. Research progress of the Chl a/Chl b type light-harvesting complex protein in algae[J]. Tianjin Agricultural Sciences,2016,22(2):31-34.(in Chinese)
[22] 丁 跃,吴 刚,郭长奎.植物叶绿素降解机制研究进展[J].生物技术通报,2016, 32(11):1-9.
DING Yue, WU Gang, GUO Changkui. Research advance on chlorophyll degradation in plants[J]. Biotechnology Bulletin,2016,32(11):1-9.(in Chinese)
[23] 姚嘉龙,郭 蓓,谢 皓.叶绿素合成关键酶基因表达的半定量RT-PCR分析[J]. 基因组学与应用生物学,2015,34(3):593-598.
YAO Jialong, GUO Bei, XIE Hao. Expression analysis of key enzyme gene involved in chlorophyll biosynthesis by semi-quantitative RT-PCR[J]. Genomics and Applied Biology, 2015, 34(3): 593-598.(in Chinese)
[24] 史典义,刘忠香,金危危.植物叶绿素合成、分解代谢及信号调控[J].遗传,2009, 31(7):698-704.
SHI Dianyi, LIU Zhongxiang, JIN Weiwei. Biosynthesis, catabolism and related signal regulations of plant chlorophyll[J]. Hereditas,2009,31(7):698-704.(in Chinese)
[25] 王平荣,张帆涛,高家旭,等.高等植物叶绿素生物合成的研究进展[J].西北植物学报,2009, 29(3):629-636.
WANG Pingrong, ZHANG Fantao, GAO Jiaxu,et al. An overview of chlorophyll biosynthesis in higher plants[J]. Acta Botanica Boreali-Occidentalia Sinica,2009,29(3):629-636.(in Chinese)
