三种方法获取胸水细胞蜡块中肿瘤细胞进行EGFR基因检测
2018-01-15蒋金芳梁伟华庞丽娟
蒋金芳,任 艳,梁伟华,庞丽娟
随着分子生物学技术的广泛应用,肿瘤的分子检测与临床靶向用药为患者提供新的治疗。目前,肺癌已进入精准治疗时代,方案及药物的选择是根据其组织学亚型和分子学检测结果共同制定[1]。近年以表皮生长因子受体(epidermal growth factor receptor, EGFR)为靶点的分子靶向治疗已成为非小细胞肺癌(non-small cell lung cancer, NSCLC)的治疗方案,然而只有约1/3的患者存在EGFR敏感突变位点,对EGFR酪氨酸激酶抑制剂(EGFR-TKI)的Gefitinib和Erlotinib药物敏感。因此,获得足量优质的样本进行基因检测是指导靶向用药的必要前提。
相对于手术和穿刺标本,获取肺癌晚期患者的胸水标本具有便捷、创伤小、多次取材等优势,针对胸水标本是否用于基因检测需依赖样本中肿瘤细胞的绝对数、肿瘤细胞所占比率、肿瘤细胞保存程度及采用分子检测方法的敏感性[2-4]。目前,大部分检测机构取胸水离心细胞或细胞蜡块切蜡膜提取核酸进行基因检测,并未对检测样本中肿瘤细胞的绝对数和肿瘤细胞所占比率进行评估,基因检测结果是否能真实反映肿瘤细胞的基因状态值得进一步分析。本实验在胸水细胞蜡块中应用三种方法获取肿瘤细胞进行基因检测,对肿瘤细胞的绝对数和肿瘤细胞所占比率做进一步探讨。
1 材料与方法
1.1材料收集石河子大学医学院第一附属医院病理科2014~2015年肺来源的恶性肿瘤胸水细胞蜡块制成切片,请两位高年资的病理医师对标本HE、免疫组化阅片,挑选肺肿瘤细胞标本30例,参照《肺癌小标本取材相关问题的中国专家共识》,病理医师对需要做基因检测的胸水细胞蜡块中肿瘤细胞数量及百分比进行评估。
1.2细胞蜡块取1份胸水沉淀样本约250 mL入50 mL离心管中,2 000 r/min离心10 min,弃上清液,将收集沉淀物,用擦镜纸包好放入包埋盒中,放入10%中性福尔马林中固定1~2 h,按小组织常规标本处理[5]。
1.3三种方法获取肿瘤细胞第一种常规方法:细胞蜡块5 μm厚,连续切片5~10张蜡膜,收集到1.5 mL的EP管中。第二种激光显微切割法:细胞蜡块8 μm厚连续切片5~10张,自然晾干,HE染色,无水乙醇2 min,自然晾干,激光显微切割仪(德国/AXT2022 ZEISS)选取并收集肿瘤细胞到收集盖上(图1),肿瘤细胞数量大于200个[4],每例需3~4个收集盖,将收集盖中的肿瘤细胞经蛋白酶K(20 mg/mL)消化12 h,收集在1.5 mL EP管中。第三种刀片刮取法:细胞蜡块5 μm厚,连续切片5~10张,完成烤片,HE染色,在低倍镜下观察,结合免疫组化用记号笔在肿瘤细胞区域划圈,消毒刀片刮去非肿瘤细胞区域,用75%乙醇把这些区域擦干净,更换刀片刮下的肿瘤细胞,估算肿瘤细胞数量大于200个,收集到1.5 mL的EP管中。

ABC图1 用激光显微切割法从胸水细胞蜡块中获取肿瘤细胞:A.切割前肺腺癌胸水细胞块切片;B.切割后肺腺癌胸水细胞块切片;C.收集盖上的肺腺癌细胞
1.4DNA提取Qiagen法石蜡组织提取DNA步骤详见说明书,提取好的DNA用核酸蛋白测定仪(Thermo scientific ND 2000)测定DNA质量及浓度,调整DNA浓度为2 ng/μL备用。
1.5EGFR基因检测使用厦门艾德医药公司提供试剂(人类EGFR基因突变21种检测试剂盒)的8联管加入样本DNA,使用实时定量PCR仪(美国/ABI 7500 Fast)检测EGFR基因。
1.6统计学分析EGFR基因检测所得数据,应用SPSS 20.0软件进行统计学处理,各组间率比较应用χ2检验。以P<0.05有统计学意义。
2 结果
2.1胸水细胞蜡块中获取肿瘤细胞进行基因检测成功率比较30例胸水细胞蜡块用三种方法获取肿瘤细胞进行基因检测成功率比较,差异有统计学意义(χ2=7.912,P=0.019),常规切蜡膜法优于刀片刮取法(χ2=6.667,P=0.024),有6例细胞蜡块切片上肿瘤细胞和间皮细胞、淋巴细胞混杂,用刀片无法刮取;而常规切蜡膜法与激光显微切割法、激光显微切割法与刀片刮取法基因检测成功率,差异均无明显统计学意义(χ2=4.286,0.480,P>0.05,表1)。
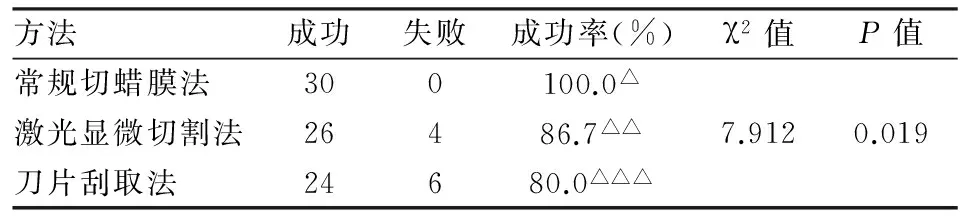
表1 胸水细胞蜡块中获取肿瘤细胞进行基因检测成功率比较(n=30)
△常规切蜡膜法与激光显微切割法相比,△△常规切蜡膜法与激光显微切割法相比,△△△激光显微切割法与刀片刮取法相比
2.2胸水细胞蜡块进行分类将血性胸水、肿瘤细胞大于30%的胸水、肿瘤细胞大于10%且小于30%的胸水标本、肿瘤细胞大于1%且小于10%的胸水标本、肿瘤细胞小于1%的胸水五组标本进行检测,其中前两组用三种方法获取肿瘤细胞EGFR检测成功率一致;肿瘤细胞大于10%且小于30%的胸水标本用刀片刮取法有1例未成功;肿瘤细胞大于1%且小于10%胸水标本用激光切割法和刀片刮取法均有2例未成功;小于1%的胸水标本组3例,用激光切割法仅1例成功。刀片刮取法均未成功(即肿瘤细胞小于10%胸水标本两组9例,用激光切割法和刀片刮取法只有5例和4例成功,表2)

表2 胸水细胞蜡块进行分类[n(%)]
Ⅰ:血性胸水;Ⅱ:肿瘤细胞大于30%的胸水;Ⅲ:肿瘤细胞大于10%且小于30%的胸水标本;Ⅳ:肿瘤细胞大于1%且小于10%的胸水标本;Ⅴ:肿瘤细胞小于1%的胸水标本
2.3三种方法获取胸水细胞蜡块中肿瘤细胞EGFR基因检测血性胸水、肿瘤细胞大于30%的胸水细胞蜡块组和大于10%且小于30%的细胞蜡块组,应用三种方法获取肿瘤细胞进行EGFR检测分别有2、2和3例阳性;但肿瘤细胞大于1%且小于10%的胸水细胞蜡块组使用常规切蜡膜法、激光显微切割法、刀片刮取法,EGFR基因检测阳性例数分别为1/6、2/4、2/4(表3,图2);肿瘤细胞小于1%的胸水细胞蜡块组,三种方法均未检测出EGFR阳性。

图2 三种方法获取肿瘤细胞进行EGFR基因检测阳性率比较

组织分类常规切蜡膜法阳性阴性激光显微切割法阳性阴性刀片刮取法阳性阴性Ⅰ2(8)62(8)62(8)6Ⅱ2(6)42(6)42(6)4Ⅲ3(7)43(7)43(6)3Ⅳ1(6)52(4)22(4)2Ⅴ0(3)30(1)10(0)0合计8(30)229(26)179(24)15
Ⅰ:血性胸水;Ⅱ:肿瘤细胞大于30%的胸水;Ⅲ:肿瘤细胞大于10%且小于30%的胸水标本;Ⅳ:肿瘤细胞大于1%且小于10%的胸水标本;Ⅴ:肿瘤细胞小于1%的胸水标本
3 讨论
随着胸水细胞蜡块技术的不断完善,胸水标本在肺癌EGFR基因检测中发挥越来越重要的作用,与手术标本和穿刺标本在病理诊断及基因检测等方面相比,具有创伤小、可以实时检测患者是否出现耐药基因或者查找其他药物敏感基因均无法替代的优势。
胸腹水脱落细胞检查是细胞病理学诊断的有效手段之一,但常规胸腹水涂片上肿瘤细胞量少,无法精确提供组织学来源,且不适用于免疫组化鉴别诊断。细胞蜡块技术不仅能够富集肿瘤细胞且多次取材,同时HE细胞无皱缩和变性,染色鲜艳,免疫组化标记染色理想,细胞蜡块可长期保存并反复切片,进行后续各种检测,大大提高细胞病理学诊断的敏感性和特异性[6]。
研究证实:EGFR体细胞突变对Gefitinib 和Erlotinib 药物治疗后的潜在临床反应起决定作用,EGFR-TKI结构域的前4个外显子(18~21)其中18、19、21外显子突变的患者对这两种药物的反应性更好[7-8],而20外显子突变使肿瘤细胞对EGFR-TKI产生抵抗,该突变主要见于EGFR-TKI治疗后复发者。2017年NCCN指南建议,对于EGFR-TKI治疗进展期的NSCLC患者在二线治疗前,推荐进行二次活检以明确EGFR-TKI耐药机制。因此临床医师针对进展期的肺癌患者更倾向于抽取胸水进行基因检测,以选择更有效的治疗方案。
胸水标本制成细胞蜡块行HE、免疫组化染色确诊为 NSCLC后,常规使用切蜡膜提取核酸进行EGFR基因检测。文献报道有高达12%的胸水标本出现间皮细胞与癌细胞难以鉴别并同时存在的状况[9],本实验证实:胸水细胞蜡块通过免疫组化抗体CK5/6和(或)CK7、TTF-1、Napsin A 表达以及WT1、Calretinin不表达,可明显区分肿瘤细胞和间皮细胞,并确定肿瘤细胞百分比。
本实验收集30例胸水标本中29例为肺腺癌,1例为腺鳞癌,有22例间皮细胞和肿瘤细胞并存的病例,8例血性胸水标本。参考《肺癌小标本取材相关问题的中国专家共识》及相关文献[10]将肺癌胸水标本分成血性胸水、肿瘤细胞大于30%的胸水、肿瘤细胞大于10%且小于30%的胸水标本、肿瘤细胞大于1%且小于10%的胸水标本、肿瘤细胞小于1%的胸水五组标本,用三种方法获取肿瘤细胞进行基因检测,其中在血性胸水、肿瘤细胞大于30%和大于10%且小于30%三组中,检测2、2和3例EGFR阳性;在肿瘤细胞小于1%的3例胸水标本中用刀片刮取法无法获取肿瘤细胞,激光显微切割法仅1例成功获取肿瘤细胞,用常规切蜡膜法3例成功,但均未检测出EGFR阳性;在肿瘤细胞大于1%且小于10%胸水标本有6例,使用激光显微切割法和刀片刮取法成功4例,进行基因检测均检测出2例EGFR阳性,核对患者信息,其中1例用三种方法获取肿瘤细胞基因检测阳性患者信息一致,另1例EGFR阳性的患者用激光显微切割法和刀片刮取法成功检测,而使用常规切蜡膜法未检测出EGFR阳性,由此推断在肿瘤细胞所含百分比小于10%的样本中用常规切蜡膜的方法,至少有1例未检测出EGFR阳性。
三种方法获取肿瘤细胞中,常规切蜡膜法适用于所有样本,而对于间皮细胞和肿瘤细胞混杂且肿瘤细胞含量小于1%的样本刀片刮取法无法完成;激光显微切割法也适用于所有样本,选用细胞数在200个以上,有4例由于提取核酸的量小于1 ng/μL未能成功检测,可能由于激光切割后,收集盖上的肿瘤细胞未能完全消化,核酸提取时损耗等方面原因,需要在后续的研究中针对收集盖上的肿瘤细胞消化时间、消化液浓度及核酸提取等流程进一步优化。
三种获取肿瘤细胞方法中以常规切蜡膜法最为简单,刀片刮取法次之,激光显微切割法操作步骤最为复杂,成本最高。对血性胸水、肿瘤细胞大于10%(包含大于30%和大于10%且小于30%胸水细胞蜡块)常规切蜡膜提取核酸比较方便;对成巢或成团的胸水细胞蜡块用刀片刮取法比较实用,在肿瘤细胞和间皮细胞混杂并且间皮细胞丰富、肿瘤细胞百分比小于1%胸水标本中激光显微切割法能获取散在、单个肿瘤细胞,比刀片刮取法更具有明显优势。
本实验进一步证实大于200个肿瘤细胞可用于EGFR基因检测,同时对血性胸水和肿瘤细胞大于10%的胸水细胞蜡块推荐使用切蜡膜法,刀片刮取法更加精确获取肿瘤细胞比较实用。对于肿瘤细胞小于10%的胸水细胞蜡块可以依据其特点选择刀片刮取法或激光显微切割法,本实验中基因检测成功率以及获取肿瘤细胞准确性方面推荐使用激光显微切割法。基因检测可以依据细胞蜡块以及组织标本特点,结合实验室条件选择获取肿瘤细胞最合适的方式,为临床精确治疗提供参考。
[1] 中华医学会呼吸病学分会, 中国肺癌防治联盟. 肺癌小标本取材相关问题的中国专家共识[J]. 中华内科杂志, 2016,55(5):406-413.
[2] Van der Heijden E H, Casal R F, Trisolini R,etal. Guideline for the acquisition and preparation of conventional and endobronchial ultrasound-guided transbronchial needle aspiration specimens for the diagnosis and molecular testing of patients with known or suspected lung cancer[J]. Respiration, 2014,88(6):500-517.
[3] Wahidi M M, Herth F, Yasufuku K,etal. Technical aspects of endobronchial ultrasound-guided transbronchial needle aspiration: CHEST guideline and expert panel report[J]. Chest, 2016,149(3):816-835.
[4] Thunnissen E, Kerr K M, Herth F J F,etal. The challenge of NSCLC diagnosis and predictive analysis on small samples. Practical approach of a working group[J]. Lung Cancer, 2012,76(1):1-18.
[5] 来茂德,丁 伟,丁华野, 等. 病理学高级教程[M]. 北京:人民军医出版社, 2013:967.
[6] 陈 晶,江 炜,李 雷,等. 改良快速胸水及腹水脱落细胞块制备的体会[J]. 临床与实验病理学杂志, 2014,30(9):1057-1058.
[7] Yoshida T, Ishii G, Goto K,etal. Solid predominant histology predicts EGFR tyrosine kinase inhibitor response in patients with EGFR mutation-positive lung adenocarcinoma[J]. Cancer Res Clin Oncol, 2013,139(10):1691-1700.
[8] Siegelin M D, Borczuk A C. Epidermal growth factor receptor mutations in lung adenocarcinoma[J]. Lab Invest, 2014,94(2):129-137.
[9] Imlay S P, Raab S S. Pleural fluid cytology: immunocytochemistry usage patterns and significance of nondefinitive diagnoses[J]. Diagn Cytopathol, 2000,22(5):281-285.
[10] Trisolini R, Cancellieri A, Tinelli C,etal. Randomized trial of endobronchial ultrasound-guided transbronchial needle aspiration with and without rapid on-site evaluation for lung cancer genotyping[J]. Chest, 2015,148(6):1430-1437.
