血清白介素-33与颈动脉粥样硬化斑块易损性的关系
2018-01-12卢非
卢非
临床研究证实,颈动脉粥样硬化易损斑块破裂、脱落所致的动脉栓塞是诱发缺血性卒中的独立危险因素[1-2]。因此,早期识别易损斑块对缺血性卒中的防治具有重要作用[3]。白细胞介素(interleukin,IL)-33是新近发现的IL,具有多种生物学活性。近年来研究显示,IL-33可通过调控Th1/Th2型免疫反应,抑制巨噬细胞源性泡沫细胞形成,发挥抗动脉粥样硬化作用[4]。但IL-33在颈动脉粥样硬化斑块易损性早期预测中的价值尚未明确。本研究旨在分析血清IL-33水平与颈动脉粥样硬化易损斑块的相关性,为临床提供参考。
1 对象与方法
1.1 研究对象 选取2015年1月-2016年1月广西科技大学第一附属医院神经内科收治的急性缺血性卒中住院患者133例,所有入组患者均经头颅计算机断层扫描(computed tomography,CT)和(或)磁共振成像(magnetic resonance imaging,MRI)明确诊断。患者或家属知情同意并签署知情同意书。本研究经医院伦理委员会审核批准。
纳入标准:①发病72 h内入院;②符合《中国急性缺血性卒中诊治指南(2014版)》中制定的缺血性卒中诊断标准[5];③成年患者;④能配合完成颈动脉超声检查者;⑤前循环卒中。排除标准:①合并恶性肿瘤、感染性疾病、自身免疫性疾病或近3个月内应用免疫抑制剂者;②心、肝、肾等脏器功能不全者;③心源性栓塞、肿瘤、动脉瘤或脑血管畸形等所引发的缺血性卒中。
1.2 方法
1.2.1 资料收集 本研究采用前瞻性病例对照法,相关信息由统一培训的调查员进行收集。调查问卷包括年龄、性别、吸烟史(每天吸卷烟1支以上,连续或一年内累计6个月)、饮酒史(折合乙醇125 ml/d或白酒约150 g/d,或啤酒>每日4瓶,持续6~10年)、疾病史(高血压病[6]、冠状动脉粥样硬化性心脏病[7]、糖尿病[8])等。
1.2.2 颈动脉超声检查 患者取平卧位,采用美国GE-LOGZQ5彩色多普勒超声仪,将探头频率设定为7.5 MHz,沿颈动脉走向,自下而上进行连续的纵、横切面扫描双侧颈总动脉、颈外动脉、颈内动脉,将管腔内膜交界面至中膜与外膜交界面之间的垂直距离定为颈动脉内膜中层厚度(intimamedia thickness,IMT):IMT<1.0 mm为正常;1.5 mm≥IMT≥1.0 mm为内膜增厚;IMT>1.5 mm为动脉粥样硬化斑块形成[9]。根据颈动脉斑块回声鉴别斑块稳定性:强回声斑块为稳定斑块;等回声、低回声、混合回声和溃疡斑块为易损斑块[10]。只要有1个易损斑块即归入易损斑块组。所有颈动脉超声检查均由同一名具备10年以上临床经验的超声科医师操作。
1.2.3 血液生化检查 抽取患者清晨空腹肘正中静脉血5 ml,常规分离血清,采用日立7600生化自动分析仪检测血清三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、空腹血糖(fasting plasma glucose,FPG)、餐后2 h血糖(2 h plasma glucose,2 h PG);采用高压液相亲和层析法检测糖化血红蛋白(hemoglobin A1c,HbA1c);采用酶联免疫吸附测定(enzymelinked immuno sorbent assay,ELISA)法检测血清IL-33。
1.2.4 血压监测 于晨起1 h内,采用臂式电子血压计测量患者收缩压(systolic blood pressure,SBP)和舒张压(diastolic blood pressure,DBP)。
1.3 统计学方法 采用SPSS 20.0进行统计学分析。计数资料用率表示,组间比较用χ2检验。符合正态分布的计量资料用表示,多组间均数比较用单因素方差,组间多重比较用LSD-t检验;对斑块是否稳定的影响因素分析采用Logistic二分类回归分析;相关性分析采用Pearson相关;P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 研究共入组133例患者,其中男76例,女57例;年龄44~89岁,平均年龄(69.8±13.2)岁。根据颈动脉超声检查结果分为无斑块组36例、稳定斑块组45例、易损斑块组52例。3组性别、吸烟、饮酒、高血压、冠状动脉粥样硬化性心脏病、糖尿病、SBP、DBP、TG、TC、HDL-C、LDL-C、FPG比较差异无显著性。3组年龄、2 h PG、HbA1c、血清IL-33、IMT比较差异有显著性,其中无斑块组年龄(P=0.037、P=0.041)、2 h PG(P=0.032、P=0.028)、HbA1c(P=0.035、P=0.039)、IMT(P=0.030、P=0.024)低于稳定斑块和易损斑块组,而血清IL-33高于后两组(P=0.025、0.037);易损斑块组IMT高于稳定斑块组(P=0.036),血清IL-33低于稳定斑块组(P=0.033)(表1)。
2.2 Logistic回归分析 选取有颈动脉斑块的患者,以动脉粥样硬化斑块是否稳定为因变量,以年龄、2 h PG、HbA1c、IMT、IL-33为自变量进行二分类Logistic逐步回归分析,结果显示:较高的年龄、2 h PG、HbA1c、IMT以及较低的IL-33为颈动脉粥样硬化斑块易损的危险因素(表2)。

表1 各组临床指标比较
2.3 血清IL-33与颈动脉粥样硬化危险因素的相关性分析 血清IL-33水平与IMT呈负相关(r=-0.336,P<0.001),与年龄、2 h PG、HbA1c无相关性(r值分别为-0.014、0.072、0.080,P值分别为0.292、0.206、0.421)。
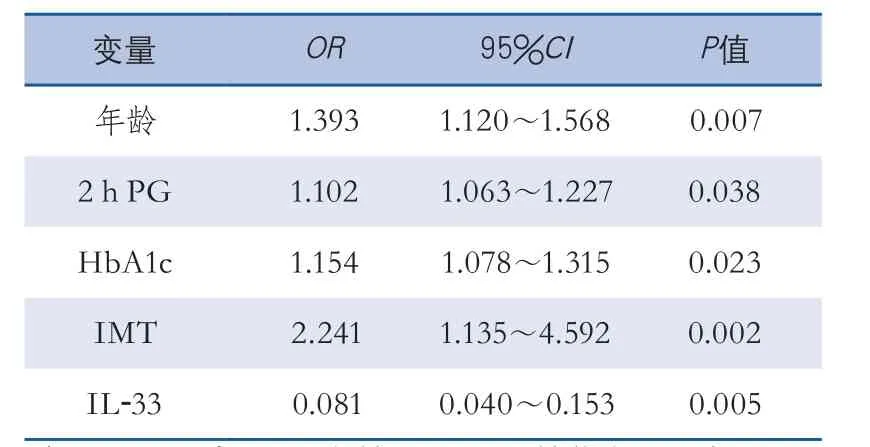
表2 颈动脉粥样硬化斑块易损性的Logistic回归分析
3 讨论
传统观念认为,颈动脉粥样硬化斑块所致的颈动脉狭窄是引起缺血性卒中的主要原因。本研究结果显示,随着颈动脉粥样硬化斑块不稳定性的增加,血清IL-33水平显著降低,与于磊等[11]研究结论一致,提示IL-33参与了颈动脉粥样硬化斑块的形成与发展。临床实践发现,部分颈动脉狭窄>70%患者由于侧支循环代偿良好并未表现出临床症状,而部分颈动脉狭窄<50%患者亦可发生严重缺血性卒中事件,提示颈动脉狭窄并非缺血性卒中的决定性因素[12]。越来越多的证据表明,易损斑块破裂所致的血小板聚集、血栓形成与急性脑血管病事件密切相关,由其引发的脑血管病事件远远多于单纯颈动脉狭窄[13]。因此,探寻颈动脉粥样硬化斑块的发生机制,明确斑块性质的早期鉴别方法是临床亟待解决的热点及难点问题。
IL-33可通过与特异性功能配体抑癌蛋白2(Suppression of Tumorigenicity 2,ST2)相结合来介导多种生物学反应[14]。在动脉粥样硬化过程中,Th1免疫亢进所致的慢性炎症反应是促进斑块性质改变的关键[15]。动物实验表明,注射外源性IL-33可诱导载脂蛋白E(apolipoprotein E,ApoE)缺失的动脉粥样硬化模型小鼠体内Th1细胞转变为Th2细胞,抑制主动脉粥样硬化斑块形成,而注射可溶性ST2则可促进主动脉粥样硬化斑块形成,说明IL-33具有抗动脉粥样硬化的作用,而调控IL-33/ST2信号通路是其主要作用机制[16]。此外,体外研究发现,IL-33可减少巨噬细胞对乙酰化低密度脂蛋白(acetylate low-density lipoprotein,ac-LDL)和氧化修饰低密度脂蛋白(oxidized low density lipoprotein,ox-LDL)的摄取,同时促进胆固醇外流,从而抑制巨噬细胞源性泡沫细胞的形成,进而阻碍动脉粥样硬化斑块的发生与发展[17]。本研究结果显示,IL-33与IMT呈负相关,且血清IL-33水平降低是影响颈动脉粥样硬化斑块稳定性的独立危险因素,究其原因可能与IL-33表达下调,机体抗动脉粥样硬化效应减弱有关。
综上所述,IL-33参与颈动脉粥样硬化的发生与发展,其血清表达水平是反映颈动脉粥样硬化斑块易损性的可靠指标,也是颈动脉粥样硬化斑块易损性的预测因素。但由于本研究纳入样本量相对较少,故研究结论可能存在一定局限性,仍有待多中心、大样本研究的进一步证实。
1 Kadoglou NP,Lambadiari V,Gastounioti A,et al. The relationship of novel adipokines,RBP4 and omentin-1,with carotid atherosclerosis severity and vulnerability[J]. Atherosclerosis,2014,235(2):606-612.
2 Van Dijk AC,Truijman MT,Hussain B,et al.Intraplaque hemorrhage and the plaque surface in carotid atherosclerosis:the plaque at risk study(PARISK)[J]. AJNR Am J Neuroradiol,2015,36(11):2127-2133.
3 崔豹,马露,曾源,等. 老年高血压患者颈动脉易损斑块与近期缺血性脑卒中的相关性[J]. 中华老年心脑血管病杂志,2013,15(12):1245-1248.
4 Willems S,Hoefer I,Pasterkamp G. The role of the Interleukin 1 receptor-like 1 (ST2) and Interleukin-33 pathway in cardiovascular disease and cardiovascular risk assessment[J]. Minerva Med,2012,103(6):513-524.
5 中华医学会神经病学分会. 中国急性缺血性脑卒中诊治指南2014[J]. 中华神经科杂志,2015,48(4):246-257.
6 刘力生. 中国高血压防治指南2010[J]. 中华心血管病杂志,2011,39(7):579-616.
7 Zhong Y,Wang N,Xu H,et al. Ischemia-modi fied albumin in stable coronary atherosclerotic heart disease:clinical diagnosis and risk strati fication[J]. Coronary Artery Disease,2012,23(8):538-541.
8 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2013年版)[J]. 中华内分泌代谢杂志,2014,30(10):893-942.
9 徐雄鹰,周蓉靖,白春峰,等. H型高血压合并急性脑梗死患者血浆同型半胱氨酸水平与颈动脉内膜中层厚度的关系[J]. 中华高血压杂志,2015,2(4):383-386.
10 崔豹,马露,曾源,等. 颈动脉血管重构与斑块稳定性关系的研究[J]. 中华老年心脑血管病杂志,2015,17(4):375-378.
11 于磊,李振. 白细胞介素33在脑血管病患者血清中的表达及其作用机制[J]. 山东大学学报:医学版,2015,53(4):75-79.
12 成勇,李朝武,涂明义,等. 血同型半胱氨酸水平对判断颈动脉粥样硬化斑块易损性的意义[J]. 神经损伤与功能重建,2010,5(1):30-31.
13 刘国荣,姚林,王大力. 颈动脉粥样硬化斑块易损性的临床研究进展[J]. 中华老年心脑血管病杂志,2012,14(7):778-780.
14 Peine M,Marek RM,Lohning M. IL-33 in T cell differentiation,function,and immune homeostasis[J].Trends Immunol,2016,37(5):321-333.
15 Shibata Y,Ohata H,Yamashita M,et al. Immunologic response enhances atherosclerosis-type 1 helper T cell(Th1)-to-type 2 helper T cell (Th2) shift and calci fied atherosclerosis in Bacillus Calmette-Guerin (BCG)-treated apolipoprotein E-knockout (apo E-/-) mice[J].Transl Res,2007,149(2):62-69.
16 Miller AM,Xu D,Asquith DL,et al. IL-33 reduces the development of atherosclerosis[J]. J Exp Med,2008,205(2):339-346.
17 Mclaren J E,Michael D R,Salter R C,et al. IL-33 reduces macrophage foam cell formation[J]. J Immunol,2010,185(2):1222-1229.
【点睛】白介素-33(interleukin-33,IL-33)参与颈动脉粥样硬化的发生与发展,其血清水平是反映颈动脉粥样硬化斑块易损性的可靠指标,血清IL-33水平降低是影响颈动脉粥样硬化斑块稳定性的独立危险因素。
