Enterprise支架治疗复杂症状性颅内动脉粥样硬化性狭窄
2018-01-12刘恋马宁莫大鹏高峰徐晓彤宋立刚孙瑄王博霍晓川缪中荣
刘恋,马宁,莫大鹏,高峰,徐晓彤,宋立刚,孙瑄,王博,霍晓川,缪中荣
颅内大血管粥样硬化性狭窄(intracranial atherosclerotic stenosis,ICAS)是造成卒中的重要原因,同时也是卒中再发的重要原因,特别是对于黄种人,黑人和西班牙人[1-3]。介入治疗ICAS是一项有前景的技术。不过,颅内动脉狭窄支架对比积极药物治疗(Stenting versus Aggressive Medical Therapy for Intracranial Arterial Stenosis,SAMMPRIS)研究[4]显示应用Wingspan自膨式支架治疗ICAS的围手术期终点事件发生率远高于单纯强化药物治疗(14.7%vs 5.8%,P=0.002);而VISSIT支架治疗缺血性卒中研究(VISSIT Intracranial Stent Study for Ischemic Therapy,VISSIT)[5]则提示应用球囊扩张式支架治疗ICAS相对于单纯强化药物治疗具有更高的围手术期并发症发生率(24.1% vs 9.4%,P=0.05)。尽管这两个临床试验都不支持支架治疗ICAS,但最近我国缪中荣等[6-7]进行的多中心登记研究表明,对于高选择性的症状性ICAS,介入治疗的风险较低(4.3%),不过,该研究排除了复杂ICAS。
复杂ICAS是指病变血管路径血管迂曲,病变较长(>15 mm),接近血管分叉或者合并狭窄段动脉瘤。介入治疗复杂ICAS在技术上具有很大挑战性。本文回顾性研究了应用Enterprise支架治疗复杂ICAS的安全性和有效性。
1 研究方法
1.1 研究对象 回顾性收集2014年1月-2016年6月首都医科大学附属北京天坛医院介入神经病学科收治的经亚满意球囊扩张+Enterprise支架治疗的复杂症状性ICAS患者资料。介入治疗前,患者和家属均签署了知情同意书。
纳入标准:①颅脑数字减影血管造影(digital subraction angiography,DSA)显示颅内动脉狭窄>70%[华法林-阿司匹林治疗症状性颅内动脉疾病(Warfarin and Aspirin for Symptomatic Intracranial Disease,WASID)标准][8];②尽管在加强药物治疗(双联抗血小板和他汀类药物)的情况下,仍有与靶血管相关的短暂性脑缺血发作(transient ischemic attack,TIA)或者卒中反复发作;③计算机断层扫描灌注成像(computed tomography perfusion,CTP)显示靶血管供血区存在低灌注[脑血流量(cerebral blood flow,CBF)和(或)脑血流容量(cerebral blood volume,CBV)异常];④改良Rankin量表(modified Rankin scale,mRS)<3分;⑤至少存在一个动脉粥样硬化的危险因素(高血压,糖尿病,高脂血症和吸烟);⑥狭窄病变长度>15 cm、接近血管分叉、入路血管迂曲、合并狭窄附近动脉瘤形成。
排除标准:①非动脉粥样硬化性狭窄;②患者的症状不是由血栓栓塞或者低灌注引起(包括穿支卒中):③6周内发生过颅内出血;④心源性栓塞;⑤已知的肝素、阿司匹林、氯吡格雷、麻醉药物或者造影剂的禁忌证;⑥血小板计数<100 000/μl;⑦国际标准化比值>1.5和不可纠正的出血倾向;⑧不同意介入治疗。
1.2 介入治疗 所有治疗均在全身麻醉下进行,经股动脉入路置入6F动脉鞘。所有患者治疗过程中均应用全身肝素化。根据入路血管的直径,经鞘置入6F或者5F Envoy导引导管(Cordis)至椎动脉V2段或者颈内动脉C1-C2段,然后对靶血管进行双C臂造影机(Artis zee Biplane;Siemens)造影,评估靶血管狭窄部位的长度和直径以及附近正常管腔的直径。路径图下,常规微导丝(Transcend-0.014,205 cm,Stryker)携带微导管(Echlon-10,EV3)技术通过病变到达血管远端或者分支,撤出微导丝进行微量造影,确保微导管位于血管真腔内。然后应用交换微导丝(Transcend-0.014,300 cm,Stryker)通过微导管进入狭窄远端血管腔内,交换撤出微导管。通过微交换导丝将Gateway球囊(Stryker)到达狭窄部位进行球囊扩张后撤出球囊导管,经交换导丝进入0.021英寸微导管(Prowler Select Plus,Codman),Enterprise支架通过该微导管置入狭窄区域。支架置入后,立即对靶血管进行血管造影评估残余狭窄。如果患者合并狭窄附近的动脉瘤则进行弹簧圈栓塞治疗。
1.3 围手术期处理 手术前至少30 d应用阿司匹林(100 mg)+氯吡格雷(75 mg)。支架术后即进行头颅CT扫描除外出血并发症。阿司匹林(100 mg/d)和氯吡格雷(75 mg/d)连续服用6个月,然后改为阿司匹林100 mg/d,终身服用。用药可根据随访情况进行调整。如果术后CT除外脑出血,术后应用3 d低分子肝素钙。对于危险因素控制,患者收缩压控制在140/90 mmHg以下(如果合并糖尿病,则应控制于130/80 mmHg以下),低密度脂蛋白<70 mg/dl(1.81 mmol/L)或者降低50%,戒烟以及生活方式调整。
1.4 结局评价 主要终点事件定义为支架术后30 d内任何卒中(包括出血性和缺血性)、TIA或者死亡。次要终点事件为成功血管成形;随访期内DSA或者计算机断层扫描血管造影(computed tomography angiography,CTA)证实的>50%的支架内再狭窄或者靶血管供血区发生的TIA或者卒中。如果怀疑有新的卒中发生,则需要进行CT或者磁共振成像(magnetic resonance imaging,MRI)进行证实。
成功血管成形被定义为支架准确释放,完全覆盖狭窄病变且残余狭窄<40%。出血性卒中被定义为CT证实的蛛网膜下腔、脑实质和脑室内的出血,无论是否有症状。
1.5 随访 30 d内的临床随访信息由两位医师进行面对面或者电话采集。影像学复查被安排在3~6个月及12个月,应用CTA或者DSA进行。需要两名医师阅片并协商决定再狭窄率。
此前各地猪瘟消息频发,疫情逐步向南扩散,情况较为严峻,养殖户补栏意愿低迷。但考虑到生猪养殖周期为10个月,猪瘟造成的补栏意愿低,豆粕需求不振需要一定的时间才能体现。换而言之,由于猪瘟周期较长,短期内对豆粕需求影响有限,但长期或对明年年底豆粕需求有所影响。
2 结果
2.1 临床/影像学特点 研究期间共收治了563例重度ICAS患者。其中,539例患者进行了支架治疗,其中24例符合入组标准的患者应用了Enterprise支架治疗。
纳入的24例患者中,年龄48~78岁,平均(61.0±8.3)岁,17例为男性(70.8%)。10例(41.7%)为TIA,14例(58.3%)表现为靶血管供血区域的卒中。支架治疗与首次发病间隔平均2个月(1~4.8个月)。合并高血压病20例(83.3%),糖尿病10例(41.7%),吸烟史11例(45.8%)。
CTP显示,24例患者(100%)均存在CBF降低。狭窄病变的形态包括0个(0%)Mori A型病变(0%),9个(37.5%)Mori B型病变以及15个(62.5%)Mori C型病变。入路分型4个(25.0%)为LMAⅠ型,29.2%为LMAⅡ型,49.8%为LMAⅢ型。4例(16.7%)患者合并狭窄段动脉瘤。病变部位位于基底动脉11例(45.8%),椎动脉V4段9例(37.5%),颈内动脉末端2例(8.3%),大脑中动脉2例(8.3%)。2例(8.3%)患者为完全闭塞病变,其中1例位于颈内动脉末端,另一例位于基底动脉。病变长度平均为(14.8±5.4)mm。
2.2 主要/次要结局以及随访 入组患者中,1例(4.2%)发生主要终点事件,表现为无症状蛛网膜下腔出血(subarachnoid hemorrhage,SAH)。考虑原因是微导丝行走过程中发生的M3穿破。本组患者中没有缺血性并发症发生。
2 4例患者手术均获得成功(10 0%)。Enterprise支架置入前应用球囊进行亚满意扩张,其中15例(62.5%)患者应用1.5~2.0 mm的球囊,9例(37.5%)应用2.25~2.75 mm球囊。支架置入前后的血管狭窄率分别为(87.1±9.3)%和(17.5±8.7)%。6个月随访期内,24例患者均获得临床随访结果,共有18例患者获得影像学随访结果,其中有6例发生支架内再狭窄。4例患者为症状性再狭窄,包括1例卒中和3例TIA。3例TIA患者应用球囊进行支架内再扩张,1例再发卒中患者由于靶血管完全闭塞而未进行再次治疗。6例发生再狭窄的患者中,5例为Mori C型病变,1例为Mori B型病变。
4例合并动脉瘤的患者中,3例患者同时进行了动脉瘤栓塞术,1例患者动脉瘤为梭形动脉瘤,未进行栓塞而仅应用Enterprise支架覆盖。2例闭塞病变患者成功进行了血管再通和支架置入,未发生并发症(表1~2)。
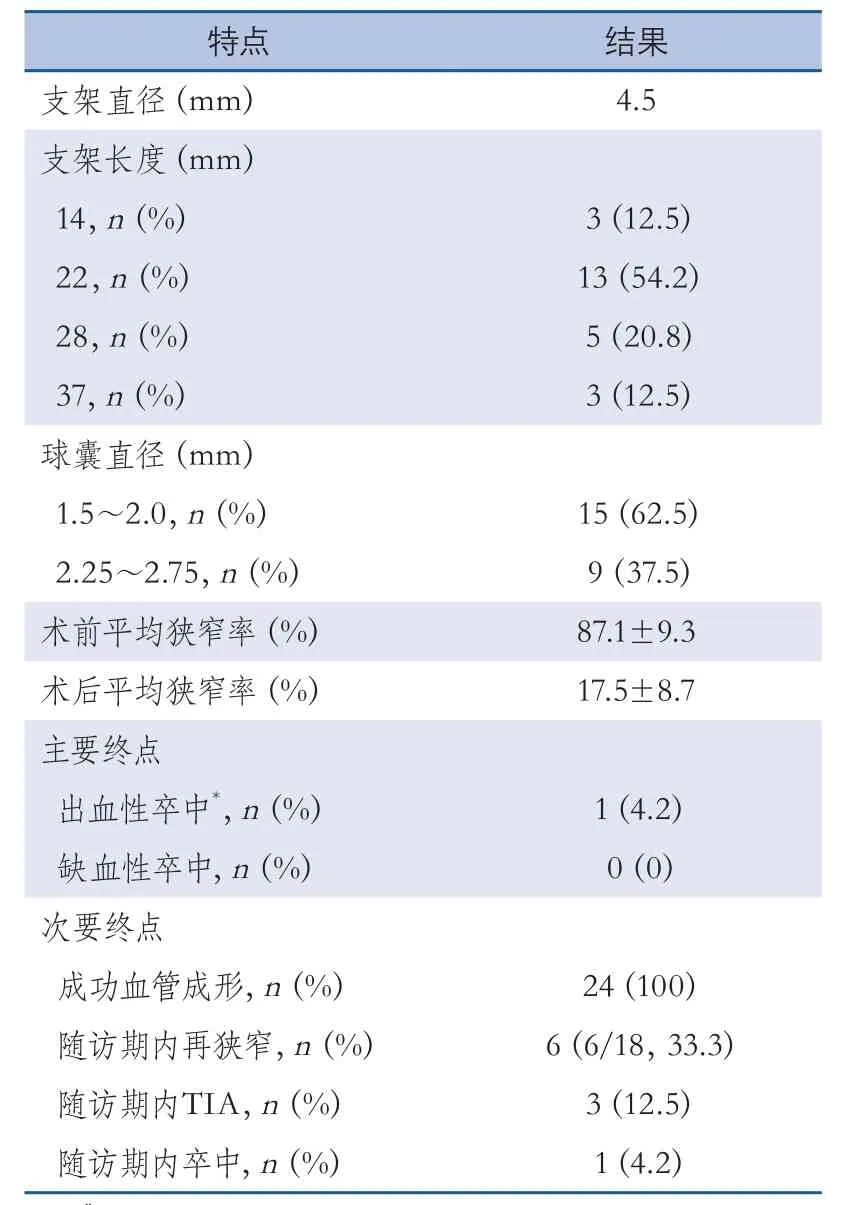
表1 支架特点及终点事件
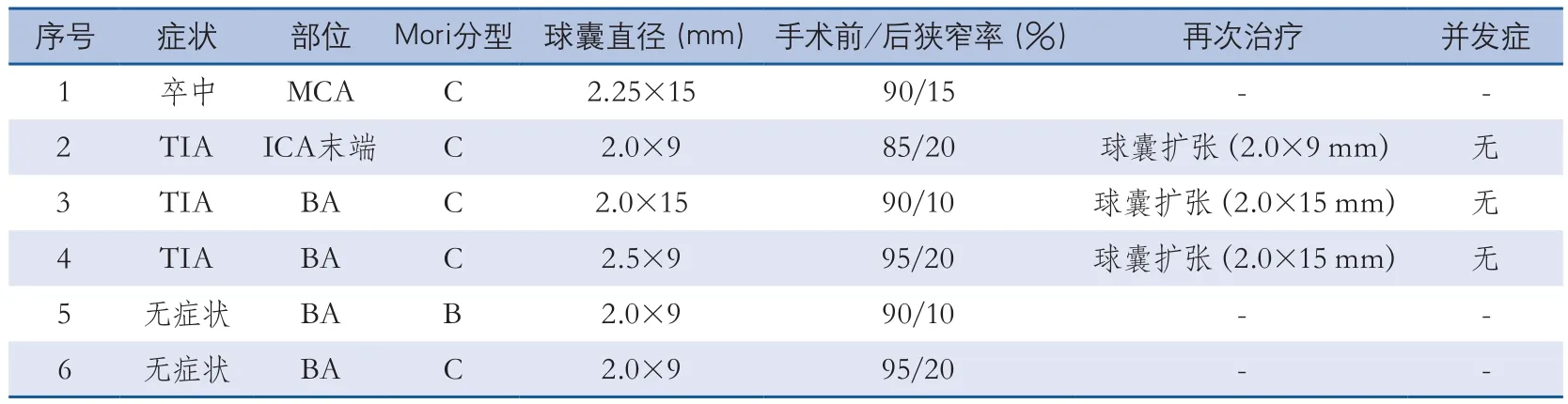
表2 DSA证实的6例再狭窄患者特点
3 讨论
该研究显示,对于复杂症状性ICAS,亚满意球囊扩张后Enterprise支架置入具有较高的安全性和较低的并发症,及可接受的远期再狭窄率。
根据临床经验,对于治疗复杂IC A S,Wingspan支架系统存在以下几个缺点:较强的径向支撑力导致支架在迂曲的血管内输送和释放困难;支架系统的橄榄形头端可能造成远端血管或者穿支撕裂;支架的开环设计有可能导致在迂曲的病变释放后出现支架系统回撤困难等。而Apollo支架是球囊扩张式设计,较之Wingspan支架支撑力更强,所以仅适合于较短和较直的病变[7,12]。另外应用球囊扩张式支架可能更容易导致穿支事件的发生,而自膨式支架在富穿支的血管中释放可能更有优势[13]。基于以上原因,两种支架都不适合治疗复杂ICAS。
Enterprise支架的输送系统是设计用来辅助动脉瘤栓塞的。该系统易于输送至远端血管。本组患者获得100%的技术成功,这与以前一些关于Enterprise支架的研究是吻合的[14-16]。Enterprise支架是微导管输送,具有良好的到位性能,这是该组手术具有高成功率的主要原因。另外,Enterprise支架的径向支撑力要低于其他两种支架[17],所以更容易在迂曲的血管中输送和释放。
虽然本组患者的病变具有较高的技术难度,但本组主要终点事件的发生率仅为4.2%,远低于SAMMPRIS和VISSIT试验。考虑原因如下:①Enterprise支架及其输送系统的优点。②本研究中支架成形术的时间与患者首次发病的时间间隔平均为2个月,这比两个试验的时间要长,SAMMPRIS试验为7 d,VISSIT试验为9 d[4-5]。发生TIA或者卒中复发通常为首次发病最初的几周[18]。③术者均为5年以上颅内操作经验的医师。④除外了从介入手术中不能获益的穿支闭塞的患者。⑤应用了亚满意球囊扩张,可能对血管内皮及穿支动脉损伤更小。
除了围手术期并发症较高,ICAS支架的另一个问题是再狭窄。对于Wingspan支架,既往报道的再狭窄率从7.5%~31.2%不等[9-10,19],而Apollo支架再狭窄率为28%[20]。本组再狭窄率为33.3%,略高于既往报道。血管内皮的过度增生是再狭窄的主要原因,这可能和球囊扩张后的内皮损伤、支架释放后血管内皮的炎性反应有关[21]。在支架辅助动脉瘤栓塞的患者中也存在一定的再狭窄率[22-23],而这些患者不存在粥样硬化基础也没有球囊扩张,提示血管内皮对支架的反应过度是再狭窄的重要因素。既往文献报道了Wingspan支架后再狭窄的一些相关危险因素:年轻患者,前循环病变,快速球囊扩张,残余狭窄以及病变较长等[24]。本组的6例再狭窄患者中,5例为Mori C型病变,1例Mori B型病变,病变相对较长且迂曲,可能是再狭窄发生的重要因素。另外,我们仅获得了18个影像学随访,其余无症状患者拒绝复查,这也可造成再狭窄率被高估。
目前缺乏颅内动脉支架后再狭窄导致卒中的确切数据,但颅外段颈动脉再狭窄后导致的卒中发生率较低[25]。这可能是由于支架术后6个月内的再狭窄主要是由于内皮增生导致,而不是动脉粥样硬化的进展。本组再狭窄患者中,只有1例(4.2%)发生卒中,而另外3例表现为低灌注造成的TIA。
综上所述,本研究显示,对于复杂ICAS,亚满意球囊扩张+Enterprise支架置入技术可行,且并发症发生率较低,再狭窄率可以接受。导管输送的支架可能提高围手术期安全性。但仍需要更多的随机临床研究数据来证实。
1 Arenillas JF. Intracranial atherosclerosis:current concepts[J]. Stroke,2011,42(1)(suppl):S20-S23.
2 Wong KS,Li H. Long-term mortality and recurrent stroke risk among Chinese stroke patients with predominant intracranial atherosclerosis[J]. Stroke,2003,34(10):2361-2366.
3 Kasner SE,Chimowitz MI,Lynn MJ,et al. Warfarin Aspirin Symptomatic Intracranial Disease Trial Investigators. Predictors of ischemic stroke in the territory of a symptomatic intracranial arterial stenosis[J]. Circulation,2006,113(4):555-563.
4 Chimowitz MI,Lynn MJ,Derdeyn CP,et al. Stenting versus aggressive medical therapy for intracranial arterial stenosis[J]. N Engl J Med,2011,365(11):993-1003.
5 Zaidat OO,Fitzsimmons BF,Woodward BK,et al. Effect of a balloon-expandable intracranial stent vs medical therapy on risk of stroke in patients with symptomatic intracranial stenosis:the VISSIT randomized clinical trial[J]. JAMA,2015,313(12):1240-1248.
6 Miao Z,Zhang Y,Shuai J. Study Group of Registry Study of Stenting for Symptomatic Intracranial Artery Stenosis in China:Thirty-Day Outcome of a Multicenter Registry Study of Stenting for Symptomatic Intracranial Artery Stenosis in China[J]. Stroke,2015,46(10):2822-2829.
7 Wang Y,Miao Z,Wang Y,et al. Protocol for a prospective,multicentre registry study of stenting for symptomatic intracranial artery stenosis in China[J].BMJ open,2014,4(8):e005175.
8 Chimowitz MI,Lynn MJ,Howlett-Smith H,et al.Comparison of warfarin and aspirin for symptomatic intracranial arterial stenosis[J]. N Engl J Med,2005,352(13):1305-1316.
9 Bose A,Hartmann M,Henkes H,et al. A novel,self-expanding,nitinol stent in medically refractory intracranial atherosclerotic stenoses:the Wingspan study[J]. Stroke,2007,38(5):1531-1537.
10 Zaidat OO,Klucznik R,Alexander MJ,et al. The NIH registry on use of the Wingspan stent for symptomatic70-99% intracranial arterial stenosis[J].Neurology,2008,70(17):1518-1524.
11 Zhang L,Huang Q,Zhang Y,et al. Wingspan stents for the treatment of symptomatic atherosclerotic stenosis in small intracranial vessels:safety and ef ficacy evaluation[J]. AJNR Am J Neuroradiol,2012,33(2):343-347.
12 Liu L,Zhao X,Mo D,et al. Stenting for symptomatic intracranial vertebrobasilar artery stenosis:30-day results in a high-volume stroke center[J]. Clin Neurol Neurosurg,2016,143:132-138.
13 Silber T,Ziemann U,Ernemann U,et al. Analysis of peri-interventional complications of intracranial angioplasty and stenting:A single center experience[J].Eur J Radiol,2014,83(12):2190-2195.
14 Vajda Z,Schmid E,Güthe T,et al. The modi fied Bose method for the endovascular treatment of intracranial atherosclerotic arterial stenoses using the Enterprise stent[J]. Neurosurgery,2012,70(1):91-101.
15 Feng Z,Duan G,Zhang P,et al. Enterprise stent for the treatment of symptomatic intracranial atherosclerotic stenosis:an initial experience of 44 patients[J]. BMC Neurol,2015,15(1):1-7.
16 Lee KY,Chen DYT,Hsu HL,et al. Undersized angioplasty and stenting of symptomatic intracranial tight stenosis with Enterprise:Evaluation of clinical and vascular outcome[J]. Interv Neuroradiol,2015,30(4):325-331.
17 Krischek Ö,Miloslavski E,Fischer S,et al. A comparison of functional and physical properties of self-expanding intracranial stents [J]. Minim Invasive Neurosurg,2011,54(1):21-28.
18 Gulli G,Marquardt L,Rothwell PM,et al. Stroke risk after posterior circulation stroke/transient ischemic attack and its relationship to site of vertebrobasilar stenosis pooled data analysis from prospective studies[J]. Stroke,2013,44(3):598-604.
19 Albuquerque FC,Levy EI,Turk AS,et al.Angiographic patterns of Wingspan in-stent restenosis[J]. Neurosurgery,2008,63(1):23-27.
20 Jiang WJ,Xu XT,Jin M,et al. Apollo stent for symptomatic atherosclerotic intracranial stenosis:study results[J]. AJNR Am J Neuroradiol,2007,28(5):830-834.
21 Schwartz RS,Henry TD. Pathophysiology of coronary artery restenosis[J]. Rev Cardiovasc Med,2002,3(3 suppl):S4-9.
22 Fargen KM,Hoh BL,Welch BG,et al. Long-term results of Enterprise stent-assisted coiling of cerebral aneurysms[J]. Neurosurgery,2012,71(2):239-244.
23 Fiorella D,Albuquerque FC,Woo H,et al. Neuroform in-stent stenosis:incidence,natural history,and treatment strategies[J]. Neurosurgery,2006,59(1):34-42.
24 Turk AS,Levy EI,Albuquerque FC,et al. In fl uence of patient age and stenosis location on Wingspan in-stent restenosis[J]. ANJR,2008,29(1):23-27.
25 Lal BK,Beach KW,Roubin GS,et al. Restenosis after carotid artery stenting and endarterectomy:a secondary analysis of CREST,a randomised controlled trial[J].Lancet Neurol,2012,11(9):755-763.
【点睛】由于Enterprise支架固有优点,亚满意球囊扩张+Enterprise支架置入治疗复杂的颅内动脉狭窄有其优势,但是其治疗后再狭窄率可能需要大样本观察。
