糖调节异常对缺血性卒中患者脑组织毛细血管渗透性和出血转化的影响
2018-01-12贾茜赵性泉王辉郑华光王伊龙王拥军
贾茜,赵性泉,王辉,郑华光,王伊龙,王拥军
笔者前期研究发现,急性缺血性卒中住院患者中糖调节异常的患病率高[1],而且,合并糖调节异常的卒中患者临床结局较差[2]。糖尿病(diabetes mellitus,DM)被发现是缺血性卒中患者脑缺血组织发生出血转化(hemorrhagic transformation,HT)的独立危险因素[3]。已知伴有高血糖的患者缺血脑组织血脑屏障破坏较血糖正常者更严重,血脑屏障破坏造成脑组织毛细血管渗透性增加,可能是缺血性卒中后发生HT的重要原因[4]。计算机断层扫描灌注成像(computed tomography perfusion,CTP)和渗透性表面彩图叠加处理是一项新的影像学技术,能对脑缺血组织的毛细血管渗透性进行定量评价[5]。目前国内尚未有应用此项影像技术来评价合并糖调节异常的急性缺血性卒中患者缺血区毛细血管渗透性变化特点的报道。本研究对全部患者进行CTP并测量低灌注区及梗死区渗透性表面(permeability surface,PS)定量,同时利用磁共振梯度回波序列或计算机断层扫描(computed tomography,CT)平扫对脑梗死患者进行HT的识别,力求阐明DM和糖调节受损(impaired glucose regulation,IGR)对缺血性卒中患者脑组织毛细血管渗透性以及HT的影响。
1 对象与方法
1.1 研究对象 前瞻性连续入组2014年1月-2015年12月在首都医科大学附属北京天坛医院神经病学中心卒中单元住院治疗的急性缺血性卒中患者。
入组标准:①急性缺血性卒中根据世界卫生组织诊断标准并经头颅磁共振成像(magnetic resonance imaging,MRI)或头颅CT平扫确诊;②发病至入院时间14 d内;③年龄18~80岁[6]。
本研究通过首都医科大学附属北京天坛医院伦理委员会批准,所有参与研究患者或法定代表人均签署知情同意书。
1.2 资料收集及随访 入院24 h内记录患者基线资料和既往病史,如性别、年龄、DM病史、高血压病史、脂代谢紊乱病史等,入院后首次美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)、改良Rankin量表评分(modified Rankin Scale,mRS)、入院首次空腹血糖等。出院前记录患者住院期间用药情况。
对全部患者在发病(14±3)d进行面对面访问或电话随访(已出院者),记录患者的mRS评分、卒中复发以及各种原因引起的死亡和卒中相关性死亡等事件。
1.3 糖调节异常诊断标准 全部患者中既往无糖尿病病史或病史不详者均在发病后(14±3)d接受口服葡萄糖耐量试验(oral glucose tolerance test,OGTT)。根据OGTT结果进行糖调节异常类型的诊断,糖调节异常的诊断标准参考世界卫生组织公布的诊断标准进行[7]。
1.4 研究分组 根据OGTT结果,将患者分为糖尿病组(DM组)、糖调节受损组(IGR组)(包括空腹血糖受损和糖耐量受损)、糖调节正常(NGR组)共三组。
1.5 影像资料的收集和处理 全部患者于发病14 d内完成头颅CTP,在CTP完成后1周内完成头颅磁共振梯度回波序列或头颅CT平扫,由两位资深神经影像科医师背对背进行头颅CT灌注图像处理并得出PS叠加彩图和PS值,以及出血转化的有无、数量以及部位。脑组织毛细血管渗透性测定点的选择:参照LIN等[5]的方法,对每例患者,在梗死区,即脑血容量(cerebral blood volume,CBV)升高区,选择两处兴趣点,每点画出直径为1 cm的圆形区域,测算出PS值[ml/(100 ml·min)],取两兴趣点PS值的平均值,作为该梗死区的PS值;同时能够自动得到对侧半球与兴趣点对称的两点的PS值,取其平均值作为对照组PS值。在低灌注区,即达峰时间(time to peak,TTP)和CBV不匹配区,同样选择两处兴趣点,测算出PS值。
脑梗死后HT的评价,采用欧洲-澳大利亚缺血性卒中研究Ⅱ中的方法分为:①无出血;②出血性梗死1型(hemorrhagic infarction,HI1);③出血性梗死2型(HI2);④脑实质内血肿1型(parenchymal hematoma 1,PH1);⑤脑实质内血肿2型(PH2);⑥PHr1型:远离梗死区的小至中等血肿,可有轻度占位效应;⑦PHr2型:远离梗死区的大的融合[8]。
1.6 统计学方法 患者基线资料采用均数±标准差、中位数或率进行表示;脑缺血组织毛细血管渗透性PS值的比较采用ANOVA方差分析及post hoc检验;糖调节异常对脑组织毛细血管渗透性及HT的影响采用Logistic回归模型。使用SPSS 19.0统计分析软件,P<0.05为差异具有显著性。
2 结果
2.1 全部患者一般资料 本研究连续入组2014年1月-2015年12月在首都医科大学附属北京天坛医院卒中单元住院的急性缺血性卒中患者共420例,其中男性占62.9%(264例)。患者入院时平均空腹血糖(5.64±2.06)mmol/L。OGTT结果显示患者发病(14±3)d时平均空腹血糖和2 h血糖分别为(5.16±1.25)mmol/L和(9.57±2.47)mmol/L(表1)。与NGR组比较,DM组患者年龄更大、入院时NIHSS评分、mRS评分及空腹血糖水平明显更高。同时DM组患者高血压、脂代谢紊乱以及应用降压药物更常见,而吸烟及中重度饮酒更少见。
2.2 缺血脑组织毛细血管渗透性 全部患者脑梗死区平均PS值是(5.93±3.57)ml/(100 ml·min),显著高于对侧半球对应区域(1.48±1.94)ml/(100 ml·min)(P<0.001)。低灌注区平均PS值是(4.94±3.21)ml/(100 ml·min),显著高于对侧半球相应部位(1.79±1.92)ml/(100 ml·min)(P<0.001)。
NGR组、IGR组和DM组患者梗死部位PS值分别为(5.16±3.07)、(5.99±4.02)和(6.38±4.28)ml/(100 ml·min),三组比较差异无显著性(P=0.781)。但DM组患者毛细血管渗透性有增高的趋势。
NGR组、IGR组和DM组患者脑组织低灌注区PS值分别为(2.11±1.45)、(4.30±2.93)和(6.06±2.60)ml/(100 ml·min),三组比较差异有显著性(P=0.019)。Post hoc分析显示,DM组患者低灌注区PS值显著高于NGR组(P=0.006)。
2.3 不同糖代谢状态患者HT情况分析 全部患者中共有36例发生了HT(8.6%)。NGR组、IGR组和DM组患者中分别有6例(4.6%,PH2型3例,PHr1型3例)、6例(5.9%,HI2型3例和PHr1型3例)和24例(12.8%,HI1型6例、HI2型6例、PH1型3例、PH2型3例、PHr1型3例、和PHr2型3例)。三组患者HT发生率比较,差异无显著性(P=0.881),但DM组患者HT的发生有升高的趋势。
发生HT的36例患者中,梗死区平均PS值是(6.49±3.52)ml/(100 ml·min),未发生HT的患者为(5.46±3.14)ml/(100 ml·min),比较差异无显著性(P=0.635)。而36例患者低灌注区平均PS值是(5.79±3.01)ml/(100 ml·min),未发生HT的患者为(4.82±3.29)ml/(100 ml·min),比较差异无显著性(P=0.530),但HT患者PS值有增加的趋势。
2.4 卒中后HT的危险因素分析 多因素Logistic回归分析显示,调整年龄、性别、入院NIHSS、入院血糖水平、卒中家族史、高血压、脂代谢紊乱、冠状动脉硬化性心脏病、吸烟、酗酒、心房颤动、牛津郡社区卒中计划(Oxfordshire Community Stroke Project,OCSP)分型、应用抗栓药物、应用降压药物以及缺血区PS值等混杂因素后,发现OGTT空腹血糖升高是卒中后出血转化的独立预测因素(比值比1.448,P=0.04)(表2)。
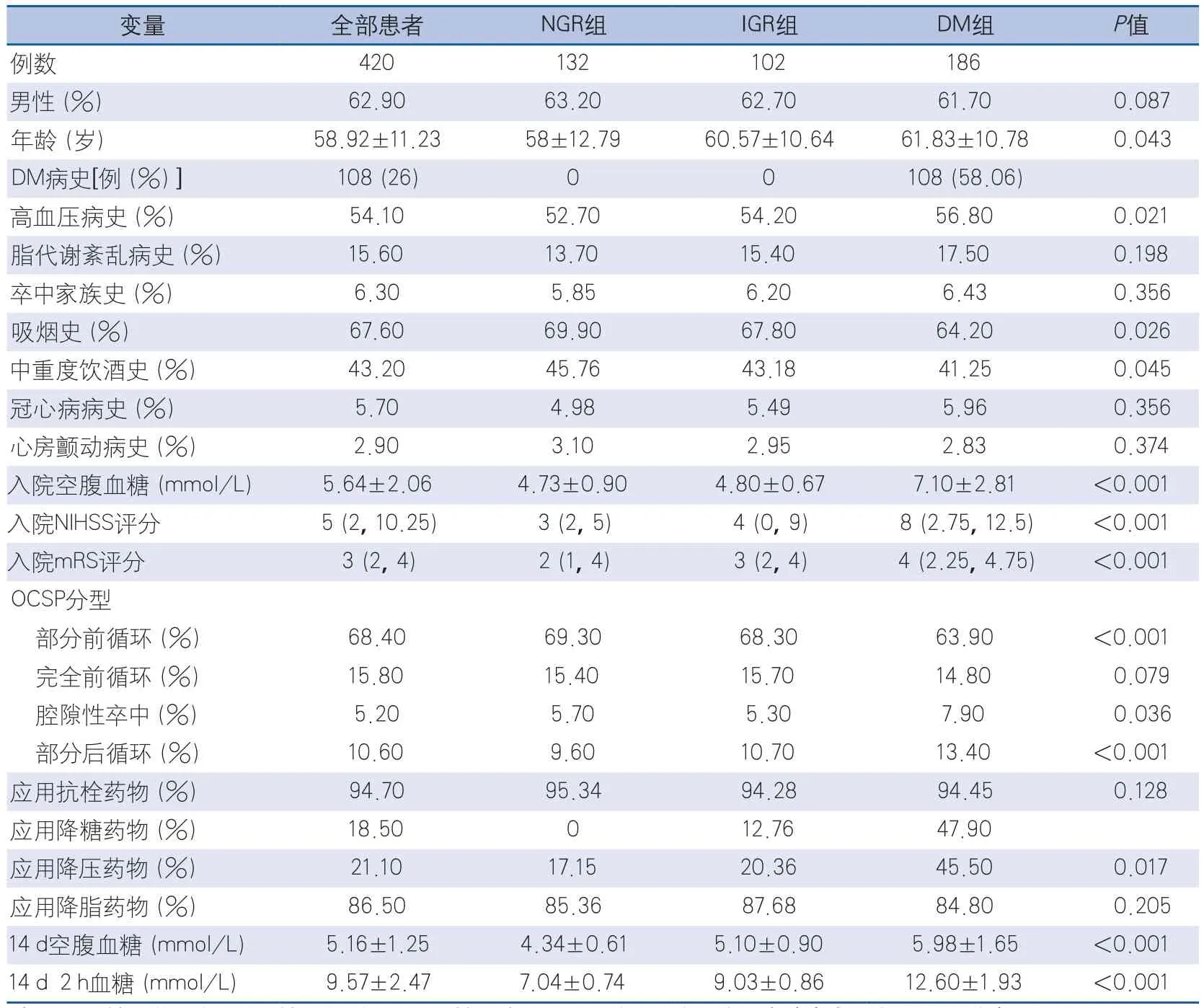
表1 NGR组、IGR组和DM组患者临床特点比较
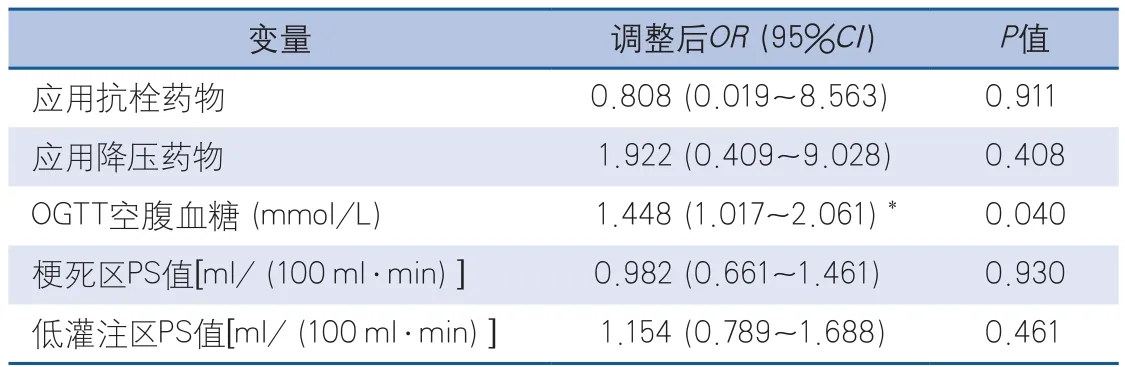
表2 应用药物、空腹血糖水平以及PS值对HT影响的调整后OR值
3 讨论
本研究中,DM组患者平均年龄最大,反映了糖尿病随年龄增长发病率升高的疾病特征,DM组患者OCSP分型为腔隙性梗死(lacunar infarcts,LACI)型和后循环梗死(posterior infarcts,POCI)型者更多见,此结果与以往的研究报道和欧洲生物医学卒中项目的结果一致[1,9]。POCI患者常出现神经内分泌功能紊乱,可能是此类型卒中患者血糖水平较高的原因。NGR组患者中有吸烟史以及中重度饮酒史者比DM病组更多见,这与以往的结果一致[1-2],提示患有糖尿病对吸烟、酗酒等不良生活习性有修正和约束作用。
脑组织毛细血管的渗透性(常以渗透性表面面积来表示)是血脑屏障完整性的反映。以往研究证据显示,在急性缺血的最初2~4 h内,脑组织毛细血管渗透性即开始升高[10]。利用CT灌注动态成像技术有助于识别脑缺血后局部组织毛细血管渗透性升高的现象,但对于缺血性卒中合并DM患者的脑组织毛细血管渗透性的研究甚少。本研究观察到缺血性卒中后缺血脑组织毛细血管渗透性明显升高,此反映了缺血诱导血脑屏障破坏,促进局部毛细血管渗透性增加。
本研究中,DM组患者低灌注区毛细血管渗透性显著高于NGR组,此结果提示DM对血脑屏障的破坏更为严重,这可能是合并DM的卒中患者梗死面积更大、结局更差的原因之一。这一现象的发生机制仍不清楚,长期高血糖导致微血管壁破坏,加重急性缺血损伤,可能是导致缺血区损伤更为严重的原因之一。来自KERENYI等[3]的研究显示,年龄、DM、梗死面积是缺血性卒中后发生HT的独立危险因素。已有研究发现,毛细血管渗透性增高是急性缺血性卒中后发生HT的预测因素。本研究发现,发生HT的患者局部毛细血管渗透性有增高的趋势,另外,笔者发现DM组患者发生HT的部位多在沿梗死区边缘或梗死灶内的小片出血(6例),DM患者脑组织低灌注区毛细血管渗透性明显增加,可能是上述出血转化发生的重要原因之一。
本研究发现仅有发病14 d空腹血糖水平是缺血性卒中患者发生出血转化的独立预测因素,此结论有较重要的临床意义,临床医师应重视患者空腹血糖检测,甚至病情相对平稳后的空腹血糖水平,此对缺血性卒中患者发生HT不良结局具有一定的临床预测意义。
本研究采用的CTP彩图处理技术和计算PS值,目前仅在少数高级卒中中心可以进行,这可能影响这项新的影像技术在临床实践中广泛应用。
[1] JIA Q,ZHENG H,ZHAO X,et al. Abnormal glucose regulation in patients with acute stroke across China:prevalence and baseline patient characteristics[J].Stroke,2012,43(3):650-657.
[2] JIA Q,LIU G,ZHENG H,et al. Impaired glucose regulation predicted 1-year mortality of Chinese patients with ischemic stroke:data from abnormal glucose regulation in patients with acute stroke across China[J]. Stroke,2014,45(5):1498-1500.
[3] KERENYI L,KARDOS L,SZÁSZ J,et al. Factors in fl uencing hemorrhagic transformation in ischemic stroke:a clinicopathological comparison[J]. Eur J Neurol,2006,13(11):1251-1255.
[4] ENNIS S R,KEEP R F. Effect of sustained-mild and transient-severe hyperglycemia on ischemia-induced blood-brain barrier opening[J]. J Cereb Blood Flow Metab,2007,27(9):1573-1582.
[5] LIN K,KAZMI K S,LAW M,et al. Measuring elevated microvascular permeability and predicting hemorrhagic transformation in acute ischemic stroke using fi rst-pass dynamic perfusion CT imaging[J].AJNR Am J Neuroradiol,2007,28(7):1292-1298.
[6] LINDSAY P,FURIE K L,DAVIS S M,et al. World Stroke Organization global stroke services guidelines and action plan[J]. Int J Stroke,2014,9(Suppl A100):4-13.
[7] ALBERTI K G,ZIMMET P Z. De fi nition,diagnosis and classi fi cation of diabetes mellitus and its complications. Part 1:diagnosis and classi fi cation of diabetes mellitus provisional report of a WHO consultation[J]. Diabetes Med,1998,15(7):539-553.
[8] LARRUE V,VON KUMMER R R,MÜLLER A,et al. Risk factors for severe hemorrhagic transformation in ischemic stroke patients treated with recombinant tissue plasminogen activator:a secondary analysis of the European-Australasian Acute Stroke Study(ECASS Ⅱ)[J]. Stroke,2001,32(2):438-441.
[9] MEGHERBI S E,MILAN C,MINIER D,et al.Association between diabetes and stroke subtype on survival and functional outcome 3 months after stroke:data from the European BIOMED Stroke Project[J].Stroke,2003,34(3):688-694.
[10] BELAYEV L,BUSTO R,ZHAO W,et al.Quantitative evaluation of blood-brain barrier permeability following middle cerebral artery occlusion in rats[J]. Brain Res,1996,739(1-2):88-96.