超临界流体色谱法拆分某一生物碱类手性化合物
2018-01-11钟浩强传厚齐永长吴俊崔海鞠宋欢
钟浩,强传厚,齐永长,吴俊,崔海鞠,宋欢
超临界流体色谱法拆分某一生物碱类手性化合物
钟浩,强传厚,齐永长,吴俊,崔海鞠,宋欢
(宣城职业技术学院护理系,安徽 宣城 242000)
目的:通过运用超临界流体色谱法(SFC)分离获得单一旋光的生物碱类手性化合物。方法:运用Thar analytical SFC仪器筛选出最佳的分析方法,并通过超临界流体制备仪器Waters Thar SFC Prep80优化方法并在碱性条件下获得单一旋光化合物,然后通过Thar analytical SFC和Agilent1200 LC-MS对获得的单一旋光化合物进行光学纯度和化学纯度的检查。结果:运用SFC可以将该生物碱类手性化合物分离成4种同分异构体,并使化学纯度和光学纯度均达到99%以上。结论:SFC可以很好地分离此生物碱类手性化合物,效果较好。
超临界流体色谱法;光学纯度;化学纯度;生物碱;手性
手性药物(chiral drug)是分子立体结构和它的镜像彼此不能够重合的一类药物,将互为镜像关系而又不能重合的一对药物结构称为对映体(enatiomer)[1]。已知药物中约有30%~40%是手性药物[2]。对映体具有不同的药动学和药效学,使用消旋体药物可能导致错误的药动学行为和作用模式[3]。因此,如何进行手性药物的拆分并提供单一的手性药物,从而控制药品生产的质量,已成为人们关注的重大课题。
目前手性拆分已从最开始的直接结晶拆分[4]、酶拆分[5]、薄层色谱法[6]发展到膜拆分、液液萃取拆分、分子印迹拆分等新型拆分法等。近年来,基于超临界流体作为流动相具有传质速度快,手性选择高,分离效果好等特点而开发出来的超临界流体色谱法(supercritical fluid chromatography,SFC)广泛应用于手性异构体的拆分[7-8]。SFC是一种流动相温度、压力均高于或略低于临界点的色谱技术[9]。超临界流体具有气体的低黏度和高扩散性,又兼有与液体相近的密度和溶解能力。目前,超临界CO2因其具有效率高,对环境良好,廉价易得,后处理简单等特点,一般使用它做SFC的流动相[10]。
SFC作为超临界流体技术发展的一个重要分支,在色谱领域获得了迅速发展。SFC可以快速高效地进行手性拆分,支持单一构型的药物分子的研究。本实验使用SFC技术对一个含有4个异构体的手性生物碱消旋体进行拆分,首先使用分析级SFC仪器筛选拆分方法,然后使用制备级SFC仪器进行拆分获得4个单一构型的化合物,并对这4个化合物进行光学纯度和化学纯度的检测。
1 仪器与试剂
1.1 仪器 Thar SFC Prep80、Thar analytical SFC(沃特斯科技有限公司);Agilent1200LC-MS(安捷伦科技公司);KQ-250DB型数控超声波清洗仪(昆山市超声仪器有限公司);RE-5000旋转蒸发仪(上海博彩仪器设备有限公司);BC-W206型旋转蒸发仪(上海贝凯生物化工设备有限公司);DLSB-低温冷却液循环泵(上海豫康科仪器设备有限公司);布氏漏斗(上海安普科学仪器有限公司);一次性使用无菌注射器(20 ml,常州金龙医用塑料器械有限公司)。
1.2 试剂 手性生物碱化合物1.3 g(某公司提供);无水乙醇、异丙醇、甲醇(制备纯,上海凌峰化学试剂有限公司);二氯甲烷(制备纯,上海政创实业有限公司);氨水(分析纯,上海润捷化学试剂有限公司出品);二乙胺(分析纯,国药集团化学试剂有限公司)。
2 方法与结果
2.1 开发实验 色谱柱:ChiralPak AD-H(150 mm×4.6 mm,3 μm),ChiralPak AS-H(250 mm×4.6 mm,5 μm),ChiralCel OJ-H(250 mm×4.6 mm,5 μm),ChiralCel OD-H(150 mm×4.6 mm,3 μm),ChiralPak AY-H(150 mm ×4.6 mm,5 μm),ChiralCel OZ-H(150 mm×4.6 mm,5 μm);流动相:A:超临界 CO2流体,B:甲醇[0.05%二乙胺(DEA)]、乙醇(0.05%DEA)、异丙醇(0.05%DEA)。检测波长:220 nm;流速:2.4 ml/min;柱温:35℃。
由于待分离样品为生物碱类,为了改善化合物峰形,防止色谱峰拖尾,在醇类流动相中添加了DEA。方法开发时,先选择分离效果较好的手性柱,再改变醇类流动相的种类进行优化。方法初试时,B相流动相的比例为5%~40%,采集时间15 min(5%~40%,0~8 min;40%,8~11 min;5%,11~15 min)。发现该化合物在色谱柱上保留较强,无法洗脱。故在方法筛选时,除使用AD-H色谱柱时,B相比例更改为40%,采集时间10 min。由于AD-H色谱柱一般对化合物保留较强,使用AD-H时,B相比例更改为55%,流速更改为2.0 ml/min,采集时间10 min。方法开发所使用的色谱柱和流动相,见表1,共筛选18种方法。
2.2 开发结果 经过方法开发实验筛选,最后确定合理的分析方法为:色谱柱:ChiralPak AD-H(150 mm×4.6 mm,3 μm);流动相:A:超临界CO2流体,B:乙醇(0.05%DEA),B相比例:55%;检测波长:220 nm;流速:2 ml/min;柱温:35℃。在该方法条件下,待分离样品的4个异构体(根据保留时间的不同,按照由小到大命名为,异构体A、异构体B、异构体C、异构体D)可以达到基线分离,并且异构体D与其它3个异构体分离度很好。分离结果色谱图见图1。

表1 色谱分离条件

图1 待分离化合物分析色谱图
2.3 制备分离 由于待分离样品中含有4个异构体,异构体A、B、C仅达到基线分离,只经过1次制备分离难以保证4个异构体都有较高的光学纯度。异构体D与其它3个异构体分离度较好,制备时经过一次制备分离得到光学纯度较高的异构体D。然后改用粒径较小的色谱柱,降低流动相流速和B相比例,改善异构体A、B、C的分离度,经过二次制备得到光学纯度较高的异构体A、B、C。
2.3.1 一次制备 仪器:Thar 80制备型SFC;色谱柱:ChiralPak AD-H(300 mm×30 mm,20 μm);流动相:A:超临界CO2流体,B:乙醇(0.2%DEA);B相比例:55%;流速:80 ml/min;柱温:38℃;样品溶解:超声溶解于乙醇,浓度:13 mg/ml,进样量:3.5 ml/针。制备结束后,将收集的组分在旋转蒸发仪上于40℃水浴上旋干,得到异构体A、B、C的混合物以及单一的异构体D,见图2、图3。
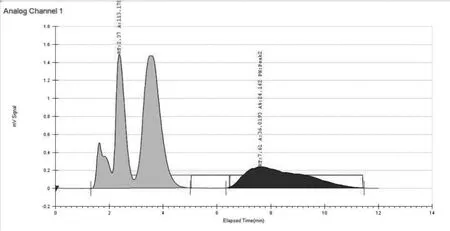
图2 第一次分离单一进样分离色谱图

图3 第一次分离连续进样分离色谱图
2.3.2 二次制备 仪器:Thar 80制备型SFC;色谱柱:ChiralPak AD-H(300 mm×30 mm,20 μm),流动相:A:超临界CO2流体,B:乙醇(0.2%DEA),B相比例:40%;流速:65 ml/min;柱温:38℃。样品溶解:超声溶解于乙醇,浓度:10 mg/ml,进样量:3 ml/针。制备结束后,将收集的组分在旋转蒸发仪上于40℃水浴上旋干,即分别得到单一的异构体A、B、C。见图4、图5。
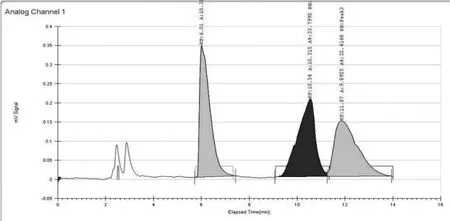
图4 第二次分离单一进样分离色谱图
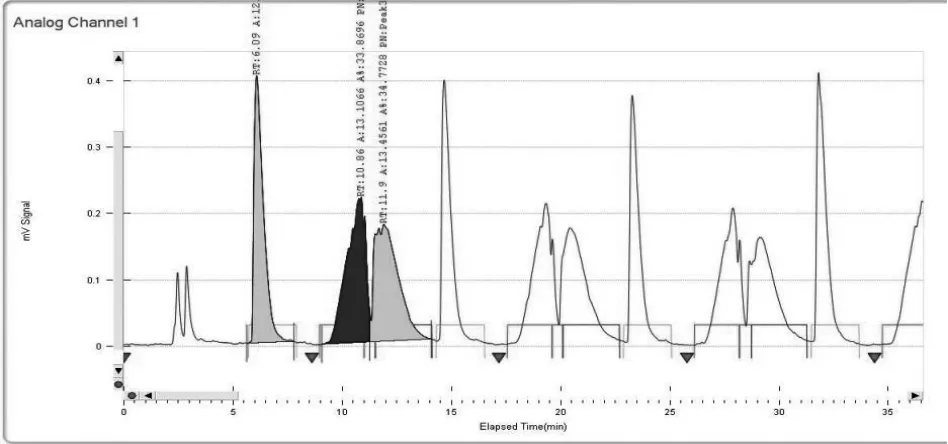
图5 第二次分离连续进样分离色谱图
2.4 质量控制
2.4.1 光学纯度测定 经过2次制备后得到的4个单一异构体的光学纯度的测定采用2.2中所述色谱条件,测定结果见图6。
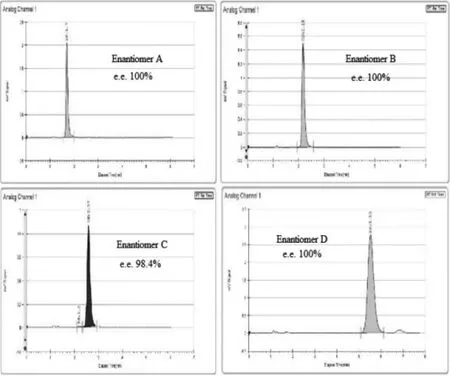
图6 4个单一异构体的光学纯度
2.4.2 化学纯度测定 经过2次制备后得到的4个单一异构体的化学纯度的测定使用Agilent 1200 LC-MS,测定结果见图7。LC-MS条件:色谱柱:Xtimate C18(2.1 mm×30 mm,3μm);流动相:A:水(0.1%三氟乙酸),B:乙腈(0.1%三氟乙酸);流速:1 ml/min;柱温:50℃。
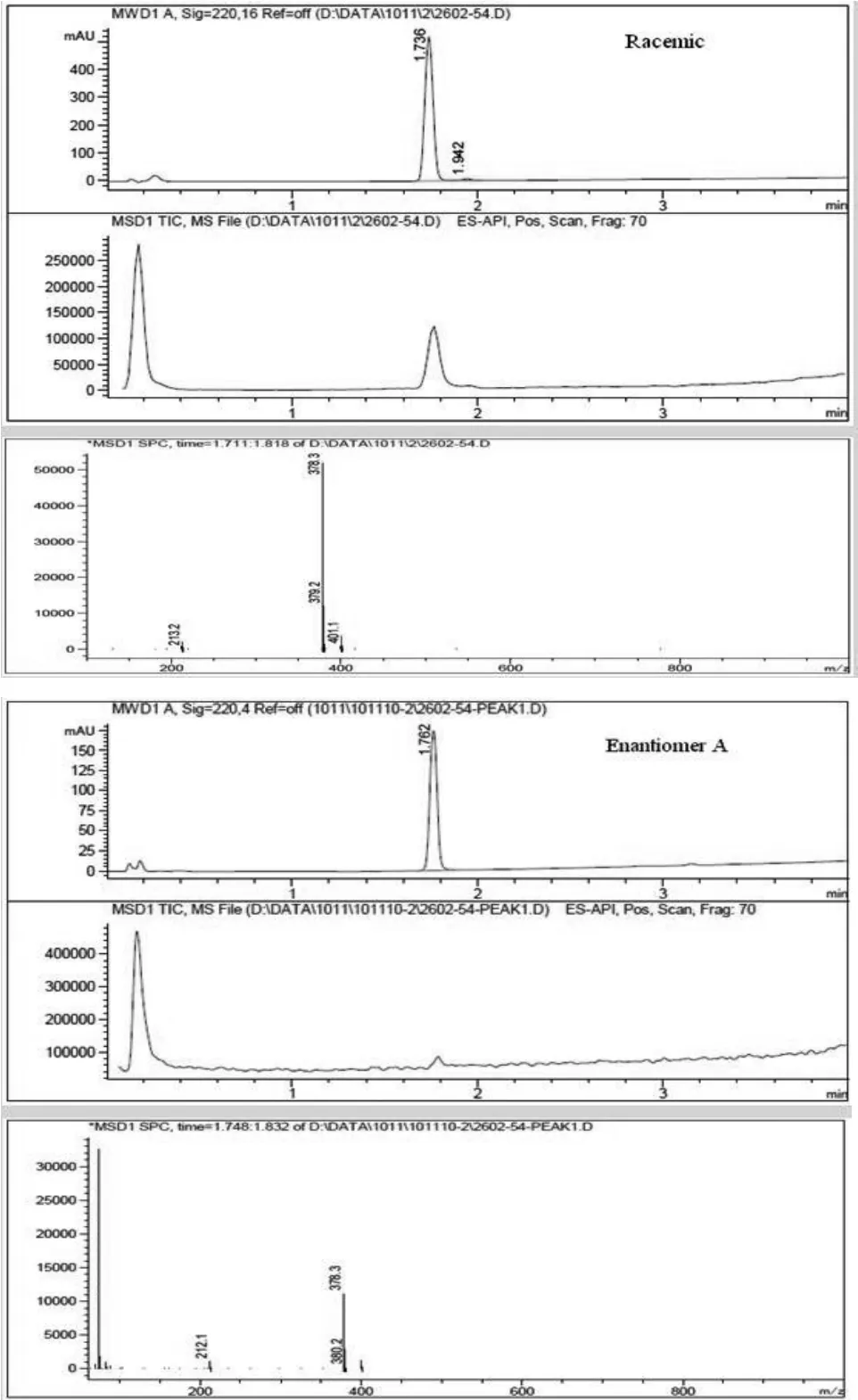
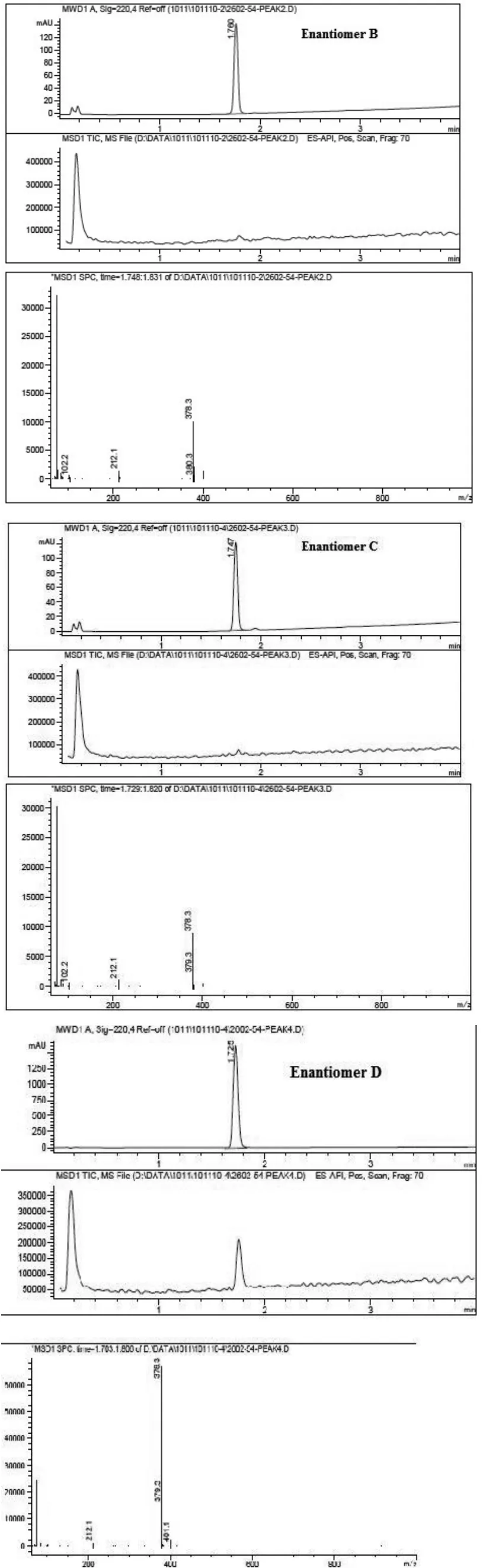
图7 4个单一异构体的化学纯度
3 讨论
本实验进行手性分离的化合物是生物碱,碱性化合物在色谱柱上的峰形经常出现拖尾现象,这是由于色谱柱残留的硅羟基和带正电荷的碱性化合物之间的相互作用引起的。实验中,在流动相中添加了DEA以减少碱性化合物的峰拖尾。DEA相当于竞争物,占据硅羟基的位置,用于消除化合物与残留硅羟基间的相互作用,使色谱柱钝化,改善化合物峰形。
在建立化合物的手性分离方法时,一般首先选择分离效果最好的手性柱,然后再继续优化分析条件,可以改变改良剂的种类,降低改良剂的比例,降低流动相的流速。多数情况下,降低改良剂的比例和流动相的流速可以改善分离度,但会延长化合物的保留时间。在实验的二次制备中,为了改善异构体A、B、C的分离度,降低了乙醇的比例和流动相的流速。本实验中进行了2次制备分离,改变的是流动相的比例和流速,得到了4个单一构型的化合物。在其它分离含有多个手性中心的化合物的情况中,也可以根据方法开发情况结合使用不同的色谱柱和改良剂进行制备分离。
在实验样品制备分离过程中温度对分离效果会产生影响,注意控制循环水浴的温度,防止由于温度的变化引起的分离度的变化。
综上所述,本实验使用SFC技术对一个含有4个异构体的手性生物碱消旋体进行了拆分,对得到的4个单一化合物进行了光学纯度和化学纯度的检测,均获得了较高的光学纯度和化学纯度。可见SFC方法在这一手性生物碱的手性分离过程中有很好的效果,且在分离过程中对于碱性化合物可以使用固体填料致纯的方法能够获得更加的分离效果,为以后生物碱类化合物的手性分离提供了实验方法依据。
[1]Kanchanamayoon W.Determination of phthalate esters in drinking water using solid-phase extraction and gas chromatography[J].J Appl Sci,2010,10(17):1987-1990.
[2]王晖,谢畅,符剑刚,等.采用超临界流体萃取技术从PVB塑料中提取增塑剂的研究[J].塑料工业,2009,37(1):75-78.
[3]Moazzen M,Ahmadkhaniha R,Gorji ME,et al.Magnetic solidphase extraction based on magnetic multi-walled carbon nanotubes for the determination of polycyclic aromatic hydrocarbons in grilled meat samples[J].Talanta,2013,115:957-965.
[4] Hadjmohammadi MR,Ranjbari E.Utilization of homogeneous liquid-liquid extraction followed by HPLC-UV as a sensitive method for the extraction and determination of phthalate esters in envirommental water samples[J].Int J Environ Anal Chem,2012,92(11):1312-1324.
[5] Eleftcria P, Nicolas K.Hollow-fiber liquid-phase microextraction of phthalate esters from water[J].J Chromatogr A,2003,999(1-2):145-153.
[6] Sendón R, Sanches-Silva A, Bustos J, et al.Detection of migration of phthalates from agglomerated cork stoppers using HPLC-MS/MS[J].J Sep Sci,2012,35(10-11):1319-1326.
[7]Ye CW,Gao J,Yang C,et al.Development and application of an SPME/GC method for the determination of trace phthalates in beer using a calixarene fiber[J].Anal Chim Acta, 2009,641(1-2):64-74.
[8] Clausen PA, Lindeberg Bille RL, Nilsson T, et al.Simultaneous extraction of di(2-ethylhexyl) phthalate and nonionic surfactants from house dust.Concentrations in floor dust from 15 Danish schools[J].J Chromatogr A, 2003,986 (2):179-190.
[9] Ezzell JL,Richter BE, Felix WD, et al.A comparison of accelerated solvent extraction with conventional solvent extraction of organophosphorus pesticide and herbicides[J].Lc Gc,1995,13:390-399.
[10] Herrera-Herrera AV,Hernández-Borges J,Afonso MM,et al.Comparison between magnetic and non magnetic multi-walled carbon nanotubes-dispersive solid-phase extraction combined with ultra-high performance liquid chromatography for the determination of sulfonamide antibiotics in water samples[J].Talanta,2013,116:695-703.
Separation of An Alkaloids of Chiral Compound by Using Supercritical Fluid Chromatography
ZHONG Hao,QIANG Chuanhou,QI Yongchang,WU Jun,CUI Haiju,SONG Huan
(Nursing Department,Xuancheng Vocational and Technical College,Xuancheng 242000,China)
Objective:To separate an alkaloids of chiral monomers by using supercritical fluid chromatography(SFC).Methods:The best analytical method was obtained by Thar analytical SFC,and then Waters Thar SFC Prep80 was used to separate the alkaloid.The chemical purity and optical purity of chiral monomers were analyzed by Thar analytical SFC and Agilent1200 LC-MS.Result:The chiral monomers were separated by SFC and the chemical purity and optical purity were all over 99%.Conculusion:SFC is a wonderful technique to separate the alkaloid with good effect.
supercritical fluid chromatography;chemical purity;optical purity;alkaloid;chiral
R917
A
1008-2344(2017)06-0498-04
10.16753/j.cnki.1008-2344.2017.06.012
2017-04-10
(文敏编辑)
