鞘氨醇激酶1在原发性肝癌组织中的表达及其临床意义
2018-01-11方长英朱传卫余良河何勇勇
方长英,朱传卫,余良河,何勇勇*
鞘氨醇激酶1在原发性肝癌组织中的表达及其临床意义
方长英1,朱传卫1,余良河2,何勇勇1*
(1.安徽省宣城中心医院检验科,安徽 宣城 242000;2.第二军医大学东方肝胆外科医院肝外六科)
目的:探讨原发性肝癌组织中鞘氨醇激酶1(sphingosine kinase 1,SPHK1)的表达及其临床意义。方法:采用Real-time PCR和免疫组化检测252例原发性肝癌患者癌组织和癌旁组织中SPHK1的表达水平,分析其对肝癌患者生存和复发的影响。结果:SPHK1蛋白在肝癌组织中阳性表达率为71.8%,而在癌旁组织中为11.1%(P<0.01),高表达SPHK1蛋白的肝癌患者生存期较短(P=0.000)而复发率较高(P=0.025)。结论:SPHK1是肝癌的一个潜在分子靶点,有助于判断患者的复发和预后。
鞘氨醇激酶1;原发性肝癌;免疫组化;复发
原发性肝癌是世界上常见的消化系统恶性肿瘤,每年约60万患者死于肝癌,其死亡率居于肿瘤第三位,严重威胁人类健康[1-2]。随着科技的发展,肿瘤诊疗水平有所提高,然而只有三分之一的肝癌患者能够进行肿瘤切除[3],并且术后效果并不理想,患者5年生存率只有17%~53%,复发率则高达70%[4-5]。因此,应从原发性肝癌的分子机制上进行研究,了解其发生和发展的过程,寻找一个潜在的分子治疗靶点,提高肝癌患者生存率,降低复发率。鞘氨醇激酶1(sphingosine kinase 1,SPHK1)是细胞中一种蛋白酶,催化鞘氨醇转变为磷酸鞘氨醇,产生的磷酸鞘氨醇与G蛋白耦联受体中的磷酸鞘氨醇受体结合后[6],会产生一系列生物学效应,抑制细胞凋亡,促进细胞增殖、迁移和侵袭等[7-9]。众多研究表明SPHK1能够促进肿瘤生长、血管生成、肿瘤转移和复发等[10-12],高表达SPHK1的恶性肿瘤,如乳腺癌、结肠癌、白血病、宫颈癌和鼻咽癌等患者有着较低生存率和较高复发率[13-18]。本文通过研究SPHK1在肝癌和对应癌旁组织中表达情况,分析其表达水平与肝癌患者生存期和复发率关系,为临床治疗原发性肝癌提供一个潜在分子靶点。
1 资料与方法
1.1 病例资料 随机收集2008年1月至2011年12月第二军医大学附属东方肝胆外科医院肝外六科3个治疗组行肝癌手术的450例原发性肝癌组织和对应的癌旁组织标本。术中所有肿瘤全部被切除,手术边界距离肿瘤大于3 cm,术后病理证实为原发性肝癌且边缘组织没有肿瘤细胞,标本置于液氮中保存。其中,252例原发性肝癌患者标本符合本研究纳入标准:(1)术前检查显示患者WHO评分为0~1分;(2)肝功能分级为Child A级;(3)患者术前未进行化疗、射频消融和分子靶向治疗等。(4)患者基本资料和病例资料完整,且全部进行了随访。
1.2 Real-time PCR检测肝癌组织和癌旁组织中SPHK1的表达水平 根据GenBank提供的基因序列,应用Primer Express 3.0设计SPHK1引物,各引物序列、扩增片段长度见表1,由上海吉玛科技公司合成。将肝癌组织和癌旁组织用新鲜的PBS清洗,剪碎后加入适量Trizol,按照说明书提取肝癌组织和癌旁组织RNA,使用分光光度计测量肝癌组织和癌旁组织RNA的浓度和纯度。采用美国Gibco公司RevertAid First strand Cdnasynthsis试剂盒对样本RNA进行反转录,反转录体系为20μl,反应条件为42℃条件下30 min,95℃条件下2 min,-20℃保存。Real-time PCR在ABI公司7300Real-time PCR仪完成,反应体系为20μl,条件为:95℃ 变性30 s,随后95℃ 15 s、60 ℃ 15 s、72℃ 10 s,循环40次。实验结果重复3次。
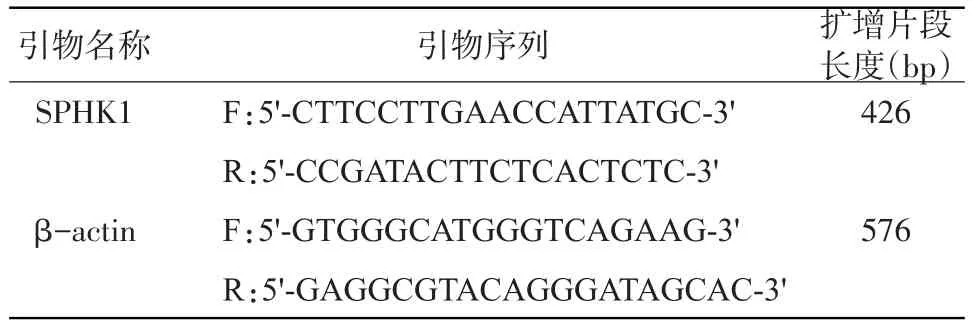
表1 Real-time PCR引物基本信息
1.3 免疫组化检测252例原发性肝癌患者癌组织和癌旁组织中SPHK1蛋白的表达水平 使用英国Abcam公司生产的EnVisionTM+kit免疫组化试剂盒,按照说明书对组织进行包埋切片,置于60℃烤箱10 h,随后用二甲苯浸泡脱蜡和乙醇水合,再放入柠檬酸盐缓冲液中进行抗原修复,BSA封闭后弃去,加一抗过夜,PBS清洗后加羊抗兔二抗,DAB显色后显微镜下观察染色程度,双蒸水终止染色,苏木紫复染,脱水、透明和封片后镜检。SPHK1蛋白阳性反应标准为:细胞染色程度和阳性染色细胞率,染色程度分为1、2、3和4四个等级(1和2为没有染色或染色极少代表阴性,3和4为染色较强代表阳性);阳性染色细胞率为染色阳性细胞数目与总细胞数目的比值,分为0~19%、20%~39%、40%~60%、>60%。最后,阳性率<40%为SPHK1低表达,≥40%为SPHK1高表达。
1.4 统计学方法 采用SPSS 17.0统计学软件进行统计学处理。SPHK1表达水平与临床病理参数之间的关系采用χ2检验和Fisher确切概率法,计量资料比较采用t检验,术后患者的生存和复发曲线采用Kaplan-Meier方法,生存和复发资料使用Cox模型进行分析。P<0.05为差异有统计学意义。
2 结果
2.1 原发性肝癌组织和癌旁组织中SPHK1表达水平差异 Real-time PCR结果显示肝癌组织中SPHK1基因表达水平明显高于癌旁组织,其表达量约为癌旁组织4倍(P<0.01);免疫组化的结果也显示肝癌组织SPHK1蛋白表达水平高于癌旁组织,分别为71.8%和11.1%,差异有统计学意义(P<0.01),见图1。

图1 SPHK1基因及SPHK1蛋白在肝癌组织和癌旁组织中的表达
2.2 SPHK1蛋白表达与肝癌病理参数和预后的相关性 SPHK1在肝癌组织中表达与包膜有无(P=0.045)、肝硬化(P=0.002)、肿瘤数目(P=0.003)和肿瘤分期(P=0.019)有关,见表2。Kaplan-Meier分析结果表明SPHK1蛋白表达较高患者有较低生存率(P=0.000),见图2A,高表达患者1年生存率为24.7%,3年生存率为6.3%;而低表达组1年生存率为59.3%,3年生存率为27.6%。并且高表达SPHK1蛋白患者复发率高于低表达的原发性肝癌患者(P=0.025),见图2B,高表达组1年复发率为93.9%,3年复发率为98.4%;低表达组1年复发率为78.9%,3年复发率为94.8%。

表2 SPHK1蛋白表达与肝癌病理参数的相关性

图2 Kaplan-Meier生存曲线分析SPHK1蛋白在252例原发性肝癌组织的表达水平与患者总体生存率及复发率的关系
3 讨论
本研究结果显示原发性肝癌组织中SPHK1基因和蛋白表达量明显高于对应的癌旁组织,且SPHK1蛋白表达水平与肿瘤包膜有无、肝硬化、肿瘤的数目和临床分期密切相关。统计分析结果表明高表达SPHK1蛋白的原发性肝癌患者比低表达患者生存率低,1年生存率下降34.6%,3年生存率下降21.3%;同时高表达患者有着较高的复发率,1年复发率增加15%,3年复发率增加3.6%。本研究结果说明SPHK1的高表达在原发性肝癌的发生和发展过程中起着重要作用。
研究发现SPHK1是一种癌基因,促进肿瘤细胞的形成并抑制其凋亡。正常的NIH3T3成纤维细胞在SPHK1过表达的情况下发生了恶性转化[19]。动物实验证实SPHK1表达水平增高可以促进肿瘤细胞生长和转移,SPHK1抑制剂的使用可以抑制肿瘤生长[20-21]。Li等[22]在临床研究中发现胃癌组织中的SPHK1表达水平高于正常的癌旁组织,其表达水平与胃癌的发生发展密切相关,高表达SPHK1的胃癌患者5年生存率较低且复发率较高。此外,过表达SPHK1的肿瘤患者在化疗的过程中容易产生耐药性,如SPHK1蛋白升高的白血病患者在进行阿霉素和足叶乙甙化疗时产生抵抗[23];前列腺癌细胞在SPHK1过表达的情况下使用喜树碱化疗时效果减弱[24]。临床研究表明SPHK1抑制剂的使用可以增加结肠癌细胞凋亡,增强5-FU的化疗敏感性[25]。
本研究结果显示肝癌组织中SPHK1基因和蛋白表达显著升高。Lu等[26]近期基础研究结果表明肝癌细胞中SPHK1过表达使肝癌细胞的活性增加,羊藿素可抑制SPHK1蛋白活性,使肝癌细胞的活性下降并出现凋亡;动物实验结果表明使用羊藿素可明显抑制裸鼠体内肝癌肿瘤生长。Li等[27]研究发现使用siRNA或FTY720阻断SPHK1能显著降低鼻咽癌细胞增殖和迁移,增加其生长周期使癌细胞凋亡速度加快;临床研究结果显示高表达SPHK1肿瘤患者预后较差。SPHK1在肝癌中扮演着重要的角色,高表达SPHK1肝癌细胞恶性度增加;高表达SPHK1的肝癌患者生存率低而复发率高。
综上所述,原发性肝癌组织中SPHK1高表达与恶性病理学特征密切相关,SPHK1蛋白是肝癌患者预后的一个有效标志物和潜在分子治疗靶点,为肝癌的分子靶向治疗提供了研究基础。
[1] Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[3] Qi X, Zhao Y,Li H, et al.Management of hepatocellular carcinoma:an overview of major findings from meta-analyses[J].Oncotarget,2016,7(23):34703-34751.
[4] Chen XP, Qiu FZ, Wu ZD, et al.Long-term outcome of resection of large hepatocellular carcinoma[J].Br J Surg,2006,93(5):600-606.
[5]Ruan DY,Lin ZX,Wang TT,et al.Nomogram for preoperative estimation of long-term survival of patients who underwent curative resection with hepatocellular carcinoma beyond Barcelona clinic liver cancer stage A1[J].Oncotarget, 2016, 7 (38):61378-61389.
[6] Spiegel S,Milstien S.Sphingosine-1-phosphate:an enigmatic signalling lipid[J].Nat Rev Mol Cell Biol,2003,4 (5):397-407.
[7] Fyrst H,Saba JD.An update on sphingosine-1-phosphate and other sphingolipid mediators[J].Nat Chem Biol,2010,6 (7):489-497.
[8]Li J,Wu H,Li W,et al.Downregulated miR-506 expression facilitates pancreatic cancer progression and chemoresistance via SPHK1/Akt/NF-κB signaling[J].Oncogene,2016,35 (42):5501-5514.
[9] Shida D,Inoue S,Yoshida Y,et al.Sphingosine kinase 1 is upregulated with lysophosphatidic acid receptor 2 in human colorectal cancer[J].World J Gastroenterol, 2016, 22 (8):2503-2511.
[10] Pyne NJ,Pyne S.Sphingosine 1-phosphate and cancer[J].Nat Rev Cancer,2010,10(7):489-503.
[11] Kumar A,Saba JD.Lyase to live by:sphingosine phosphate lyase as a therapeutic target[J].Expert Opin Ther Targets,2009,13(8):1013-1025.
[12] Liang J, Nagahashi M, Kim EY, et al.Sphingosine-1-phosphate links persistent STAT3 activation,chronic intestinal inflammation,and development of colitis-associated cancer[J].Cancer Cell,2013,23(1):107-120.
[13]易敏,王嵘,陈璐,等.鞘氨醇激酶1蛋白在乳腺浸润性导管癌组织中的表达及其临床意义[J].中国免疫学杂志,2014,30(12):1683-1685.
[14] Marzec KA,Baxter RC,Ma rtin JL.Targeting insu lin-like growth factor binding protein-3 signaling in triple-negative breast cancer[J].Biomed Res Int,2015,2015:638526.
[15] Nguyen AV,Wu YY,Lin EY.STAT3 and sphingosine-1-phosphate in inflammation-associated colorectal cancer[J].World J Gastroenterol,2014,20(30):10279-10287.
[16] Wallington-Beddoe CT,Bradstock KF,Bendall LJ.Oncogenic properties of sphingosine kinases in haematological malignancies[J].Br J Haematol,2013,161(5):623-638.
[17] Kim HS,Yoon G,Ryu JY,et al.Sphingosine kinase 1 is a reliable prognostic factor and a novel therapeutic target for uterine cervical cancer[J].Oncotarget, 2015, 6 (29):26746-26756.
[18] Li W,Tian Z,Qin H,et al.High expression of sphingosine kinase 1 is associated with poor prognosis in nasopharyngeal carcinoma[J].Biochem Biophys Res Commun, 2015, 460(2):341-347.
[19] Xia P, Gamble JR, Wang L, et al.An oncogenic role of sphingosine kinase[J].Curr Biol, 2000,10 (23):1527-1530.
[20] Pyne NJ,Pyne S.Sphingosine 1-phosphate and cancer[J].Nat Rev Cancer,2010,10(7):489-503.
[21] Guan H,Song L,Cai J,et al.Sphingosine kinase 1 regulates the Akt/FOXO3a/Bim pathway and contributes to apoptosis resistance in glioma cells[J].PLoS One, 2011, 6 (5):e19946.
[22] Li W, Yu CP, Xia JT, et al.Sphingosine kinase 1 is associated with gastric cancer progression and poor survival of patients[J].Clin Cancer Res,2009,15(4):1393-1399.[23]Bonhoure E,Pchejetski D,Aouali N,et al.Overcoming MDR-associated chemoresistance in HL-60 acute myeloid leukemia cells by targeting sphingosine kinase-1[J].Leukemia,2006,20(1):95-102.
[24] Brizuela L,Ader I,Mazerrolles C,et al.First evidence of sphingosin.7e 1-phosphate lyase protein expression and activity downregulation in human neoplasm:implication for resistance to therapeutics in prostate cancer[J].Mol Cancer Ther,2012,11(9):1841-1851.
[25] Tan SS, Khin LW, Wong L, et al.Sphingosine kinase 1 promotes malignant progression in colon cancer and independently predicts survival of patients with colon cancer by competing risk approach in South Asian population[J].Clin Transl Gastroenterol,2014,5:e51.
[26]Lu PH,Chen MB,Liu YY,et al.Identification of sphingosine kinase 1(SphK1) as a primary target of icaritin in hepatocellular carcinoma cells[J].Oncotarget, 2017, 8 (14):22800-22810.
[27]Li W,Li J,Wang Y,et al.Sphingosine kinase 1 is a potential therapeutic target for nasopharyngeal carcinoma[J].Oncotarget,2016,7(49):80586-80598.
Expression of Sphingosine Kinase 1 in Primary Hepatocellular Carcinoma Tissues and Its Clinical Significance
FANG Changying1,ZHU Chuanwei1,YU Lianghe2,HE Yongyong1*
(1.Department of Clinical Laboratory,Xuancheng Central Hospital, Xuancheng 242000, China;2.Department Ⅵ of Hepatic Surgery,Eastern Hepatobiliary Surgery Hospital,The Second Military Medical University)
Objective:To investigate the expression of sphingosine kinase 1 (SPHK1) in primary hepatocellular carcinoma tissues and its clinical significance.Methods:Real-time PCR and immunohistochemistry methods were used to detect the expression levels of SPHK1 in 252 cases of hepatocellular carcinoma tissues and paired normal tumor-adjacent tissues.The tumor recurrence and survival of the primary hepatocellular carcinoma patients were analyzed.Results:The positive expression rate of SPHK1 was 71.8%in primary hepatocellular carcinoma tissues,while 11.1%in paired adjacent tissues(P<0.01).The patients with high expression levels of SPHK1 protein had higher recurrence rate and poorer prognosis(P<0.01 or 0.05).Conclusion:SPHK1 may be a potential molecular target and helps to determine the patient's recurrence and prognosis.
sphingosine kinase 1;primary hepatocellular carcinoma;immunohistochemistry;recurrence
R735.7
A
1008-2344(2017)06-0473-04
10.16753/j.cnki.1008-2344.2017.06.004
何勇勇(1984—),男(汉),主管检验师.研究方向:肿瘤标志物.E-mail:heyongyong84@sina.com
2016-06-26
(文敏编辑)
