核桃渣中单宁酸物质HPLC检测方法的建立
2018-01-10梁国伟牟德华
梁国伟 牟德华
1(中粮华夏长城葡萄酒有限公司,河北秦皇岛066600)2(河北科技大学,河北石家庄050018)
单宁酸物质是维管束植物常见的次生代谢产物,主要存在于叶、芽、种子,根和茎的组织。单宁酸物质具有抗菌活性,这使得植物可以抵御病菌的攻击,对草食动物也有影响。单宁酸可以使植物内的同化作用变得困难,同时产生一种难闻的味道。单宁酸因其对人类的健康有益而被大家知道,主要表现为一些生物学特性,包括抗诱变、抗癌和抗氧化的特性。有研究表明,单宁酸的抗氧化能力和它与铜离子螯合的能力有关。
核桃中的单宁酸种类有很多,而且不同品种核桃中单宁酸的种类和含量也不相同。研究表明,核桃内种皮中的单宁酸含量最高。本文以核桃乳生产过程中产生的废弃物核桃渣为原料,建立其单宁酸的HPLC检测方法,以期为核桃渣的综合利用提供基础依据。
1 材料和方法
1.1 材料
1.1.1 标准品
酚酸类:咖啡酸,中国食品药品检定研究院;(+)-儿茶素,纯度≥94.4%,中国食品药品检定研究院;没食子酸,,纯度≥99.%,分析纯,天津市大茂化学试剂厂;阿魏酸,纯度≥99%,生化试剂,天津市光复精细化工研究所。
类黄酮:无水槲皮素,纯度≥98%,生化试剂,国药集团化学试剂有限公司;芦丁,北京化学试剂公司。
1.1.2 试剂
甲醇、乙腈、冰乙酸,均为色谱纯;95%乙醇、乙酸乙酯、盐酸,均为分析纯;超纯水。
1.1.3 仪器
岛津LC-20AT系列高相液相色谱仪,Lc Solution Lite工作站,UV检测器,Inertsil ODS-SP反相C18柱(250 mm×4.6 mm);旋转蒸发器。
1.2 试验方法
1.2.1 样品的前处理
将核桃渣粉碎并去除油脂后,过40目筛,备用。
1.2.2 单宁酸的提取
称取1 g处理好的核桃渣,按照料液比1∶70,提取液为体积分数60%、pH1.5的乙醇溶液,提取温度70℃,提取时间60 min,超声波的功率是50 W。将提取液进行收集、离心、浓缩得到单宁酸的粗提液。后用乙酸乙酯萃取2次,合并萃取相并氮吹至干,再用5 mL甲醇定容,用于HPLC测定。
2 色谱条件的优化
2.1 色谱条件选择
用2%冰乙酸和乙腈作为流动相分离单宁酸物质,通过改变流动相的配比以及浓度梯度,柱温达到各峰分离的目的。
2.2 方法学验证
2.2.1 线性关系的考察
准确称取5 mg没食子酸、阿魏酸、(+)-儿茶素、咖啡酸、芦丁、无水槲皮素,溶于10 mL甲醇溶液中。将质量浓度为0.5 mg/mL的标准样品稀释成不同的浓度梯度。在已经确定的色谱条件下,进样量20 μL,进行HPLC分析。在测定的过程中根据需要及时调整浓度。根据液相色谱的峰面积与标准样品的进样量,确定线性回归方程、相关系数以及线性范围。
2.2.2 回收率考察
取已知质量浓度的单宁酸提取液加入一定量的各单体酚标准样品,在已经确定的色谱条件下进行HPLC测定,计算各组分的加标回收率。
加标回收率(%)=[实测值(mg)-样品中含量(mg)]/添加值(mg)×100%
2.2.3 精密度考察
日内精密度:在24 h内,将不同质量浓度的单宁酸标准品混合溶液多次进样进行测定,每次20 μL,根据峰面积计算日内RSD值。
日间精密度:取单宁酸标准品的混合溶液,在不同的日数内进行测定,计算日间RSD值。
2.2.4 稳定性考察
准确量取一定体积的单宁酸提取液,在室温下静置 0 h、2 h、4 h、6 h、8 h、12 h、24 h、48 h,根据已经确定的色谱条件进行HPLC测定,计算各单体酚峰面积的RSD值。
2.2.5 重复性考察
准确量取一定体积的单宁酸提取液,根据已经确定的色谱条件进行HPLC测定,计算各单体酚峰面积的RSD值。
2.2.6 最低检测限的考察
取一定质量浓度的标准样品混合溶液,用甲醇进行倍比稀释。以信噪比S/N=3为标准,测定该色谱条件下的最低检测量。
3 结果与讨论
3.1 色谱条件
3.1.1 流动相的选择
分别选择1%冰乙酸-乙腈、1.5%冰乙酸-乙腈、2%冰乙酸-乙腈等不同的流动相进行检测,结果表明,2%冰乙酸-乙腈作为流动相时,各物质的分离度较好,峰形锐,故选择2%冰乙酸-乙腈作为流动相。
3.1.2 柱温的选择
柱温是影响物质分离的一个重要因素。分别考察了25℃、30℃、35℃、40℃等不同的温度对测定结果的影响。结果表明,30℃时各物质的分离度好,峰形锐,出峰时间适宜。故测定柱温选择30℃。
3.1.3 洗脱程序的确定
流动相A为2%冰乙酸,流动相B为乙腈(均过 0.45 μm有机膜),进样量 20 μL,流速 1 mL/min,柱温30℃,检测波长280 nm。梯度洗脱程序见表1。单宁酸标品色谱图见图1。

表1 单宁酸梯度洗脱程序
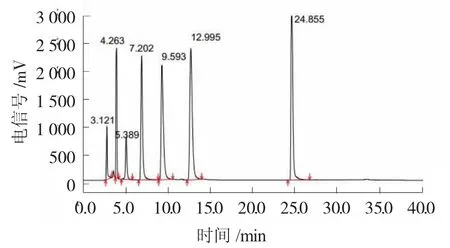
图1 单宁酸标品色谱图
3.2 定性分析
通过外标法进行定性分析,结果见表2。
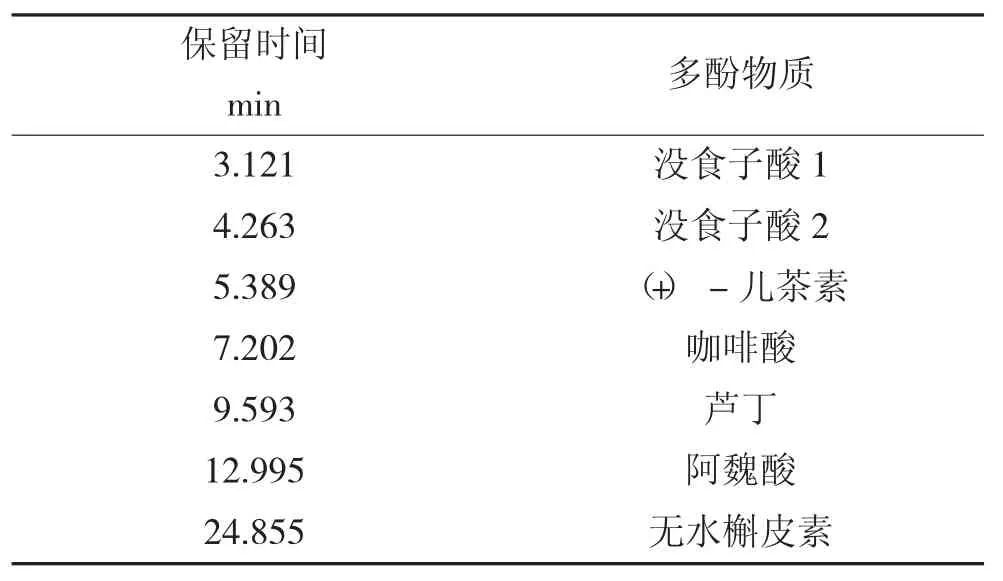
表2 单体酚物质的定性分析
3.3 方法学验证
3.3.1 线性关系
以标准物质的进样量为横坐标,峰面积为纵坐标进行线性回归,计算各单体酚物质的标准曲线,线性范围及相关系数,结果见表3。通过表3的数据可以看出,标准物质的进样量和各物质的峰面积呈现良好的线性关系。

表3 单体酚的标准曲线回归方程、相关系数和线性范围
3.3.2 加标回收率
各单体酚物质的加标回收率试验结果见表4。由表4可以看出,各物质的加标回收率在80.66%~108.17%之间,因此该方法测定结果可靠。
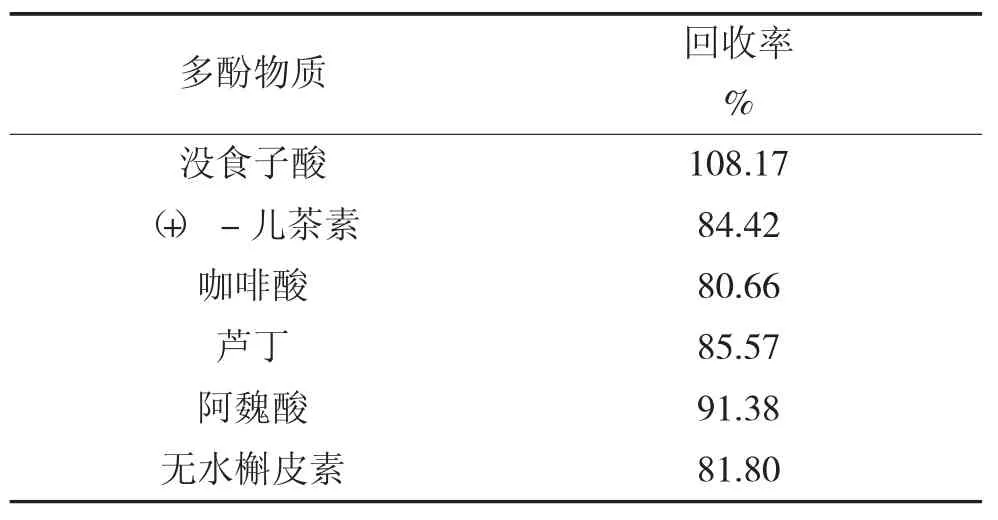
表4 各单体酚物质的加标回收率
3.3.3 精密度
日内精密度和日间精密度的测定结果见表5。由表5可以看出,各多酚物质的峰变异系数均小于10%,故精密度良好,符合测定的要求。

表5 不同浓度混合标准品的日内和日间的RSD值
3.3.4 稳定性
各多酚物质的稳定性结果见表6。由表6可以看出,各单体酚物质的变异系数均小于10%,表明样品在24 h内稳定。

表6 多酚物质的稳定性RSD值
3.3.5 重复性
各多酚物质的重复性结果见表7。由表7可以看出,各单体酚物质的变异系数均小于10%,重现性良好,符合测定的要求。

表7 多酚物质的重复性RSD值
3.4 样品检测的结果
根据确定的色谱条件测得核桃渣中的单宁酸含量,结果见表8。由表8可知,核桃渣中含有没食子酸、儿茶素、咖啡酸、芦丁和槲皮素等多酚物质,阿魏酸未检出。其中没食子酸的含量最高,槲皮素的含量最低。

表8 核桃渣中多酚物质的含量
4 结论
以2%冰乙酸和乙腈为流动相,调整比例后进行洗脱,各单体酚物质的峰得到很好的分离。经过方法学的验证,各物质的线性关系良好,回收率在80.66%~108.17%之间。方法的精密度、稳定性和重现性良好,测定结果可靠。
核桃渣中多酚物质的含量均不同。核桃渣中含有没食子酸、咖啡酸、儿茶素、槲皮素和芦丁,其中没食子酸的含量最高,槲皮素的含量最低。
[1]ROMANI A,CAMPO M,PINELLI P.HPLC/DAD/ESI-MS analyses and anti-radical activity of hydrolyzable tannins from different vegetal species [J].Food Chemistry,2012,130(1):214-221.
[2]李海洋.核桃青皮有效化学成分及抑菌性研究[D].西北农林科技大学,2012.
[3]OLIVEIRA I,SOUSA A,FERREIRA I C,et al.Total phenols,antioxidant potential and antimicrobial activity of walnut(Juglans regia L.)green husks [J].Food and Chemical Toxicology,2008,46(7):2326-2331.
[4]PEREIRA J A,OLIVEIRA I,SOUSA A,et al.Bioactive properties and chemical composition of six walnut(Juglans regia L.)cultivars [J].Food and Chemical Toxicology,2008,46(6):2103-2111.
[5]PEREIRA J A,OLIVEIRA I,SOUSA A,et al.Walnut(Juglans regia L.)leaves:Phenolic compounds,antibacterial activity and antioxidant potential of different cultivars[J].Food and Chemical Toxicology, 2007,45(11):2287-2295.
[6]FERNANDEI-AGULLO A,PEREIRAE,FREIRE MS,et al.Influence of solvent on the antioxidant and antimicrobial properties of walnut(Juglans regia L.)green husk extracts[J].Industrial Crops and Products,2013,42:126-132.
[7]张婷,张虹.山核桃青皮化学成分及生物活性研究进展[J].食品科技,2007(5):116-119.
[8]陈虹霞,王成章,周昊,等.核桃酚类化合物的研究进展[J].林产化学与工业,2013,33(1):130-134.
[9]陈杭君,李兴飞,郜海燕,等.山核桃仁多酚组分分析及抗氧化研究[J].核农学报,2013,27(1):61-67.
[10]CARVALHO M,FERREIRA P J,MENDES V S,et al.Human cancer cell antiproliferative and antioxidant activities of Juglans regia L.,Food and Chemical Toxicology,2010,48(1):441-447.
[11]ROBERTO G,ANDRADE J.The antioxidant effect of tannic acid on the in vitro copper-mediated formation of free radicals,Archives of Biochemistry and Biophysics,2005,437(1):1-9.
[12]万政敏,郝艳宾,杨春梅,等.核桃仁种皮中的多酚类物质高压液相色谱分析 [J].食品工业科技,2007(7):212-213.
[13]魏静,郝利平.核桃仁种皮中多酚的提取工艺研究[J].山西农业大学学报(自然科学版),2010,30(2):150-153.
[14]刘彬球,陈朝银,葛锋,等.核桃渣中油脂和蛋白的水剂法同步提取工艺 [J].食品与发酵工业,2012,38(3):159-162.
