OL负载Cu催化剂及其催化氧化CO及乙酸乙酯性能
2018-01-10傅之丹臧佳欣程水源康天放
傅之丹 臧佳欣 叶 青 程水源 康天放
OL负载Cu催化剂及其催化氧化CO及乙酸乙酯性能
傅之丹 臧佳欣 叶 青*程水源 康天放
(北京工业大学区域大气复合污染防治北京市重点实验室,北京 100124)
采用氧化还原法合成了层状锰氧化物(OL),并以OL为载体采用离子交换法制备了不同Cu负载量的Cu/OL催化剂。利用X射线衍射(XRD)、电子扫描电镜(SEM)、N2吸附/脱附、H2-程序升温还原(H2-TPR)、TG(热重)、X射线光电子能谱(XPS)、O2-程序升温脱附(O2-TPD)等技术对所制催化剂进行结构和织构表征,并对其催化氧化CO及乙酸乙酯活性进行了评价。结果表明,OL具有典型的层状锰氧化物结构,适量掺杂Cu对OL的结构和织构影响不大,但Cu的掺杂明显影响Cu/OL的还原性、氧移动性及催化剂表面Cu2+/CuO、(Mn2++ Mn3+)/Mn4+和Oads/Olatt的比例。Cu/OL的催化性能与以上因素密切相关。在Cu/OL样品中,Cu5/OL催化剂具有最佳的催化活性(CO催化氧化,50= 70 °C和90= 100 °C;乙酸乙酯催化氧化50= 160 °C,90= 200 °C)。同时,Cu5/OL催化剂具有最佳的还原性能、氧移动性能和最多的Cu2+、(Mn2++ Mn3+)和表面吸附氧浓度。Cu/OL催化性能与铜锰之间相互作用、还原性和氧移动性能密切相关。
层状锰氧化物;Cu/OL;一氧化碳;乙酸乙酯;催化氧化
1 引言
CO是一种常见的大气污染物,主要是由含碳物质不完全燃烧产生的。CO催化氧化已在很多领域得到了广泛的应用,如:封闭式内循环CO2激光器、CO气体探测器、室内空气净化以及密闭空间微量CO的消除等1。挥发性有机物(VOCs,Volatile Organic Compounds)是在常温下以蒸汽形式存在于空气中的一类有机物,主要包括烃类、苯系物、酮、胺、醇、醚、酯、酸等,挥发性VOCs的危害很大,它会伤害人的肝脏、肾脏、大脑和神经系统,甚至致癌2,3。乙酸乙酯是一种非常重要的有机化工原料和极好的工业溶剂,广泛应用于精细化工,它是大气污染物VOCs的重要组成部分4。乙酸乙酯对眼、鼻、咽喉有刺激作用,持续大量吸入,可致呼吸麻痹。误服者可产生恶心、呕吐、腹痛、腹泻等,可致湿疹样皮炎,长期接触可致角膜混浊、继发性贫血等。目前VOCs的净化处理技术已成为环境催化领域的一个研究热点5,其中,催化燃烧法具有辅助燃料费用低、操作温度低、设备体积小、去除率高、无二次污染物等优点,是处理VOCs最有效的净化方法之一6,7。
目前,催化氧化CO和VOCs的催化剂主要有负载贵金属或过渡金属型氧化物。虽然负载型贵金属催化剂在低温条件下催化活性较高8,但是昂贵的价格限制了它们广泛的应用。因此寻找高效、廉价的负载型过渡金属催化剂去除CO和VOCs成为一个巨大的挑战。锰氧化物因其成本低,活性高且环保,成为替代贵金属催化氧化VOCs的最佳选择8,9。另外,锰氧化物因其优良的催化活性常被用于苯酚的催化分解10和VOCs的催化燃烧11。层状锰氧化物OL具有二维层状结构,由共边的[MnO6]八面体组成结构单元,其中,锰离子多为Mn4+并含有少量Mn3+和Mn2+,使OL具有丰富的活泼晶格氧物种,是较好的氧化催化剂。
目前,将OL应用于催化氧化CO和乙酸乙酯研究较少。本文采用氧化还原法制备OL催化剂,同时以OL为载体采用了离子交换法制备了负载型Cu/OL催化剂。并通过多种技术表征催化剂的结构和织构,研究其催化氧化CO和乙酸乙酯性能。
2 实验部分
2.1 催化剂的制备
2.1.1 载体OL催化剂的制备
将KOH (分析纯,北京化工厂)加入蒸馏水中配成KOH溶液(5 mol∙L−1);醋酸锰(分析纯,北京化工厂)加入蒸馏水中配成醋酸锰溶液(0.5 mol∙L−1);高锰酸钾(分析纯,北京化工厂)加入蒸馏水中配成高锰酸钾溶液(0.1 mol∙L−1)。
将70 mL KOH溶液(5 mol∙L−1)逐滴加入到40 mL的醋酸锰溶液(0.5 mol∙L−1)中,得到悬浮液;再将50 mL高锰酸钾(0.1 mol∙L−1)溶液逐滴加入上述悬浮液,得到黑色浆液,沉淀老化5天。过滤、洗涤数次,随后在80 °C下干燥 24 h,在马弗炉以1 °C∙min−1的升温速率程序升温到400 °C,在此温度下煅烧2 h,得到OL。
2.1.2 Cu/OL催化剂的制备
首先将Cu(NO3)2(分析纯,北京化工厂)加入蒸馏水配成硝酸铜溶液(0.12 mol∙L−1)。按照铜负载量为1% (w),称取一定量上述制备的OL加入硝酸铜溶液(0.12 mol∙L−1)中,加入一定量水,使固液比满足(1 g/50 mL),在室温下搅拌48 h,过滤、再用去离子水洗涤至数次,然后80 °C干燥24 h。将所制固体,置于马弗炉中以1 °C∙min−1的升温速率程序升温至400 °C,并保持400 °C焙烧2 h。所制样品记为Cu1/OL。以同样的方法,改变OL的质量,得到负载Cu负载量为% (w),记为Cu/OL (其中% (w)为Cu的负载量(w))。
2.2 催化剂的表征
X射线粉末衍射(XRD)实验在Bruker-axe公司D8-ADVANCE射线衍射仪上进行,入射光源为Cu靶,α辐射,入射波长为0.15405 nm,管电压50 kV,管电流30 mA,扫描范围2= 10°−80°,扫描速率3.5°∙min−1。
催化剂N2吸附/脱附结构表征:采用北京精微高博科学技术有限公司JW-BK-132F型测试仪在液氮温度下测定。样品首先在200 °C下真空脱气6 h,然后取出在液氮气氛(−196 °C)下测定N2的吸脱附等温线。通过BET(Brunauer-Emmett-Teller)方法计算样品的比表面积数据。
氧气的程序升温脱附(O2-TPD)采用北京彼奥德电子技术有限公司PCA-1200型化学吸附分析仪。取100 mg催化剂置于石英反应管中,先用He气在300 °C下吹扫 60 min;然后切换到5% O2/He吸附60 min,在5% O2/He氛围中降温至室温,再用He气吹扫60 min;最后待基线稳定后,以10 °C∙min−1升温速率升至900 °C进行程序升温实验。
氢气程序升温还原(H2-TPR)采用北京彼奥德电子技术有限公司生产的PCA-1200 型化学吸附分析仪。催化剂装填量为50 mg,在N2氛围下400 °C预处理30 min,随后N2吹扫冷却至室温,切换通入H2体积分数为6%的氢氮混合气,气体流量为12 mL∙min−1,以3 °C∙min−1的升温速率从室温升至850 °C进行还原,通过热导检测池检测H2的消耗量,以分析纯CuO作耗氢量校正。
热重分析实验是是在德国生产的NETZSCH STA 449 F5热重差热分析仪上进行测量,高纯氮气作为载气,流量为100 mL∙min−1。将样品在80 °C下干燥24 h后,不焙烧,直接称25 mg于坩埚中,在25 °C下保温50 min,然后从25 °C以10 °C∙min−1的速率升温至900 °C,记录样品质量随温度的变化。
扫描电子显微镜(Scan Electronic Microscopy,SEM)测定是使用日本电子株式会社(JEOL)型仪器JSM 6500F,加速电压为20 kV,真空度< 10−5Pa。
X射线光电子能谱(XPS)分析使用VG Scientific公司的Esca-Lab-220i型X射线光电能谱仪,使用Al-Kα射线为激发源,电压20 kV,电流30 mA,基础真空为3.06 × 10−7Pa,样品以污染碳的C1s结合能(284.7 eV)作为内标校正样品。
2.3 催化剂的评价
CO和乙酸乙酯催化氧化反应是在常压固定床流动微型石英管反应器中进行。反应管内径为8 mm,装入催化剂(0.1 g,40–60目)和等量的40–60目石英砂的混合物,将热电偶插入反应器内测量催化剂的实际温度。CO催化氧化实验,混合气组成为1% (体积分数)CO + 空气,反应气总流量50 mL∙min−1,空速30000 mL∙g−1∙h−1,进样气体和出口混合气采用Shimadzu GC-8A气相色谱在线分析,反应原料气O2、N2和CO采用TDX-01柱状分子筛进行分离,分别取反应前和反应后气体进行进样分析,根据CO峰面积百分比计算反应转化率。乙酸乙酯催化氧化反应,将计算量的一定流量的氮气流过含乙酸乙酯的恒温鼓泡器,并与空气混合,获得乙酸乙酯体积浓度2´10−3g∙m−3混合气,混合气的总流量为200 mL∙min−1,空速(SV)为120000 mL∙g−1∙h−1。反应前后气体采用天美GC-7900型气相色谱仪在线分析,采用SE-30柱子氢火焰离子化检测器(FID)分析有机物,乙酸乙酯的转化率通过反应前后乙酸乙酯的浓度变化计算12。
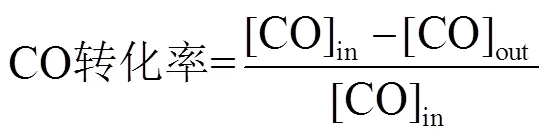
3 结果与讨论
3.1 XRD
图1为OL和Cu/OL的XRD谱图。所有样品在2= 12.5o,25.3o,29o,37.31°,42.60°,51.83°和58.33°处出现明显的衍射峰,分别对应birnessite型MnO2结构的(001),(002),(111),(110),(106),(004)和(203)晶面(JCPDS 18-0802),它们是birnessite晶体结构的特征衍射峰9。其中2= 12.5°的衍射峰是birnessite型层状锰氧化物(001)晶面的特征峰。通过计算所有样品的001大约是0.72 nm,表明birnessite层状结构中存在层间水分子和K+,通常层状锰氧化物birnessite可以写成KMnO2·H2O13。加入铜后,Cu/OL的XRD图中birnessite的特征峰仍然存在,除Cu1/OL样品,其余Cu/OL样品OL峰明显宽化,表明颗粒在变小。根据birnessite (111)的晶面参数,利用Scherrer’s方程计算出Cu/OL中OL颗粒平均大小分别为Cu1/OL (0.43 nm) > OL (0.26 nm) > Cu10/OL (0.23 nm) > Cu3/OL (0.21 nm) > Cu5/OL (0.18 nm)。进一步分析表明,Cu/OL (图1(b–e)的样品在2= 5.9°、38.7°、47.5°和58.5°处出现明显对应CuO(002)、(111)、(020)和(202)晶面的衍射峰(JCPDS 05-0661)14。当铜浓度较低,如:Cu5/OL对应CuO峰形较弱,表明CuO颗粒较小,高度分散在OL载体中,随着铜浓度增加,CuO峰强增大,表明铜物种颗粒增大。
3.2 SEM和N2-吸附/脱附
图2为OL和Cu/OL扫描电子显微镜(SEM)形貌照片。由图可知,所有样品都呈纳米纤维状,负载铜后,样品的形貌变化不大。
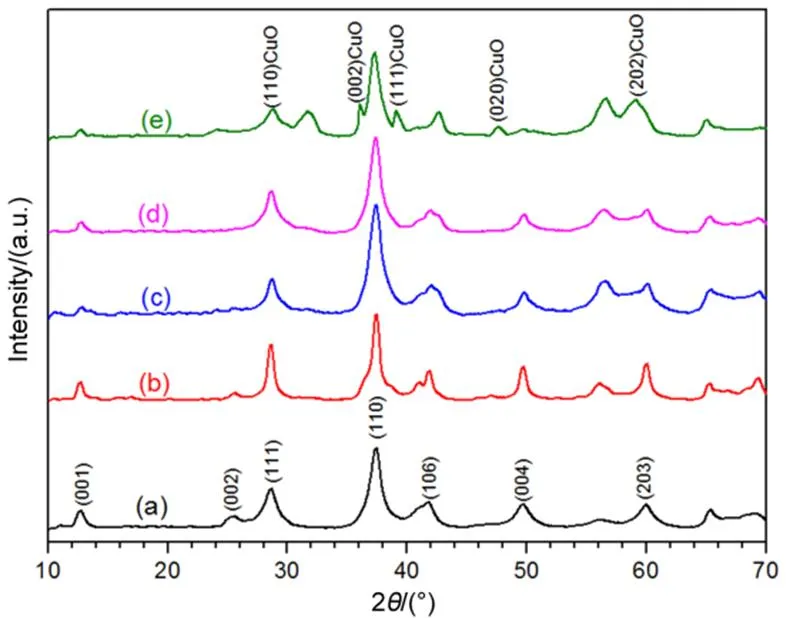
图1 OL (a) 和Cux/OL (b–e) 催化剂的XRD谱图

图2 OL (a) 和Cux/OL (b–e) 催化剂的SEM图
图3为OL和Cu/OL样品的N2-吸附/脱附等温线图。表1为样品的比表面积数据。由图3得出,OL和Cu/OL样品具有IV型等温线和H3型迟滞环,这表明其形成了狭缝状介孔结构,由SEM可知,其介孔结构可能是由纳米纤维状聚集而成15。对于Cu/OL样品,其比表面积随铜含量增加先增加后降低:Cu5/OL (47.9 m2·g−1) > Cu3/OL (43.6 m2·g−1) > Cu1/OL (39.4 m2·g−1) > Cu10/OL (38.3 m2·g−1) > OL (37.7 m2·g−1)。其顺序与以下的催化反应结果不一致,表明比表面积不是决定催化活性的唯一因素。随着Cu负载量的增加,其比表面积随之增加,这可能与Cu2+或Cu+进入了OL载体的骨架中,改善了OL结构。但随Cu负载量再增加,其比表面积减少,这可能是由于随负载量增加,Cu颗粒聚集在OL孔道附近,阻塞部分孔道。
3.3 H2-TPR
H2-TPR可以有效地表征催化剂的还原性能。为了研究Cu/OL催化剂的还原性能,测定其H2-TPR,并进行了分峰。图4显示了所有样品的H2-TPR谱图,表1为样品还原峰位置及计算出的样品耗氢量。OL载体(图4谱线a)分别在300 °C、375 °C和430 °C处出现一个弱峰和两个强峰。根据OL峰的耗氢量结果(表1),第一个峰和第二个峰的耗氢量之和与第三峰的比为2 : 1,所以可以归因于MnO2→ Mn3O4→ MnO的系列还原16。由于将MnO还原成金属态Mn的能量较高,所以500 °C还原结束时,不存在MnO → Mn0的还原峰,MnO应为MnO2还原的终态,这点通过OL还原后的XRD测定结果得到了证实(图略)。对于OL样品,耗氢量计算H/Mn摩尔比约为1.53,低于MnO2完全还原成MnO (MnO2+ H2→ MnO + H2O)的计算值(约为2.0),表明在OL中存在混合价态的离子Mn+(= 2, 3, 4)。
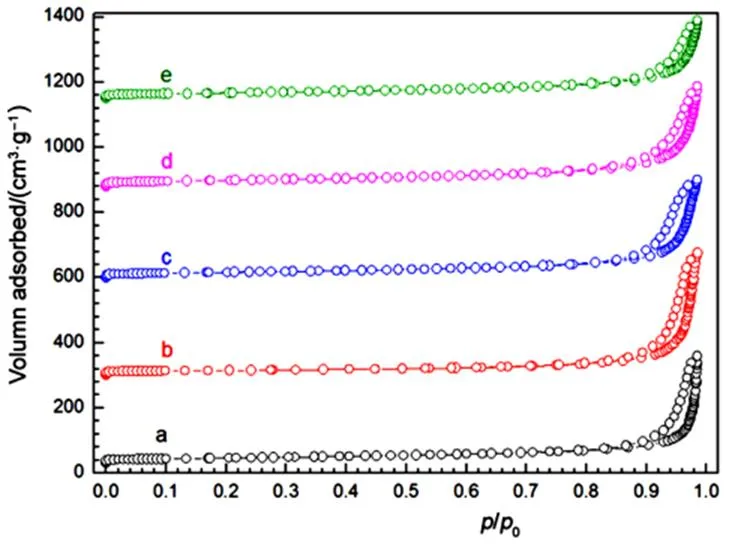
图3 OL (a) 和Cux/OL (b–e) N2-吸附/脱附等温线
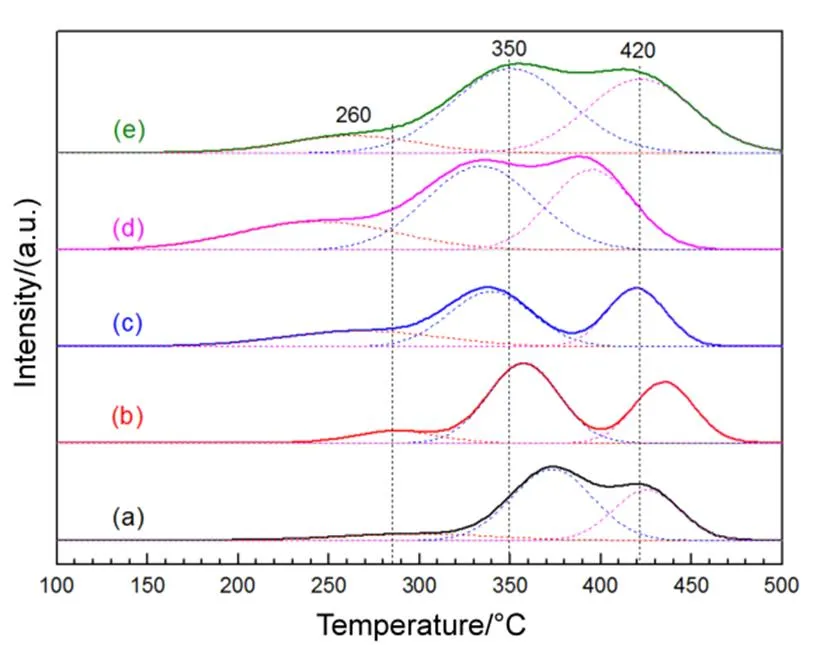
图4 OL (a) 和Cux/OL (b–e) 催化剂的H2-TPR图
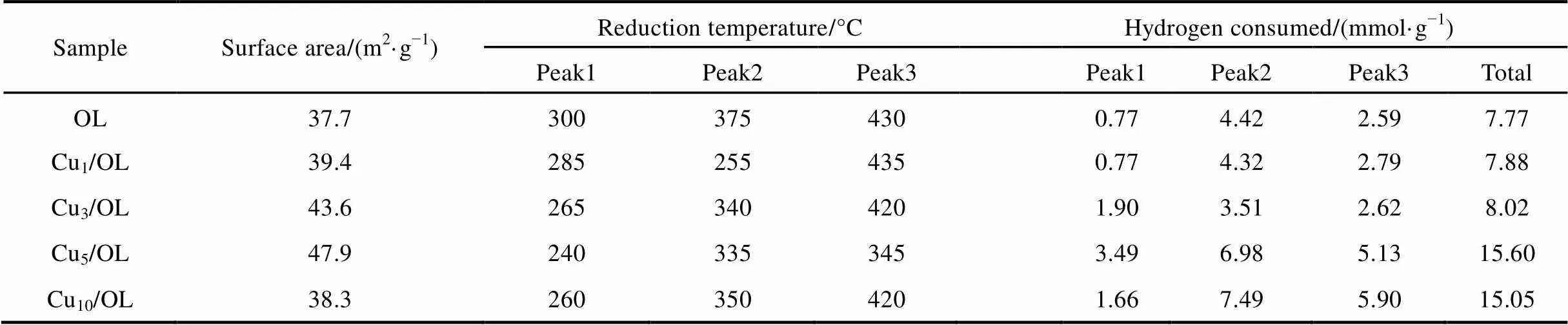
表1 OL和Cux/OL催化剂的BET和耗氢量分析
对于Cu/OL样品(图4谱线b–e),与载体OL(图4谱线a)相比,加入Cu能明显提高其还原性能,Cu/OL样品还原峰的位置和面积均发生明显改变。Cu1/OL,Cu3/OL,Cu5/OL和Cu10/OL分别在240–290 °C、330–370 °C和390–440 °C处出现三个还原峰。显然负载Cu使OL样品的还原温度降低,负载Cu明显促进了Cu/OL样品的还原。这可能是由于金属(如:Pt,Au,Rh和Ag)通过H2的溢流作用促进了OL样品中晶格氧的移动性,从而提高了OL的还原性能。从耗氢量结果,Cu/OL样品第一个峰和第二个峰的耗氢量之和与第三峰的比在(1.5–2.0) : 1之间,而载体OL的还原峰比例为2 : 1,表明在Cu/OL样品中存在CuO的还原,通常对于单负载的Cu基样品来说,300–400 °C左右存在两个还原峰分别对应高度分散的表面CuO和孤立态的Cu2+17,所以Cu/OL的还原峰对应Cu和Mn的还原,并且相互覆盖。以上结果表明,在Cu和OL之间存在强相互作用,这也由下面XPS结果得到证实,Li等18在研究负载型氧化锰催化剂时也得出了相同的结论。按照还原峰的温度(以最低还原峰为例),不同催化剂的还原峰温度排序为Cu5/OL (240 °C) < Cu10/OL (260 °C) < Cu3/OL (265 °C) < Cu1/OL (285 °C) < OL (300 °C)。与其他样品比较,Cu5/OL还原峰的对应温度最小为240 °C,表明Cu5/OL催化剂具有最高的还原性能19。

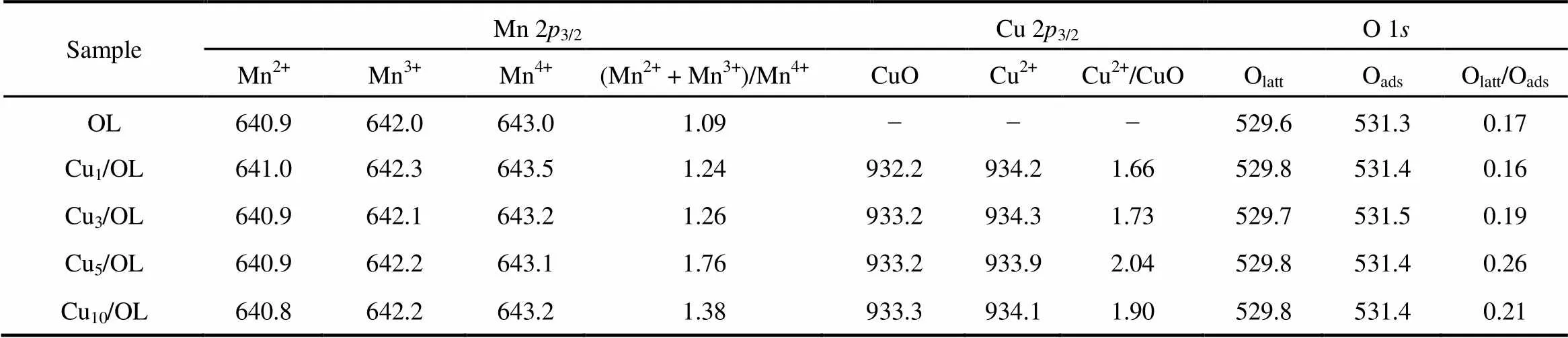
表2 OL和Cux/OL催化剂的XPS能谱分析
3.4 XPS
为检测样品表面元素成分和金属价态,图5和表2给出了Mn 2,Cu 2和O 1XPS图谱。图5(A)中所有样品的Mn 2都在 BE (Binding Energy) = 642.0 eV和654.0 eV处出现两个峰,分别对应Mn 23/2和Mn 21/2。Mn 23/2峰为不对称峰,通过分峰和依据文献20,在BE = 641.5 eV和643.5 eV处的Mn 23/2峰分属Mn3+和Mn4+,表明Cu/OL中有混合价的锰物种,这与以上H2-TPR结果一致。表2列出了(Mn2++ Mn3+)/Mn4+峰的面积的相对值。显然,(Mn2++ Mn3+)/Mn4+的值随着铜含量而变,其顺序为Cu5/OL(1.76) > Cu10/OL(1.38) > Cu3/OL (1.26) > Cu1/OL(1.24) > OL(1.09),其中Cu5/OL的(Mn2++ Mn3+)/Mn4+的值最高为1.76,表明其(Mn2++ Mn3+)量最多,对催化活性有一定的影响。
图5(B)中列出了所有样品的Cu 23/2XPS谱图。对于每个样品,XPS谱表现出不对称峰,可以分为三个部分:BE = 933.2−934.6 eV、BE = 935.6–936.2 eV和星峰BE = 943.4–944.0 eV。根据文献21,22,对于Cu 23/2峰值大于933.1 eV峰对应集聚态CuO和孤立Cu2+物种,通常Cu2+的BE值比CuO高,即,较低的峰值(933.2–934.6 eV)为集聚态CuO,较高的峰值(935.6–936.2 eV)是孤立Cu2+物种,所以测定其峰值可以区分铜物种。如表2所示,Cu含量明显影响Cu2+/CuO比值,其顺序为Cu5/OL (2.04) > Cu10/OL (1.90) > Cu3/OL (1.73) > Cu1/OL (1.66)。显然,Cu5/OL样品中Cu2+/CuO的比值最高为(2.04),Cu1/OL最低为(1.66)。可以看出所有Cu2+/CuO的比值大于1,表明在Cu/OL中孤立Cu2+物种高于集聚态CuO物种。而且,Cu/OL中Cu2+/CuO的顺序与(Mn2++ Mn3+)/Mn4+的顺序一致,这表明在Cu/OL氧化物中铜锰之间存在相互作用。这点与Haneda等23的研究结果一致。他们的XPS结果显示碱金属与Co3O4之间存在电子传输的相互作用,这种相互作用影响Co3O4的还原性质等。通常孤立Cu2+物种作用较强,而集聚态CuO作用较弱,本研究XPS结果表明,随着Cu浓度增加,Cu2+/CuO比值先增加,随后降低,Cu5/OL比值最高,表明Cu和Mn之间电子转移引起的相互作用最强,有利于H2溢流作用,使之还原更容易。比较还原峰峰温与Cu2+/CuO比值可以看出,Cu2+/CuO比值越高,其H2-TPR的还原峰温越低,还原能力越高。
图5(C)中列出了所有样品的O 1XPS谱图,样品在BE = 529.8 eV和BE = 531.9 eV处出现两个峰,分别对应表面晶格氧(Olatt)和吸附氧(Oads)。根据文献结果24,25,Oads的形成是由于表面氧空位的存在,表明在OL中存在不同价态的锰物种(Mn3+,Mn2+和Mn4+),这与Mn 23/2结果一致。从表2可以看出,不同铜含量催化剂中Oads/Olatt的比值也不同,其顺序为Cu5/OL (0.26) > Cu10/OL (0.21) > Cu3/OL (0.19) > Cu1/OL (0.17) > OL (0.16)。显然,Cu5/OL的Oads/Olatt比值最大。表明Cu5/OL表面有更多的氧空位和较低价态的锰原子,这与Mn 2的结果一致。
3.5 TG/DTG和O2-TPD
图6是载体OL型层状锰氧化物的TG和DTG图,其它Cu/OL样品结果相似,未显示。结果表明,OL存在4个失重峰。第一失重峰出现在90.5 °C,失重比例为1.77% (),主要对应表面吸附水和表面吸附氧的脱除;第二失重峰出现在486.4 °C,失重比例为4.6% (),对应表面氧物种脱除,即样品部分MnO2转化为Mn2O3;第三失重峰出现在554.8 °C,失重比例为3.03% (),对应样品的体相晶格氧进一步脱除,第四失重峰出现在785 °C,失重比例为2.31% (),此时对应样品全部MnO2转化为Mn2O3或者部分从Mn2O3分解成Mn3O4,层状空间结构完全塌陷26,27。以上结果表明OL的失重过程实际上是逐渐脱氧的过程。

图6 OL催化剂的热重分析
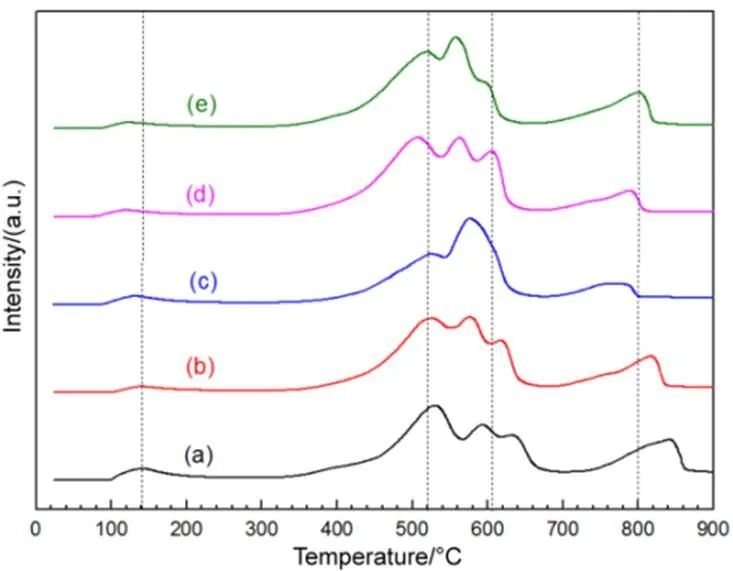
图7 OL (a) 和Cux/OL (b–e) 催化剂O2-TPD
图7为样品的O2-TPD谱图。每个样品的TPD谱图都有三个区域峰:一个是在100–200 °C下较小的低温峰LT,在300–700 °C较宽的中温峰MT以及在700–850 °C的高温峰HT。根据文献28和以上的热重分析可知,LT峰应为化学吸附氧峰,不存在吸附水峰,因在O2-TPD前,催化剂在300 °C下已经预热处理了1 h,气体检测前经过冷阱处理。300–700 °C的中温峰MT为体相化学吸附氧和晶格氧脱附峰,表示不同氧物种与Mn离子结合,最终生成Mn2O3;高温峰HT表示晶格氧的进一步脱出,最终转化成Mn3O4,因此,所有样品中的O2-TPD涵盖了大部分的氧物种。考虑到反应活性温度区在室温和200 °C之间,所以LT对应的温度是有催化作用的氧物种的脱附峰,所以本论文主要考虑铜的加入量对LT脱附氧温度的影响,对应催化剂的LT脱附温度排序为Cu5/OL (115 °C) < Cu10/OL (120 °C)
3.6 OL及Cux/OL催化剂上CO和乙酸乙酯催化氧化性能
图8为OL和Cu/OL催化剂上CO和乙酸乙酯催化氧化活性。通常用T表示催化剂催化转化率为%对应温度,T显示在表3中。空白实验(不加催化剂,石英空管反应),CO和乙酸乙酯在200 °C和400 °C下没有转化,表明在该温度下CO和乙酸乙酯与氧气不存在气相反应。
从图8可以看出,OL活性较低,其CO转化率为50%和90%对应的50和90分别为125 °C和175 °C,其乙酸乙酯转化率为50%和90%对应的50和90分别为210 °C和290 °C。加入Cu对反应活性有较大的影响,从图8可看出,Cu/OL催化氧化CO的50和90分别为70–120 °C和100–155 °C,催化氧化乙酸乙酯的50和90为160–190 °C和200–250 °C。其中活性最好的是Cu5/OL,其CO转化率的50和90分别为70 °C和100 °C,乙酸乙酯的50和90分别为160 °C和200 °C。
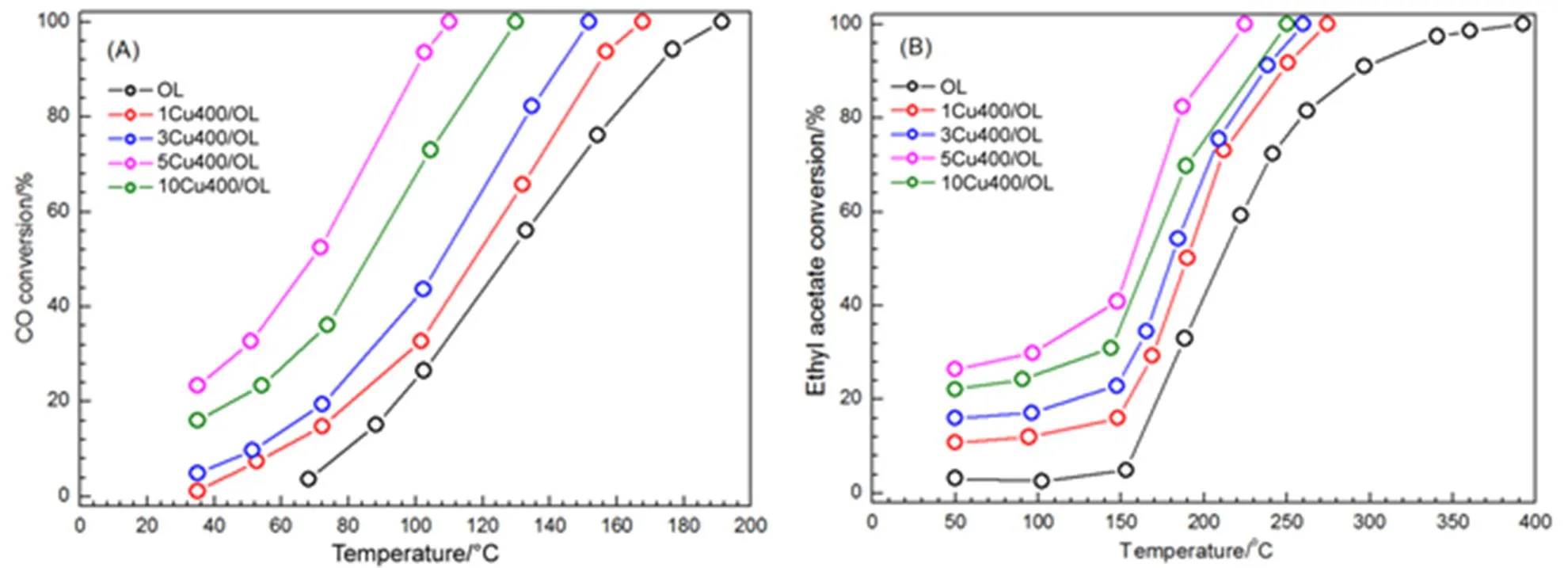
图8 OL和Cux/OL催化剂上CO和乙酸乙酯的催化反应活性
根据我们前期研究表明30,反应速率()可以更好地反映催化活性,为每秒每克催化剂转化CO和乙酸乙酯的摩尔数。表3分别为100 °C和180 °C条件下CO和乙酸乙酯的反应速率()。OL样品在100 °C的反应速率为9.8´10−7molCO/(gcats),这与Carabineiro等31报道的MnO,样品在100 °C的反应速率(7.2´10−8–1.09´10−6molCO/(gcats)数量级一致,但是低于Wang等32报道的100 °C时MnO的反应速率 (6.8´10−7–1.5´10−6molCO/(gcats)。铜的加入明显提高了催化剂的反应活性,Cu/OL在100 °C的反应速率(1.2´10−6molCO/(gcats)–3.4´10−6molCO/(gcats))远高于100 °C时PdFeMn/Cord的反应速率(3.1´10−7molCO/(gcats)33。根据计算,Cu/OL上反应速率顺序为:Cu5/OL > Cu10/OL > Cu3/OL > Cu1/OL > OL,与前面反应活性顺序一致。同样,对于乙酸乙酯的催化反应,OL的反应速率为9.0´10−7molethyl acetate/(gcats),Cu/OL的反应速率为1.4´10−6–2.3´10−6molethyl acetate/(gcats),以上反应速率远大于O。 Larsson等34制备的CuO-CeO2/Al2O3和CuMn2O4/Al2O3反应速率(2.3´10−8–9.1´10−8molethyl acetate/(gcats),根据计算,Cu/OL上乙酸乙酯反应速率的大小顺序为:Cu5/OL > Cu10/OL > Cu3/OL > Cu1/OL> OL,这与乙酸乙酯催化反应活性结果一致。

表3 OL和Cux/OL在100 °C和180 °C条件下CO和乙酸乙酯的反应速率(r)
通常认为CO催化氧化反应按Mars-van反应机理进行,大量研究表明,有机化合物的氧化也遵循Mars-van Krevelen机制35。对于Cu和Mn体系,研究认为在反应过程存在Cu2+/Cu+、Mn4+/Mn3+和活性O2−物种36,反应关键是活性氧物种的供应,可还原的表面氧和晶格氧循环过程:
2Cu2+-O2−-Mn4++ 2COads↔ 2Cu+-Vo-Mn3++ 2CO2
2Cu+-Vo-Mn3++ O2ads↔ 2Cu2+-O2−-Mn4+
2COads+ O2ads→ 2CO2(Vo代表氧空位)
CO吸附在Cu2+-O2−-Mn4+氧物种表面反应生成CO2和Cu+-Vo-Mn3+,然后Cu+-Vo-Mn3+又被反应气中的O2氧化成Cu2+-O2−-Mn4+,如此进行催化循环。在反应过程中,CO分子被金属氧化物(Cu2+-O2−-Mn4+)中可还原晶格氧吸附成活性COads,同时O2分子也被Cu+-Vo-Mn3+中的氧空位吸收成O2ads,最终吸附的COads和O2ads迅速转化为CO2,因此,催化剂的活性与催化剂的还原性、氧移动性能和吸附性能密切相关,Mars-van-Krevelen机理与晶格氧和气相氧交换有关。因此,氧移动性和催化剂的还原性对锰氧化物的催化氧化很重要。
如图8和表3所示,CO和乙酸乙酯氧化的催化活性的顺序为Cu5/OL > Cu10/OL > Cu3/OL > Cu1/OL > OL,与样品O2-TPD、H2-TPR和Oads/Olatt对应的氧移动性、还原性能和吸附氧浓度一致。Cu5/OL具有最高的催化氧化CO和乙酸乙酯活性,对应其也具有最高的氧移动性、还原性能和吸附氧浓度。因此,高的氧移动性、还原性能和吸附氧浓度产生更高的催化活性,即:Cu/OL催化氧化CO和乙酸乙酯性能,与样品的还原性能、氧移动性能和吸附氧浓度有关,与铜和锰的物种之间的相互作用有关。
4 结 论
采用氧化还原法合成了层状锰氧化物(OL),以OL为载体采用离子交换法制备了不同Cu含量的Cu/OL催化剂。Cu掺杂对OL的物理化学性质和催化氧化CO和乙酸乙酯的性能产生明显影响。
(1) XRD、BET和SEM结果表明,掺杂Cu使OL颗粒略有变小,比表面积略有减小,但没有改变OL的晶型结构;
(2) H2-TPR表明,Cu的掺杂后,由于氢的溢流作用,Cu明显促进了Cu/OL的还原;
(3) XPS表明,Cu掺杂改变Cu/OL表面Cu、Mn、O的价态含量,表明Cu和Mn之间存在相互作用;
(4) O 1和O2-TPD结果表明,Cu掺杂明显促进了Cu/OL的表面吸附氧浓度和氧的移动性;
(5) Cu掺杂明显促进了Cu/OL催化剂的催化氧化CO和乙酸乙酯性能,其中Cu5/OL具有最佳活性(CO氧化,50= 70 °C和90= 100 °C;乙酸乙酯氧化50= 160 °C,90= 200 °C)。
结合Cu/OL样品的表征结果和催化性能表明,Cu/OL样品的催化性能与催化剂还原性能、氧移动性能及铜锰的相互作用力密切相关。
(1) Wang, Y. Z.; Zhao, Y. X.; Liu, S. S.. 2003,(8), 8. [王永钊, 赵永祥, 刘滇生. 环境工程学报, 2003,(8), 8.] doi:10.3969/j.issn.1673-9108.2003.08.002
(2) Zhang, X. D.; Wang, Y.; Yang, Y. Q.; Chen, D.2015,(9), 1633. [张晓东, 王 吟, 杨一琼, 陈 丹. 物理化学学报, 2015,(9), 1633.]doi: 10.3866/PKU.WHXB201507281
(3) Gardner, S. D.; Hoflund, G. B.; Schryer, D. R.; Schryer, J.; Upchurch, B. T.; Kielin, E. J.1991,(10), 2135. doi: 10.1021/la00058a027
(4) Chen, J.; Li, J.; Li, H.; Huang, X.; Shen, W.. 2008,(1–3), 586. doi:10.1016/j.micromeso.2008.05.029
(5) Duan, M. H.; Li, J. J.; Chu, X.; Wang, J. M.2010,(3), 46. [段明华, 李进军, 褚 霞, 王家明. 工业催化. 2010,(3), 46.] doi:10.3969/j.issn.1008-1143.2010.03.008
(6) Li, W. B.; Gong, H.. 2010,(4), 885. [黎维彬, 龚 浩. 物理化学学报, 2010,(4), 885.] doi: 10.3866/PKU.WHXB20100436
(7) Gandhe, A. R.; Rebello, J. S.; Figueiredo, J. L.; Fernandes, J. B.2007,(1–2), 129.doi:10.1016/j.apcatb.2006.10.017
(8) Zhou, H.; Wang, J. Y.; Chen, X.; O’Young, C. L.; Suib, S. L.1998,, 315. doi: 10.1016/S1387-1811(98)00034-1
(9) Deng, Y. Q.; Zhang, T.; Au, C. T.; Yin, S. F.2013,, 117. doi:10.1016/j.apcata.2013.07.015
(10) Deguzman, R, N.; Shen, Y. F.; Neth, E. J.; Suib, S. L.; Levine, S.; Newsam, J. M..1994,(6), 815. doi: 10.1021/cm00042a019
(11) Luo, J.; Zhang, Q. H.; Huang, A. M.; Suib, S. L.. 2000,(6), 209. doi: 10.1016/S1387-1811(99)00221-8
(12) Ge, J.; Zhuo, L.; Yang, F.; Tang, B.; Wu, L.; Tung, C.2006,(36), 17854. doi: 10.1021/jp0631127
(13) Carno, J.; Ferrandon, M.; Bjornbom, E.; Jaras, S.1997,(2), 265. doi:10.1016/S0926-860X(97)80129-9
(14) Post, J. E.; Veblen, D. R.. 1990,, 477.
(15) Hu, H. M.; Deng, C. H.; Sun, F. X.; Zhang, K. H.; Sun, M.; Xuan, H.. 2012,(2), 405. [胡寒梅, 邓崇海, 孙凤霞, 张克华, 孙 梅, 宣 寒. 无机化学学报, 2012,(2), 405.]
(16) Kapteijn, F.; Singoredjo, L.; Andreini, A.; Moulijn, J. A.1994,(2−3), 173. doi:10.1016/0926-3373(93)E0034-9
(17) Ma, Z. Y.; Yang, C.; Wei, W.; Li, W. H.; Sun, Y. H.2005,(1–2), 75. doi:10.1016/j.molcata.2004.12.026
(18) Tsuji, Y.; Imamura, S.ysis; Elsevier Press: Amsterdam, The Netherlands, 1993.
(19) Xu, R.; Wang, X.; Wang, D. S.; Zhou, K. B.; Li, Y. D.. 2006,(2), 426. doi:10.1016/j.jcat.2005.10.026
(20) Ferrandon, M.; Carno, J.; Jaras, S. D.1999,(1–2), 141.doi: 10.1016/S0926-860X(98)00326-3
(21) Muilenbergy, G. E.;Perkin Elmer Corporation: MA, USA, 1979.
(22) Wang, J.; Liu, Z.; Feng, G; Chang, L; Bao, W.2013,, 101. doi: 10.1016/j.fuel.2012.09.046
(23) Haneda, M.; Kintaichi, Y.; Bion, N.; Hamada, H.2003,, 473. doi: 10.1016/S0926-3373(03)00287-X
(24) Dong, Y.; Niu, X.; Zhu, Y.; Yuan, F.; Fu, H.. 2011,(2), 242. doi: 10.1007/s10562-010-0490-1
(25) Xia, Y.; Dai, H.; Jiang, H.; Zhang, L.. 2010,(15), 1171. doi: 10.1016/j.catcom.2010.07.005
(26) Gaillot, A. C.; Lanson, B.; Drits, V. A.. 2005,(11), 2959. doi: 10.1021/cm0500152
(27) Ma, R.; Bando, Y.; Zhang, L. Sasaki, T.. 2004,, 918. doi: 10.1002/adma.200306592
(28) Yin, Y. G.; Xu, W. Q.; Suib, S. L.; Oyoung, C. L.. 1995,(16), 4187. doi: 10.1021/ic00120a025
(29) Jiratova, K.; Mikulova, J.; Klempa, J.; Grygar, T.; Bastl, Z.; Kovanda, F.2009,(1–2), 106. doi:10.1016/j.apcata.2009.04.004
(30) Ye, Q.; Zhao, J. S.; Huo, F. F.. 2013,, 20. doi: 10.1016/j.micromeso.2013.01.007
(31) Carabineiro, S. A. C.; Bastos, S. S. T.; Orfao, J. J. M.; Pereira, M. F. R.; Delgado, J. J.; Figueiredo, J. L.. 2010,(3–4), 217. doi: 10.1007/s10562-009-0251-1
(32) Wang, L. C.; Liu, Q.; Huang, X. S.; Liu, Y. M.; Cao, Y.; Fan, K. N.2009,(1–2), 204. doi:10.1016/j.apcatb.2008.09.031
(33) Huang, Q.; Yan, X.; Li, B.; Xu, X.; Cheng, Y.; Zhu, S.; Shen, S.2013,(2), 438. doi: 10.1016/j.jiec.2012.08.031
(34) Larsson, P, O.; Andersson, A.2000,(3–4), 175. doi: 10.1016/S0926-3373(99)00104-6
(35) Sun, H.; Liu, Z.; Chen, S.; Quan, X.. 2015,, 58. doi: 10.1016/j.cej.2015.02.017
(36) Liu, X. S.; Jin, Z. N.; Lu, J. Q.; Wang, X. X.; Luo, M. F.. 2010,(1), 151. doi:10.1016/j.cej.2010.05.015
Cu-Doped Octahedral Layered Birnessites Catalysts for the Catalytic Oxidation of CO and Ethyl Acetate
FU Zhi-Dan ZANG Jia-Xin YE Qing*CHENG Shui-Yuan KANG Tian-Fang
()
Octahedral layered birnessite (denoted as OL) was synthesized by the oxidation-reduction method and a series of Cu/OL catalysts were prepared by the ion exchange method with various Cu loadings. The materials were characterized by X-ray diffraction (XRD), scanning electron microscopy (SEM), N2adsorption- desorption, hydrogen temperature-programmed reduction (H2-TPR), X-ray photoelectron spectroscopy (XPS), thermogravimetric (TG) and .oxygen temperature-programmeddesorption(O2-TPD) techniques, and their catalytic activities for CO and ethyl acetate oxidation were evaluated. The results show that OL is a typical octahedral layered structure, and the doping of Cu hardly affects the structure of OL. Moreover, Cu/OL samples had different reducibility, oxygen mobility, and atomic ratio of Cu2+/CuO, (Mn2++ Mn3+)/Mn4+,and Oads/Olattafter the addition of Cu to OL. Among the Cu/OL samples, the Cu5/OL sample showed the best activity for the catalytic oxidation of CO and ethyl acetate (50= 70 and90= 100 °C for CO oxidation;50= 160 °C and90= 200 °C for ethyl acetate oxidation). Cu5/OL showed the best reducibility, most isolated Cu2+species, highest surface (Mn2++ Mn3+)/Mn4+atomic ratio, highest chemisorbed oxygen species, and lowest O2desorption temperature. Hence, factors such as the strong interaction between copper and manganese, good reducibility, and oxygen mobility were responsible for the excellent catalytic activity of Cu5/OL.
Octahedral layered birnessite; Cu/OL; Carbon monoxide; Ethyl acetate; Catalytic oxidation
March 17, 2017;
April 20, 2017;
April 28, 2017.
. Email: yeqing@bjut.edu.cn; Tel: +86-10-67391659.
10.3866/PKU.WHXB201704282
O643
The project was supported by the National Natural Science Foundation of China (21277008, 20777005) and Natural Science Foundation of Beijing, China (8082008) and Project of Construction of Innovative Teams and Teacher Career Development for Universities and Colleges Under Beijing Municipality (IDHT20140504)
国家自然科学基金(21277008, 20777005), 北京市自然科学基金(8082008)和北京市教委教师队伍建设(IDHT20140504)资助项目
猜你喜欢
杂志排行
物理化学学报的其它文章
- Development and Validation of a Reduced Chemical Kinetic Mechanism for HCCI Engine of Biodiesel Surrogate
- Cobalt@cobalt Carbide Supported on Nitrogen and Sulfur Co-Doped Carbon: an Efficient Non-Precious Metal Electrocatalyst for Oxygen Reduction Reaction
- 非离子表面活性剂Triton X-100溶液在不同生长期小麦叶片表面的润湿行为
- Efficient Synthesis of Sulfur and Nitrogen Co-Doped Porous Carbon by Microwave-Assisted Pyrolysis of Ionic Liquid
- First-Principles Study: the Structural Stability and Sulfur Anion Redox of Li1−xNiO2−ySy
- S掺杂促进Fe/N/C催化剂氧还原活性的实验与理论研究
