棘孢木霉组合应用对杨树生长和光合特性影响
2018-01-09刘照莹姜传英翟彤彤姚志红刘志华张荣沭
刘照莹 姜传英 翟彤彤 常 媛 姚志红 刘志华 张荣沭*
(1.东北林业大学园林学院,哈尔滨 150040; 2.东北林业大学林学院,哈尔滨 150040)
棘孢木霉组合应用对杨树生长和光合特性影响
刘照莹1姜传英1翟彤彤1常 媛1姚志红1刘志华2张荣沭1*
(1.东北林业大学园林学院,哈尔滨 150040;2.东北林业大学林学院,哈尔滨 150040)
为研制复方棘孢木霉菌肥制剂,在大田条件下将等浓度(5×103cfu·cm-3土)不同组合的棘孢木霉(Trichodermaasperellum)分生孢子T1(Ta536+Ta4)、T2(Ta536+Ta4+Ta492)和T3(Ta536+Ta4+Ta492+Ta650)根施山新杨(Populusdavidiana×P.albavar.Pyramidalis)组培移栽苗,研究棘孢木霉组合施用对山新杨生长及光合特性的影响。方差分析结果表明,诱导时间和不同处理对苗高、地径、叶绿素含量、叶绿素a/b值、Pn、Cond、Ci和Tr均有显著影响(P<0.05):处理组的山新杨苗高、地径及干物质量均在不同程度上高于对照组(CK),作用效果为T3>T2>T1>CK;60 d时,T3、T2和T1组杨树苗生物量分别比CK增加17.99%、14.28%和10.54%;15 d时叶绿素含量比CK分别提高7.79%,6.91%和4.17%;叶绿素a/b值分别比CK提高7.79%、5.84%和4.73%。此外,处理组净光合速率(Pn)、胞间CO2浓度(Ci)、气孔导度(Cond)、蒸腾速率(Tr)均高于CK,并且处理组的最大净光合速率、表观量子效率以及光饱和点均高于CK。同时,诱导时间和不同处理的交互作用对检测的多数指标(除Pn和Ci外)均具有显著影响(P<0.05)。说明4个棘孢木霉菌株组合施用具有协同作用,能提高菌株对环境条件的适应性,增强促生长和改善光合的作用效果。并且T3组对山新杨苗的影响最大、作用速度最快。
山新杨;棘孢木霉;协同作用;促生长;光合作用
在农林生产中,化学肥料的普遍使用带来许多负面影响,如造成耕地板结、土壤肥力下降、酸化等问题。生物肥料具有不污染环境、改良土壤、作用持久等优点,已引起人们的高度重视。木霉菌(Trichodermaspp.)是一类优良的生物肥料,能促进种子萌发[1~3]、植株的开花和生长[4~6]、提高植物的生物量[7~10]、增强植物对病原菌的拮抗能力[11~13]、改善土壤肥力[14~16]。可见木霉菌在农林生产中发挥越来越重要的作用,具有极大的应用前景。
光合作用是植物生长发育的基础,同时又是一个对环境条件变化十分敏感的生理过程。山新杨的光合生理参数可以作为评价其生产力和适应性的重要指标[17]。木霉菌对植物光合生理影响的作用机制尚未明确。因此,研究木霉菌诱导后植物的生长状况和光合生理生化指标,具有重要的现实意义。现阶段对木霉菌的研究,较多的集中在单一菌株的应用,多株木霉组合施用对植物光合生理影响的报道较少,对木本植物研究的更少。单一的木霉菌株对植物有促生长作用,但效果不稳定,易受环境条件的影响,在使用效果上受到一定限制。因此,可以将具有协同促进植物生长的多株木霉进行组合施用,以达到优势互补的目的,提高单一菌株的有效性,增强其稳定性。本研究将4个不同来源的棘孢木霉进行不同组合施用,以不施用棘孢木霉为对照组,研究不同处理组对山新杨树苗生长状况和光合作用的影响,结果将为研制复方棘孢木霉生物菌肥提供理论依据。
1 材料与方法
1.1 材料
供试菌株:T.asperellumACCC30536(Ta536)、T.asperellumACCC32492(Ta492)、T.asperellumACCC31650(Ta650)和T.asperellum(Ta4),信息见表1。
供试植物:山新杨组培移栽树苗,培养方法同姜传英等[18]。2014年4月20日选取高度和长势一致的组培苗,进行移栽驯化,并将幼苗置于室温内自然光下生长。实验用土取自本市农田地表土。

表1 棘孢木霉菌种信息
1.2 木霉对峙培养实验
分别将活化的4个木霉菌株的菌饼(5 mm)接种在直径为9 cm的培养皿中进行对峙培养,Ta536与Ta4两株对峙为T1;Ta536、Ta4和Ta492三株对峙为T2;Ta536、Ta4、Ta492和Ta650四株对峙为T3。每个菌碟接种在距离培养皿边缘1 cm处,将培养皿放置在26℃的培养箱中倒置培养5 d,观察菌落生长状态。
1.3 实验方法
在无菌条件下,按照姜传英等[18]的方法获得棘孢木霉分生孢子,按照T1、T2和T3组合用自来水配制成混合分生孢子悬浮液,备用。
将温室驯化的山新杨组培移栽苗于2014年6月10日栽入21 cm×21 cm的营养钵中,置于东北林业大学园林学院花卉研究所苗圃内自然条件下生长。于7月11日在山新杨根际施用5×103cfu·cm-3土的棘孢木霉分生孢子,以不施用分生孢子的山新杨为对照组(CK),随机区组法设计,每处理为10株苗,设3个重复。各组杨树苗均采用相同的大田管理方法。
1.4 指标的测定
1.4.1山新杨高度和地径的生长动态、生物量干重和根冠比的测定
2014年7月10日(根施木霉0 d),用直尺和游标卡尺分别测量幼苗的苗高和地径,每隔10 d测量一次,共测量7次。
9月10日(根施木霉60 d),将杨树苗从营养钵中取出,按照姜传英等[18]的方法进行清洗、收集和测量根、茎和叶组织鲜重。再将各部位样品烘干,分别称量干重并计算根冠比,分析棘孢木霉对杨树苗苗高和地径生长动态、干重和根冠比的影响。
1.4.2 叶绿素含量的测定
在根施木霉菌0、3、6、9、12和15 d时,采集无病虫害、无机械损伤、整齐一致的成熟叶,按照王学奎[19]的方法测定叶绿素含量。
1.4.3 光合日变化测定
于2014年8月下旬,选择晴朗无风的天气,每一个处理选取3株长势一致的杨树苗,并在其上部分别选择3片生长健壮的成熟顶生叶片。采用LI-6400XT便携式光合仪,在8:00~16:00,自然光照射下,按照姜传英等[18]的方法测定叶片的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Cond)和胞间CO2浓度(Ci)等光合指标日变化。每隔2 h测定1次。
1.4.4 光响应曲线的特征参数测定
利用LI-6400XT内置6400-02LED红蓝光源和6400-01 CO2注入系统,于8月下旬选择三个晴天,在9:00~12:00测量光合—光响应曲线。选取朝向一致、无病虫害、长势健硕的顶生成熟叶片。采用姜传英等[18]的方法进行测定,记录不同光照强度下的净光合速率,每一光照梯度测定3个叶片,每个叶片读取数据3次。
采用Farquhar模型[20]进行光响应曲线拟合,计算最大净光合速率(Pnmax)、暗呼吸速率(Rd)以及表观量子效率(AQY)等参数。理论公式如下:
Pn={EQ+Pnmax-sqrt[(QE+Pnmax)2-4QPnmaxEk]}/(2k)-Rd
(1)
式中:Pn为净光合速率;E为光照强度;Pnmax为最大净光合速率;Q为表观量子效率(AQY);k为曲角;Rd为暗呼吸速率。
将0~200 μmol·m-2·s-1低光强下的光响应曲线进行线性回归分析。光补偿点(light compensation point,LCP)和光饱和点(light saturation point,LSP)是利用低光条件下(PAR≤200 μmol·m-2·s-1)的Pn与PAR构建的线性方程所得。直线与X轴的交点就是LCP(μmol photons·m-2·s-1);该直线与Y=Pnmax直线相交,交点所对应X轴的数值即为LSP(μmol photons·(m-2·s-1)。
1.5 数据分析
测得的数据采用Microsoft Office Excel 2007软件包及Minitab16.0数据处理系统进行处理。对同一时间点的处理与对照间的差异显著性进行ANOVA分析,在P=0.05下比较差异性。并对处理(CK、T1、T2和T3)和时间这两个因子对株高、茎围、叶绿素含量及光合日变化的影响在P=0.05水平下进行双因子方差分析,比较差异性。
2 结果与分析
2.1 对峙培养
图1为各组合棘孢木霉菌株对峙培养5 d时形态。观察发现,4个棘孢木霉菌株对营养和空间的竞争力、产孢能力均相近,能友好共生。
2.2 山新杨生长变化分析
2.2.1 苗高和地径的生长动态
根施棘孢木霉分生孢子后,处理组山新杨苗高(Height,H)逐渐高于对照组(CK)(表2)。根施木霉10 d时,T3组山新杨苗高显著高于CK(P<0.05)。木霉诱导30 d后,处理组山新杨苗高均显著高于CK(P<0.05),且HT3>HT2>HT1>HCK。60 d时,T3、T2、T1组苗高分别是CK的1.22、1.17、1.12倍。由此得出,三组棘孢木霉菌株组合均能够促进山新杨苗高的增加,且T3(Ta536+Ta492+Ta4+Ta650)组的作用效果最好(表2)。
三组棘孢木霉对山新杨地径(Basal stem,BS)的生长均有促进作用(表2)。木霉菌诱导初期各组山新杨地径差异不大。但木霉菌诱导20 d,T3、T2、T1组幼苗地径均显著高于CK(P<0.05)。60 d时,试验组与对照组杨树苗地径差异最大,这与苗高的生长动态一致。此时,T3、T2、T1组山新杨地径分别比CK增加1.03、0.83、0.64 mm。对比试验组杨树苗地径的大小可知,木霉诱导20~60 d内,T3组杨树苗地径均明显高于T2和T1组,说明T3组(Ta536+Ta492+Ta4+Ta650)对山新杨幼苗地径的生长促进作用最好。

图1 棘孢木霉4个菌株不同组合的对峙培养A. Ta536; B. Ta4; C. Ta492; D. Ta650; E. Ta536+Ta4; F. Ta536+Ta4+Ta492; G. Ta536+Ta4+Ta492+Ta650Fig.1 Dual culture of T.asperellum strains different combinationsA. Ta536; B. Ta4; C. Ta492; D. Ta650; E. Ta536+Ta4; F. Ta536+Ta4+Ta492; G. Ta536+Ta4+Ta492+Ta650
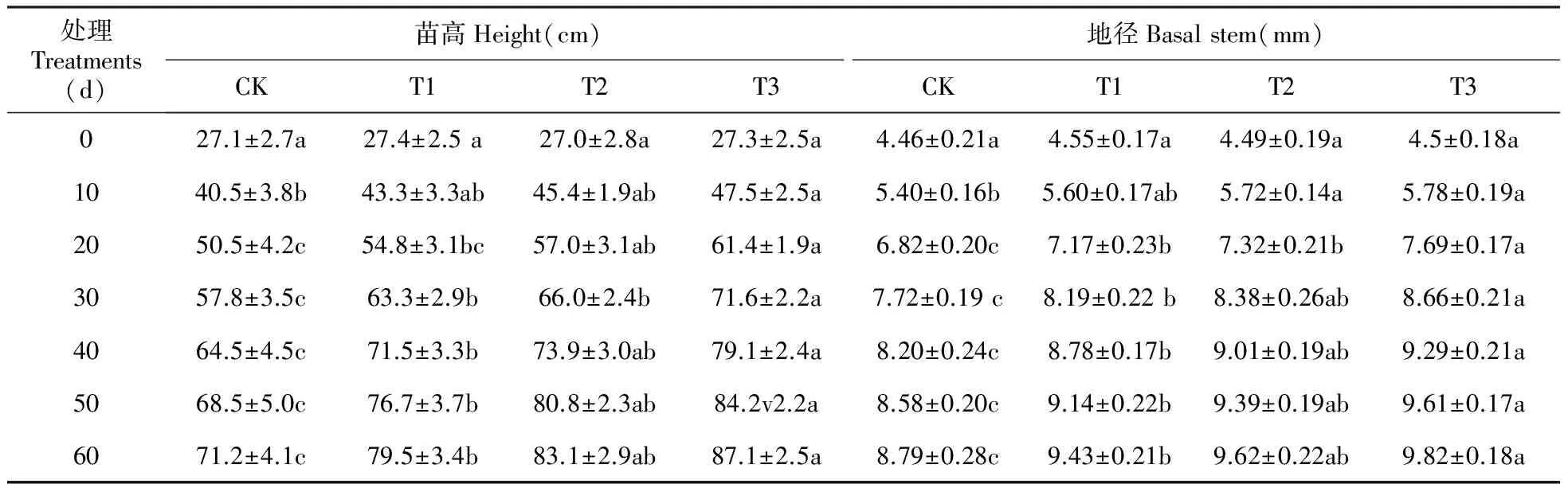
表2 棘孢木霉处理后山新杨幼苗苗高和地径的生长动态
注:CK代表对照组;T1、T2和T3分别代表木霉(Ta536+Ta4),(Ta492+Ta536+Ta4),(Ta536+Ta4+Ta492和Ta650)处理组;图中不同小写英文字母表示在0.05水平上差异显著 下同。
Note:CK represents the control group; T1,T2 and T3 represent the groups inoculated with(Ta536 and Ta4),(Ta492,Ta536 and Ta4),(Ta536,Ta4,Ta492 and Ta650),respectively; Different lowercase letters in English mean significant difference at 0.05 level The same as below.
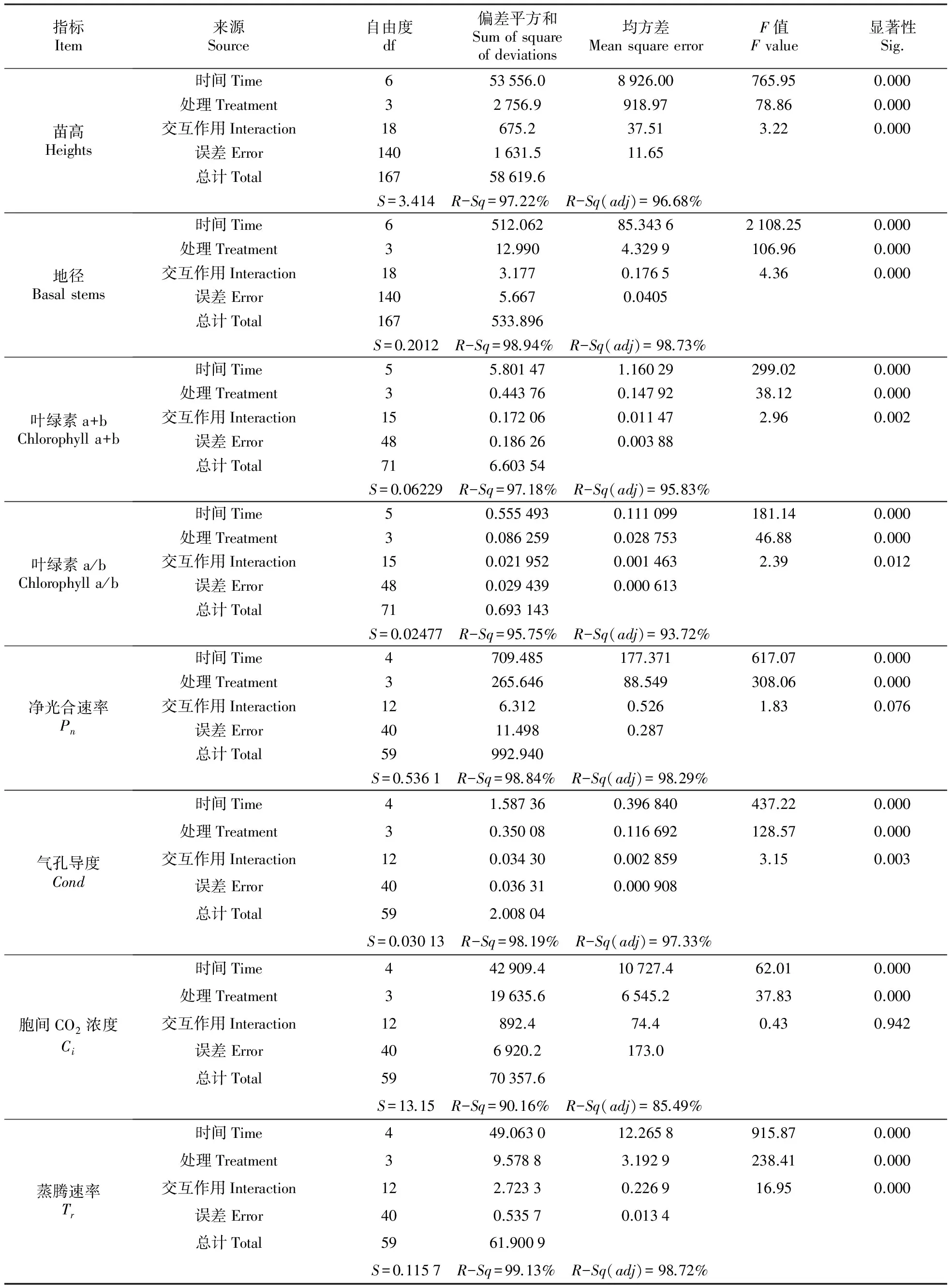
表3 时间和处理交互作用双因子方差分析
注:S.标准方差;R-Sq.误差占总误差的百分比;R-Sq(adj).调整的R-Sq
Note:S. Standard deviation;R-Sq. Percentage of total error;R-Sq(adj). AdjustedR-Sq
对影响山新杨苗高和地径的因子(木霉菌诱导时间和处理)进行交互作用双因子方差分析,结果如表2所示,时间和处理两个因子的P值均小于0.05,说明木霉诱导时间与不同处理对山新杨苗高和地径均有显著影响(P<0.05),并且,时间和处理双因子的交互作用对苗高和地径也具有显著影响(P<0.05)(表3)。
2.2.2 干重和根冠比
试验组山新杨根、茎、叶的干重均高于对照组,且T3组杨树苗根、茎干重显著高于CK(P<0.05),而各组山新杨叶组织干重差异不显著(图2)。将各组织部位干重相加获得四组杨树苗生物量干重,其从大到小顺序依次为T3>T2>T1>CK,并且T3、T2和T1组杨树苗生物量分别比CK增加17.99%、14.28%和10.54%。由此得出,三组棘孢木霉组合均可促进山新杨幼苗生物量的增加,且T3组(Ta536+Ta492+T4+Ta650)效果最好。
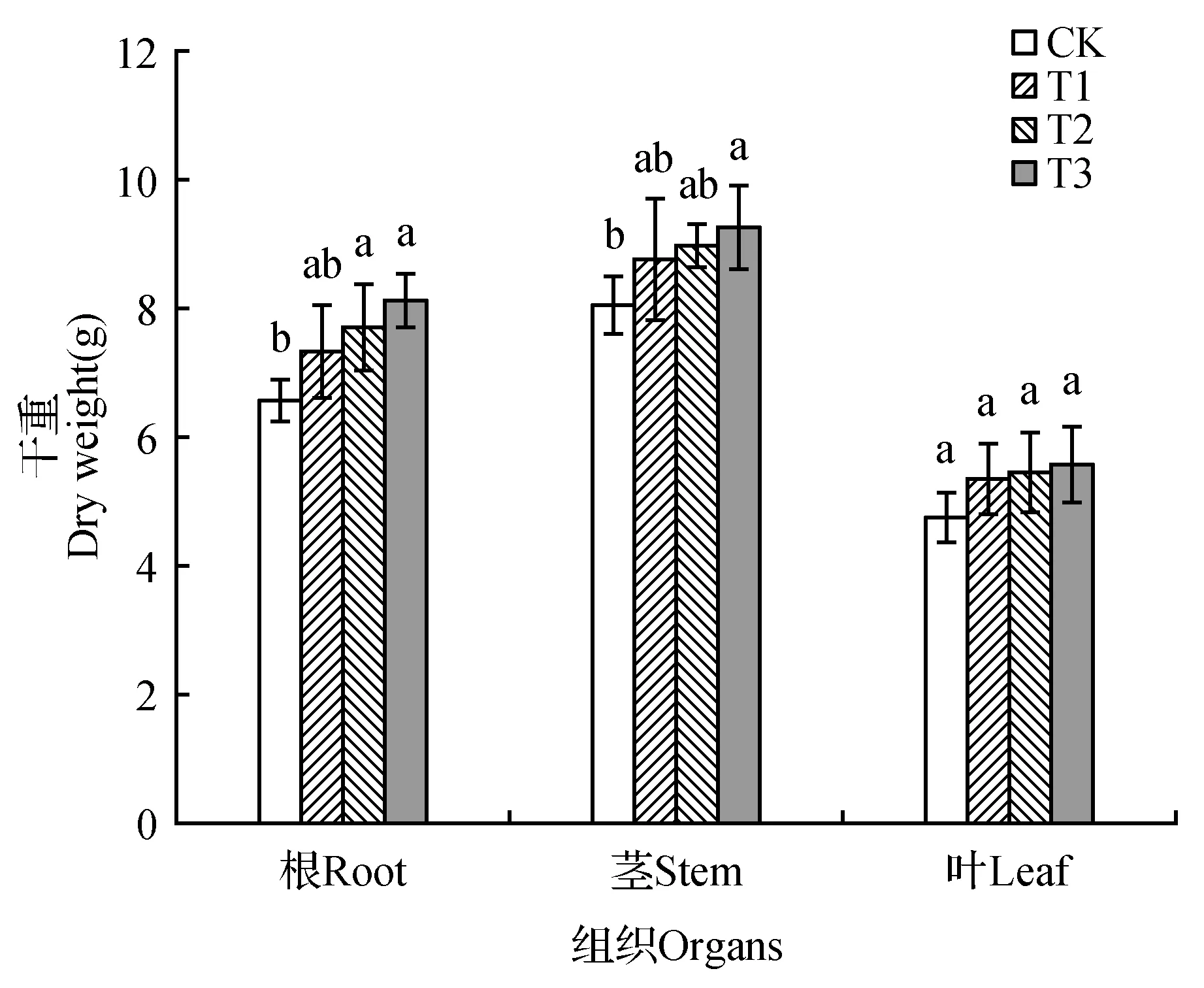
图2 棘孢木霉处理后山新杨幼苗不同组织干重Fig.2 The dry weights of different tissues of poplar seedlings treated by T.asperellum
由图3可见,处理组山新杨幼苗的根冠比均大于对照组,且T3组山新杨根冠比显著高于CK(P<0.05)。T3、T2和T1杨树苗根冠比分别是CK的1.063、1.038和1.014倍。可见,T3组使山新杨幼苗根冠比的增量最大。
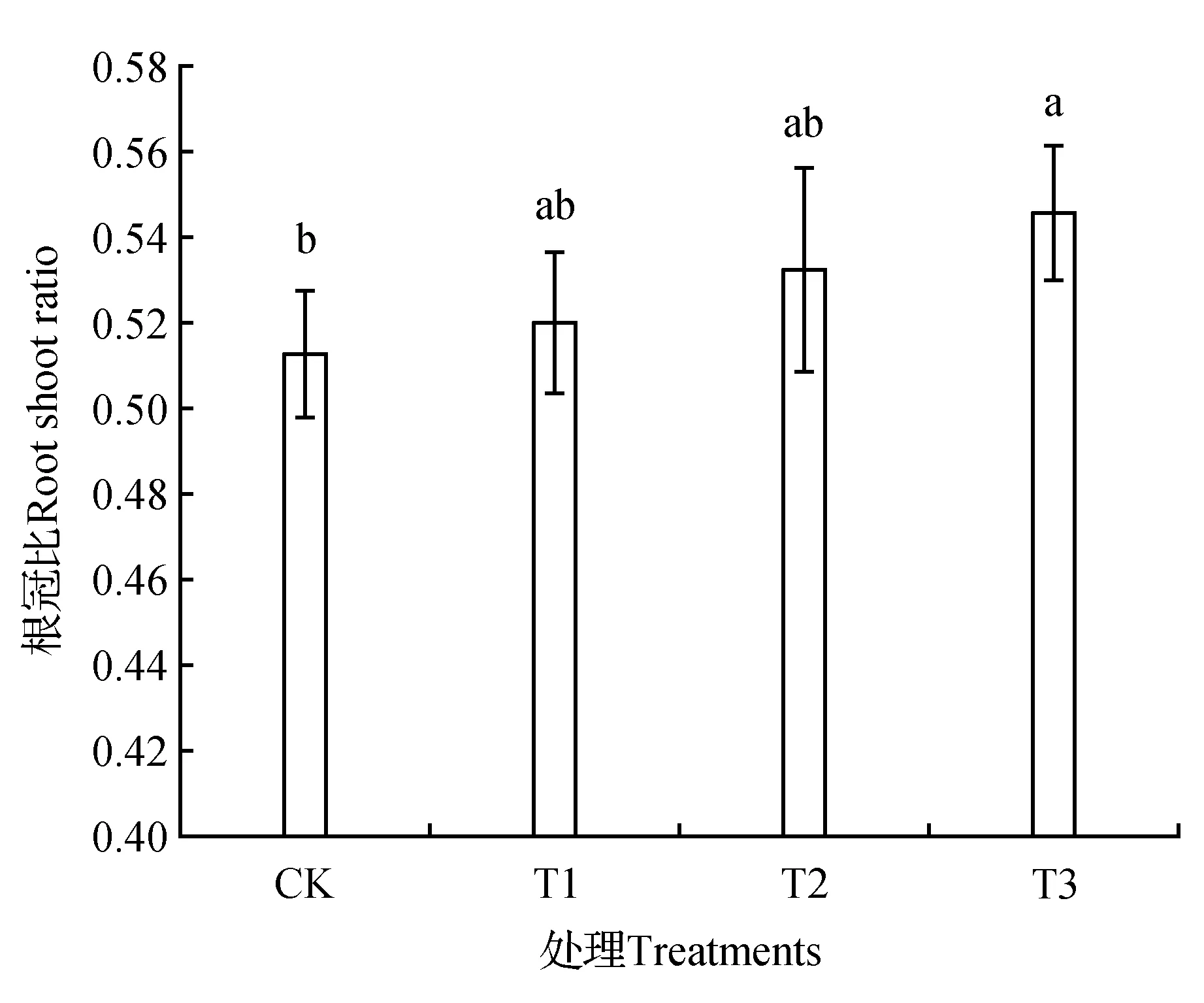
图3 棘孢木霉处理后山新杨幼苗根冠比Fig.3 Root shoot ratio of poplar seedlings treated by T.asperellum
2.2.3 叶绿素含量
试验组与对照组的叶绿素含量变化趋势一致,呈上升趋势(表4)。木霉菌诱导6 d时,试验组叶绿素含量显著高于对照组(P<0.05),T3、T2和T1组山新杨叶绿素含量比CK分别提高10.47%、6.63%和7.80%。木霉诱导后6~15 d内,试验组山新杨叶绿素含量多数时刻要显著高于对照组(P<0.05)。
三组棘孢木霉分生孢子均可提高山新杨叶绿素a/b值(表4)。木霉诱导6 d时,T3组叶绿素a/b值显著高于CK(P<0.05)。木霉诱导12 d后,试验组山新杨叶绿素a/b值显著高于对照组。15 d时,T3、T2和T1组叶绿素a/b值分别比CK提高7.79%、5.84%和4.73%。结果说明,根施三组棘孢木霉均能够提高山新杨叶绿素含量,增大叶绿素a/b。
对影响山新杨叶绿素(a+b)和叶绿素a/b值的因子(木霉菌诱导时间和处理)进行交互作用双因子方差分析,结果如表3所示,时间和处理两个因子的P值均小于0.05,说明木霉诱导时间与不同处理对山新杨叶绿素(a+b)和叶绿素a/b值均有显著影响(P<0.05)。并且,对于叶绿素(a+b),时间和处理双因子的交互作用也有显著影响(P<0.05)(表3)。
2.3 山新杨光合生理日变化特征
2.3.1 净光合速率日变化
三组棘孢木霉均可有效提高山新杨净光合速率(Pn)(图4)。试验组与对照组山新杨净光合速率(Pn)日变化趋势一致,先升高后下降,均在12:00出现峰值(图4)。试验组山新杨净光合速率在检测时刻均显著高于对照组(P<0.05),而不同试验组净光合速率差异不显著。此外,在12:00~16:00时, 山新杨净光合速率逐渐下降, 而对照组Pn下降幅度要比试验组Pn大。16:00时,T1、T2与T3组叶片净光合速率分别是CK的1.44、1.53、1.57倍。说明三组棘孢木霉均可有效提高山新杨净光合速率。
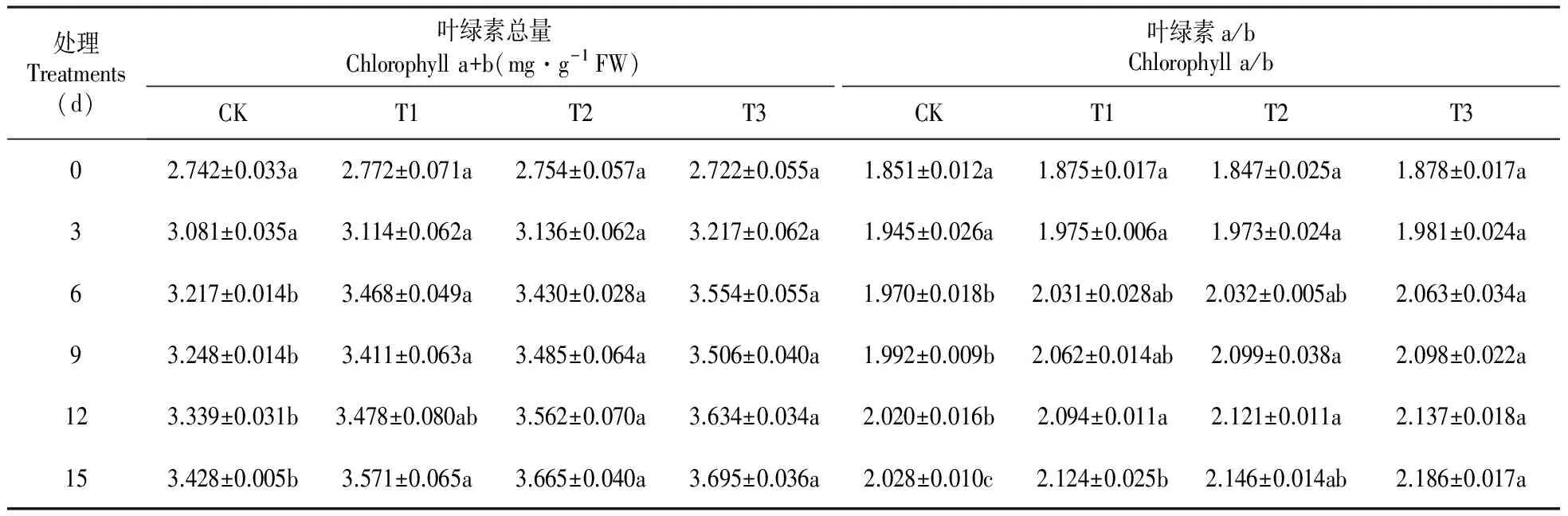
表4 棘孢木霉处理后山新杨幼苗叶片中叶绿素含量及叶绿素a/b
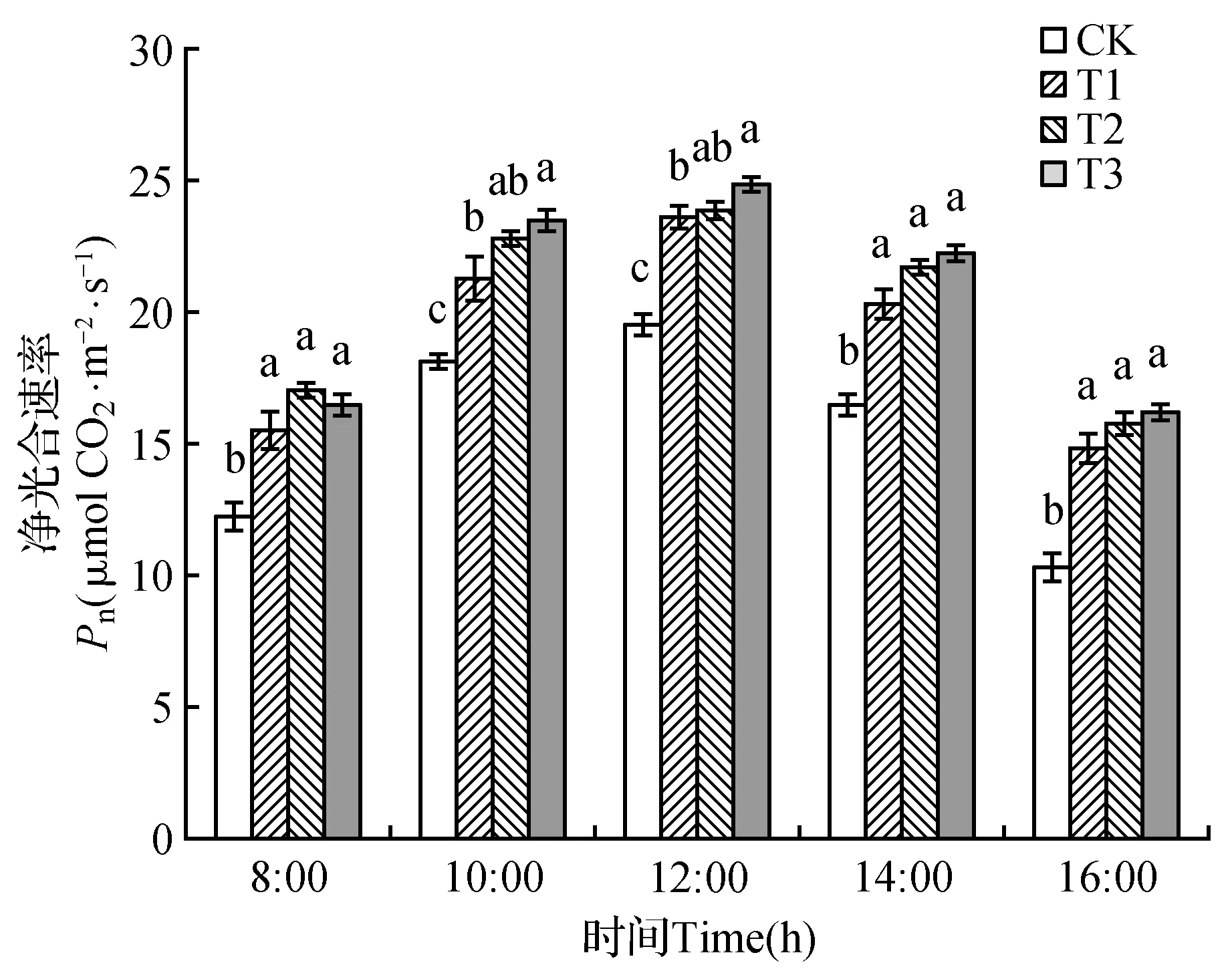
图4 棘孢木霉处理后山新杨幼苗叶片中净光合速率日变化Fig.4 Diurnal variation of Pn of poplar seedlings treated by T.asperellum
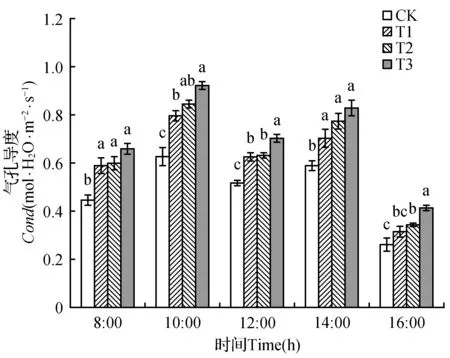
图5 棘孢木霉处理后山新杨幼苗气孔导度日变化Fig.5 Diurnal variation of Cond of poplar seedlings treated by T.asperellum

图6 棘孢木霉处理后山新杨幼苗胞间CO2浓度的日变化Fig.6 Diurnal variation of Ci of poplar seedlings treated by T.asperellum
2.3.2 气孔导度日变化
对照组与处理组山新杨叶片气孔导度(Cond)日变化趋势一致,均呈双峰型,分别在10:00和14:00时达到峰值。通过比较各组山新杨Cond值发现,处理组山新杨Cond值均显著高于对照组(除16:00的T1组)(P<0.05)。在10:00时,T1、T2与T3组山新杨气孔导度分别为0.796、0.844、0.923 mol·H2O·m-2·s-1,而CK叶片Cond值仅为0.628 mol·H2O·m-2·s-1。在14:00,T1、T2与T3组Cond值分别是CK的1.19、1.31、1.40倍。由数据可知,施用棘孢木霉能够有效促进山新杨气孔的张开,这将有利于植物的光合作用。
2.3.3胞间CO2浓度日变化
处理组与对照组山新杨叶片胞间CO2浓度(Ci)日变化趋势一致,先降后升,呈“V”字型(图6)。在8:00~12:00时,随着光照强度的增强,光合作用也在增强,CO2的消耗量在增加,导致Ci降低。在12:00时,出现波谷,Ci达到最低。此时,T1、T2、T3组叶片Ci分别为197.85、209.23、214.71 μmol CO2·mol-1,较CK分别增加了13.53%、20.06%和23.21%,表现为显著差异(P<0.05)。12:00以后,净光合速率降低,消耗CO2的能力减弱,而气孔也逐渐开放,从而导致Ci上升。比较各组山新杨叶片Ci日变化发现,处理组叶片Ci明显高于对照组。并且,T2与T3组叶片Ci显著高于CK(除16:00的T2组),而T1组仅在8:00与12:00时显著高于CK(P<0.05)。
2.3.4 蒸腾速率的日变化
由图7可见,处理组与对照组的蒸腾速率(Tr)日变化趋势一致,呈“双峰型”,这与气孔导度(Cond)日变化趋势相同。在8:00~10:00时,Tr迅速增加;在10:00~12:00时,Tr略下降;在12:00~14:00时,Tr又小幅度上升;之后迅速下降。处理组山新杨叶片Tr在检测时刻(除8:00外)均显著高于对照组(P<0.05),并且T3组Tr要显著高于T1、T2组(除10:00外),而T1与T2组Tr差异不显著。
对影响山新杨Pn、Cond、Ci和Tr值的因子(木霉菌诱导时间和处理)进行交互作用双因子方差分析,结果如表3所示,时间和处理两个因子的P值均小于0.05, 说明木霉诱导时间与不同处理对山新杨叶片Cond、和Tr均有显著影响(P<0.05),对于Pn和Ci,P值分别为0.076和0.942,说明无显著影响(P<0.05)(表3)。

图7 棘孢木霉处理后山新杨幼苗蒸腾速率的日变化Fig.7 Diurnal variation of Tr of poplar seedlings treated by T.asperellum
2.4 光合—光响应曲线特征参数
利用Farquhar模型进行光响应曲线拟合获得最大净光合速率(Pnmax)、表观量子效率(AQY)、暗呼吸速率(Rd)等光合特征参数(表5)。AQY、Rd均未达到显著差异,处理组山新杨Pnmax要显著高于对照组(P<0.05),T1、T2、T3组分别高于CK组5.99%、11.25%和28.60%。此外,T3组Pnmax显著高于T1、T2组,分别比T1、T2组高21.34%、15.60%。说明三组棘孢木霉均可有效提高山新杨幼苗最大净光合速率,且T3组(Ta536+Ta492+T4+Ta650)效果最好,为幼苗积累有机物奠定了基础。各组山新杨AQY、Rd无显著差异(P<0.05)。
在低光强PAR≤200 μmol·m-2·s-1下,对Pn-PAR进行直线回归,计算获得LSP和LCP(表5)。处理组山新杨的LSP明显高于CK组,其中,LSPT3比LSPCK高12.46%,达到显著差异水平(P<0.05),而T1、T2组与CK组差异不显著。此外,处理组山新杨LCP均小于CK组,但无显著差异(P<0.05)。光补偿点(LCP)反映了植物对弱光的利用效率,而光饱和点(LSP)反映了植物对强光的适应能力。提高植物的LSP和降低LCP可以增加植物对光能的利用率,有利于植物体内有机物的积累。从表5可知,T3组杨树苗LCP值最小,而LSP最大,说明T3组山新杨对光能的利用率最高(表5)。
3 讨论
木霉菌是一种普遍存在的益生真菌,作为生物肥料被应用于农林生产中。木霉菌促进植物生长的作用已引起国内外研究者的高度重视。如哈茨木霉能提高玉米(Zeamays)、马铃薯(Solanumtuberosum)、辣椒(Capsicumannuum)、烟草(Nicotianatabacum)、长春花(Catharanthusroseus)和菊花(Dendranthemamorifolium)等植物的发芽率、株高,增加干湿重[5,21~22]。本研究将棘孢木霉4个菌株按照不同组合根施山新杨,结果表明4个棘孢木霉菌株对营养和空间的竞争力、产孢能力均相近,培养皿中能友好共生。不同组合的3个处理都能提高山新杨叶的光合作用效率,促进山新杨的生长,增加生物量。其中4个菌株共同施用山新杨,促生长作用起效快,效果最好。
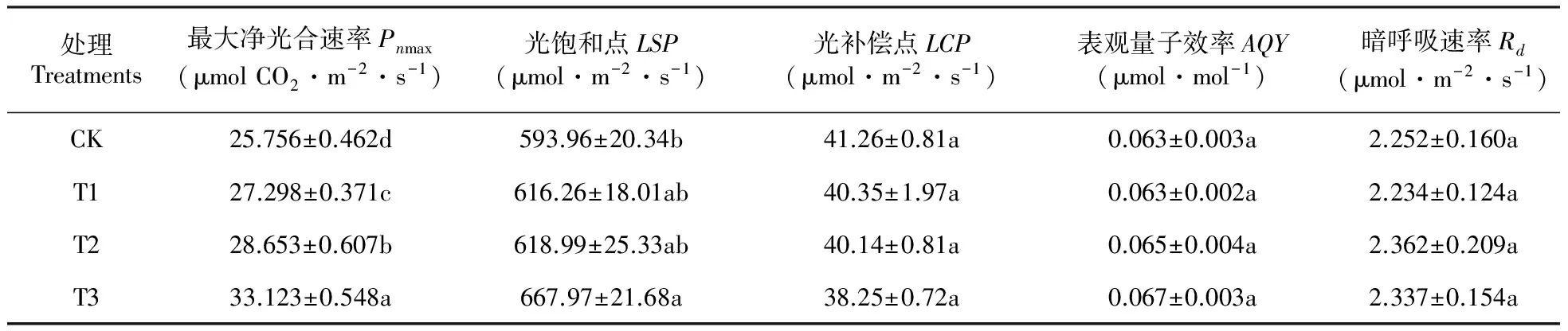
表5 棘孢木霉处理对山新杨幼苗Pnmax、LSP、LCP、AQY和Rd的影响
植物根系能够固持植物体、吸收贮存能量,同时还起到传输营养的作用。根冠比是指植物根系与地上部干重的比值,是反映植物根系与地上部的生长状况的重要指标,易受环境条件的影响[23]。研究发现,在白三叶草(Trifoliumrepens)中施用木霉菌可以使根系长度增加[3]。这说明木霉菌能促进植物根的生长。张敏[24]等喷施木霉L24,对小麦的根长有促进作用。本研究发现通过施用不同组合的棘孢木霉菌,增大了山新杨根冠比,T3>T2>T1>CK,发达的根系为山新杨创造良好的生长条件,有利于杨树苗吸收土壤中的养分、水分和微量元素,进而促进地上的茎和叶的生长。这与张树武[3]、张敏[24]等的研究结果一致。
叶绿素的存在是光合作用的必要条件[25]。植物通过叶绿素将CO2和水转化成糖来维持生命活动。绝大部分叶绿素起到吸收和传递光能的作用,仅有部分的叶绿素a可以起到转换光能的作用[26]。说明叶绿素a在植物能量转换过程中具有重要作用。叶绿素含量影响植物的光能利用效率,其含量会因季节和环境条件而改变[27~28]。有研究表明,施用哈茨木霉后增加了番茄(Lycopersiconesculentum)叶片的叶绿素含量,提高了光合作用的能力,有利于积累有机物,使植物生长发育增快[29~30]。本研究根施不同组合的棘孢木霉诱导山新杨,改变了杨树苗生长的环境。随着诱导时间的延长,杨树苗叶绿素含量和叶绿素a/b比值逐渐增高。在诱导15 d时,山新杨叶绿素含量和叶绿素a/b比值均达到最高,且T3>T2>T1>CK。这为提高山新杨光合效率奠定了基础。
光合作用是植物赖以生存的基础,同时对环境条件的变化十分敏感[31]。本研究发现,处理组山新杨幼苗的净光合速率、蒸腾速率、胞间CO2浓度和气孔导度等生理指标均有不同程度的提高,尤其是在10:00~14:00时间段,光照强度大、叶表面温度高,大气中CO2浓度偏低,处理组的这4个指标仍均显著高于CK,且T3组的作用效果最好。光合光响应曲线参数LCP、LSP、Pnmax和AQY是反映植物利用光能能力和效率的重要指标[32]。处理组的Pnmax均显著高于CK(P<0.05);T3组的LSP显著高于CK(P<0.05),这说明,多株木霉组合施用,能使山新杨对强光的适应性增强。由此得出,根施棘孢木霉菌能够通过影响叶绿素含量、叶绿素a/b值以及提高光合生理指标来促进山新杨树苗的生长。并且发现组合的菌株越多,协同促进杨树苗生长的作用效果越好。棘孢木霉菌调动杨树苗光合代谢生理的机制有待于今后在光合相关信号途径中基因表达、蛋白调控和小分子代谢等层面进行深入研究。
木霉的种类、木霉种间(外源种与固有种之间)及与其它微生物之间的互作,存在不同的差异[33],筛选出高效、协同作用的木霉菌株对研制复方木霉菌肥制剂极为重要。现研究单株木霉菌对植物光合作用影响的较多,对多种或单种多株木霉组合对植物生长和光合作用的研究相对较少。由于多株木霉混合施用不仅可以发挥其单株菌株的功效;同时,具有协同作用的木霉菌能增强其各自单独施用对植物的促生作用,因此在农林生产中复合菌肥具有广阔的推广应用前景。本研究将棘孢木霉菌株组合施用,比先前单独根施山新杨的研究的作用效果都好[17~18]。总之,多株棘孢木霉分生孢子组合根施山新杨,对幼苗的生长和光合作用都有积极的影响,木霉菌株量增多,有利于适应环境、提高其促进植物生长效果,本研究为棘孢木霉复方菌肥的研发提供理论依据。
1.穆红梅,杨重军,何宝玉.哈茨木霉对三种作物种子萌发及生长的影响[J].吉林农业科学,2014,39(5):5-7.
Mu H M,Yang C J,He B Y.Impact ofTrichodermaSolution on Seed Germination and Growth of Three Crops[J].Journal of Jilin Agricultural Sciences,2014,39(5):5-7.
2.尹大川,杨立宾,邓勋,等.绿木霉对樟子松苗木生长指标及生理生化指标的影响[J].北京林业大学学报,2015,37(1):78-83.
Yin D C,Yang L B,Deng X,et al.HowTrichodermavirensaffects growth indicators,physiological and biochemical parameters ofPinussylvestrisvar.mongolicaseedlings[J].Journal of Beijing Forestry University,2015,37(1):78-83.
3.张树武,徐秉良,程玲娟,等.深绿木霉对白三叶草促生作用及生理生化特性的影响[J].草业学报,2015,24(2):161-167.
Zhang S W,Xu B L,Cheng L J,et al.Effects ofTrichodermaaureoviridefermentation on the growth and physiological characteristics ofTrifoliumrepens[J].Acta Prataculturae Sinica,2015,24(2):161-167.
4.陈建爱,王未名,刘益同.生物复合肥木霉T1010对花生生长的影响[J].花生学报,2008,37(3):29-32.
Chen J A,Wang W M,Liu Y T.Effect ofTrichodermaaurevirideT1010 Compound Fertilizer on Growth of Peanut[J].Journal of Peanut Science,2008,37(3):29-32.
5.Chang Y C,Baker R,et al.Increased growth of plants in the presence of the biological control agentTrichodermaharzianum[J].Plant Disease,1986,70(2):145-148.
6.陆宁海,吴利民,田雪亮,等.哈茨木霉RT-12对黄瓜幼苗促生作用的机理[J].江苏农业学报,2007,23(3):254-255.
Liu N H,Wu L M,Tian X L,et al.Mechanism ofTrichodermaharzianumRT-12 on Cucumber Seedling Growth[J]. Jiangsu Journal of Agricultural Sciences,2007,23(3):254-255.
7.梁志怀,魏林,郑明福,等.哈茨木霉发酵产物对豇豆产量和品质的影响[J].湖南农业科学,2005(5):38-40,43.
Liang Z H,Wei L,Zheng M F,et al.Effects of the Fermentation Filtrate ofTrichodermaharzianumon Yield and Quality of Cowpea[J].Hunan Agricultural Sciences,2005(5):38-40,43.
8.Lorito M,Woo S L,Harman G E,et al.Translational Research onTrichoderma:From ‘Omics to the Field[J]. Annual Review of Phytopathology,2010,48(1):395.
9.Yedidia I,Benhamou N,Chet II. Induction of Defense Responses in Cucumber Plants(CucumissativusL.) by the Biocontrol AgentTrichodermaharzianum[J].Applied and Environmental Microbiology,1999,65(3):1061-1070.
10.Martínez-Medina A,Del Mar Alguacil M,Pascual J A,et al.Phytohormone Profiles Induced byTrichodermaIsolates Correspond with Their Biocontrol and Plant Growth-Promoting Activity on Melon Plants[J].Journal of Chemical Ecology,2014,40(7):804-815.
11.Harman Gary.Myths and Dogmas of Biocontrol Changes in Perceptions Derived from Research onTrichodermaharzinumT-22[J].Plant Disease,2000,84(4):377-393.
12.张量,张敬泽.渐绿木霉抑菌物质的分离纯化及其对植物病原菌的抑制作用[J].中国农业科学,2015,48(5):882-888.
Zhang L,Zhang J Z.Isolation and Purification of Active Compound fromTrichodermaviridescensand Its Inhibitory Activities Against Phytopathogens[J].Scientia Agricultura Sinica,2015,48(5):882-888.
13.陈方新,齐永霞,戴庆怀,等.哈茨木霉对几种植物病原真菌的拮抗作用及其抗药性测定[J].中国农学通报,2005,21(11):314-317.
Chen F X,Qi Y X,Dai Q H,et al.In-lab determination of antagonism against several plant pathogenic fungi and resistance to fungicides ofTrichodermaharzianum[J].Chinese Agricultural Science Bulletin,2005,21(11):314-317.
14.吕曼曼,刘志华,王慧,等.棘孢木霉对杨树苗栽培土理化性质及养分的影响[J].植物研究,2015,35(2):289-296.
Lü M M,Liu Z H,Wang H,et al.Effects ofTrichodermaasperellumon the Physical and chemical properties and chemical properties and nutrient components of the pot coil culturing tissue-culturedPopulusdavidiana×P.bolleanaSeedlings[J].Bulletin of Botanical Research,2015,35(2):289-296.
15.曹云,常志州,马艳,等.沼液施用对辣椒疫病的防治效果及对土壤生物学特性的影响[J].中国农业科学,2013,46(3):507-516.
Cao Y,Chang Z Z,Ma Y,et al.Effects of Application of Anaerobically Digested Slurry on Suppression of Pepper(CapsicumfrutescensL.) Blight and Soil Biological Characteristics[J].Scientia Agricultura Sinica,2013,46(3):507-516.
16.曾华兰,叶鹏盛,李琼芳,等.哈茨木霉T23对花生的促生增产作用[J].云南农业大学学报,2005,20(1):145-146.
Zeng H L,Ye P S,Li Q F,et al.Effects ofTrichodermaharzianumT23 on Peanut Yield[J].Journal of Yunnan Agricultural University,2005,20(1):145-146.
17.朱国栋,吕曼曼,杨兴堂,等.木霉Ta650对杨树移栽苗生长及光合特性的影响[J].中国农学通报,2015,31(10):7-12.
Zhu G D,Lv M M,Yang X T,et al.Effects ofTrichodermaasperellum650 on the growth and leaf photosynthetic characteristics of transplanted poplar seedlings(Populusdavidiana×P.albavar.pyramidalis)[J].Chinese Agricultural Science Bulletin,2015,31(10):7-12.
18.姜传英,朱国栋,姚志红,等.3个棘孢木霉菌株对山新杨组培移栽苗生长和光合特性的影响[J].草业科学,2016,33(6):1189-1199.
Jiang C Y,Zhu G D,Yao Z H,et al.Effects of threeTrichodermaasperellumonstrains on the growth and photosynthetic characteristics of tissue-culturedPopulusdavidiana×P.albavar.Pyramidalisseedlings[J].Pratacultural Science,2016,33(6):1189-1199.
19.王学奎.植物生理生化实验原理和技术:第2版[M].北京:高等教育出版社,2006:278-279.
Wang X K.Principles and Techniques of Plant Physiological Biochemical Experiment:2nd[M].Beijing:Higher Education Press,2006:278-279.
20.Farquhar G D,Von Caemmerers S,Berry J A.A biochemical model of photosynthetic CO2assimilation in leaves of C3species[J].Planta,1980,149(1):78-90.
21.张广志,杨合同,周红姿,等.土壤杀菌剂对木霉根际竞争的影响及木霉对玉米生长作用的初步研究[J].农业环境科学学报,2007,26(3):229-231.
Zhang G Z,Yang H T,Zhou H Z,et al.Competitive Effects of Fungicide on Rhizosphere ofTrichodermaspp.in Soil and Maize Growth[J].Journal of Agro-Environment Science,2007,26(3):229-231.
22.Windham M T,Elad Y,Baker R.A mechanism for increased plant growth induced byTrichodermaspp.[J].Phytopathology,1986,76(5):518-521.
23.王艳哲,刘秀位,孙宏勇,等.水氮调控对冬小麦根冠比和水分利用效率的影响研究[J].中国生态农业学报,2013,21(3):282-289.
Wang Y Z,Liu X W,Sun H Y,et al.Effects of water and nitrogen on root/shoot ratio and water use efficiency of winter wheat[J].Chinese Journal of Eco-Agriculture,2013,21(3):282-289.
24.张敏,胡丽,杨春平,等.木霉L24菌株对小麦幼苗生长的影响[J].安徽农业科学,2010,38(4):1765-1766,1785.
Zhang M,Hu L,Yang C P,et al.Effect ofTrichodermaStrain L24 on the Growth of Wheat Seedlings[J].Journal of Anhui Agricultural Sciences,2010,38(4):1765-1766,1785.
25.Jiao L Y,Ding H D,Wang L H,et al.Bisphenol A effects on the chlorophyll contents in soybean at different growth stages[J].Environmental Pollution,2017,223:426-434.
26.曹翠玲,李生秀.供氮水平对小麦生殖生长时期叶片光合速率、NR活性和核酸含量及产量的影响[J].植物学报,2003,20(3):319-324.
Cao C L,Li S X.Effect of Nitrogen Level on the Photosynthetic Rate,NR Activity and the Contents of Nucleic Acid of Wheat Leaf in the Stage of Reproduction[J].Chinese Bulletin of Botany,2003,20(3):319-324.
27.Al-Hashmi,Claereboudt K A,Al-Azri M R,et al.Seasonal Changes of Chlorophyll a and Environmental Characteristics in the Sea of Oman[J].The Open Oceanography Journal,2010,4(1):107-114.
28.Shibghatallah M A H,Khotimah S N,Suhandono S,et al.Measuring leaf chlorophyll concentration from its color:A way in monitoring environment change to plantations[C].//American Institute of Physics,2013:210-213.
29.陆宁海,徐瑞富,房振宏,等.哈茨木霉对小麦和玉米幼苗生长的影响[J].江苏农业学报,2005,21(3):238-240.
Lu N H,Xu R F,Fang Z H,et al.Influence ofT.harzianumon Growth of Wheat and Corn Seedling[J].Jiangsu Journal of Agricultural Sciences,2005,21(3):238-240.
30.陈为京,李润芳,杨焕明,等.黄绿木霉T1010对日光温室番茄功能叶光合色素含量及光系统Ⅱ光化学效率的影响[J].中国农学通报,2010,26(9):178-183.
Chen W J,Li R F,Yang H M,et al.Effect ofTrichodermaaureoviride1010 on Chlorophyll and Carotenoid Content andFv/Fmof Tomato Functional Leaves in Solar-Greenhouse[J].Chinese Agricultural Science Bulletin,2010,26(9):178-183.
31.冯虎元,安黎哲,王勋陵.环境条件对植物稳定碳同位素组成的影响[J].植物学报,2000,17(4):312-318.
Feng H Y,An L Z,Wang X L.A review on effect of environmental factors on stable carbon isotope composition in plants[J].Chinese Bulletin of Botany,2000,17(4):312-318.
32.Collatz G J.Influence of certain environmental factors on photosynthesis and photorespiration inSimmondsiachinensis[J].Planta,1977,134(2):127-132.
33.燕嗣皇,吴石平,陆德清,等.木霉生防菌对根际微生物的影响与互作[J].西南农业学报,2005,18(1):40-46.
Yan S H,Wu S P,Lu D Q,et al.Effects of biocontrol strain ofTrichodermaharzianumon microflora in rhizosphere and its interactions with microbe[J].Southwest China Journal of Agricultural Sciences,2005,18(1):40-46.
The National Natural Science Foundation of China(NSFC:31370642);Heilongjiang Province Post doctorate science foundation(LBH-Q11176)
introduction:LIU Zhao-Ying(1993—),female,master,majoring in garden plant germplasm resources.
date:2017-06-07
EffectsofTrichodermaasperellumCombinedApplicationonGrowthandPhotosynthesisCharacteristicsofPopulusdavidiana×P.albavar.pyramidlis
LIU Zhao-Ying1JIANG Chuan-Ying1ZHAI Tong-Tong1CHANG Yuan1YAO Zhi-Hong1LIU Zhi-Hua2ZHANG Rong-Shu1*
(1.College of Landscape Architecture,Northeast Forestry University,Harbin 150040;2.School of Forestry,Northeast Forestry University,Harbin 150040)
In order to prepare compound fungi fertilizer ofTrichodermaasperellum, we studied the effects ofT.asperellumcombined application on the growth and photosynthetic characteristics ofPopulusdavidiana×P.albavar.pyramidlis(Shanxin poplar) by applying the concentration(5×103cfu·cm-3soil) with different combinations ofT.asperellumconidia T1(Ta536+Ta4), T2(Ta536+Ta4+Ta492) and T3(Ta536+Ta4+Ta492+Ta650) to roots of the tissue-cultured Shanxin poplar seedlings under field conditions. Analysis of variance showed that the induction time and different treatments had significant effects on height, basal stem, chlorophyll content, chlorophyll a/b value,Pn,Cond,CiandTr(P<0.05): the seedling heights, basal stems and dry weights of the treatment groups were higher than those of control group(CK) in different degree, and the effect was T3> T2>T1>CK; the biomass of poplar seedlings of T3, T2 and T1 separately increased 17.99%、14.28% and 10.54% compared with CK at 60 d; at 15 d, chlorophyll contents separately increased 7.79%, 6.91% and 4.17% and chlorophyll a/b values separately increased 7.79%, 5.84% and 4.73% compared with CK. In addition, the net photosynthetic rate(Pn), intercellular CO2concentration(Ci), stomatal conductance(Cond) and transpiration rate(Tr) of the treatment were higher than those of CK, and the maximum net photosynthetic rate, apparent quantum efficiency and light saturation point of the treatment groups were higher than those of CK(P<0.05). At the same time, the interaction between the inducing durations and the different treatments levels ofT.asperellumalso significantly influenced the above indexes(except forPnandCi)(P<0.05). In brief, combination of 4 strains had synergistic effects that can enhance the adaptability of these strains to environment, promote growth and improve photosynthesis characteristics, and the T3 group has the biggest influence and the fastest action on the poplar seedlings.
Populusdavidiana×P.albavar.pyramidlis(Shanxin poplar);Trichodermaasperellum;synergistic effect;growth promotion;photosynthesis
国家自然科学基金资助项目(31370642);黑龙江省博士后科研启动金资助项目(LBH-Q11176)
刘照莹(1993—),女,硕士研究生,主要从事园林植物种质资源研究。
* 通信作者
2017-06-07
* Corresponding author
S792.247
A
10.7525/j.issn.1673-5102.2018.01.008
