交替呼吸途径对CuCl2胁迫下菜豆叶片光系统Ⅱ的保护作用
2018-01-09谢佳佳芦丽娜石岱龙王庆文贾凌云冯汉青
谢佳佳 芦丽娜 石岱龙 王庆文 贾凌云 冯汉青
(西北师范大学生命科学学院,兰州 730070)
交替呼吸途径对CuCl2胁迫下菜豆叶片光系统Ⅱ的保护作用
谢佳佳 芦丽娜 石岱龙 王庆文 贾凌云 冯汉青*
(西北师范大学生命科学学院,兰州 730070)
以“农普”12号菜豆幼苗为材料,采用1 mmol·L-1的水杨基氧肟酸(SHAM)抑制交替呼吸途径活性,探讨了在CuCl2胁迫下交替呼吸途径对菜豆幼苗叶片光系统Ⅱ的保护作用。结果表明,随着CuCl2胁迫浓度的增加,菜豆幼苗叶片潜在最大光化学效率Fv/Fm、光适应下叶片的最大光化学效率Fv′/Fm′、PSⅡ的实际光化学效率Y(Ⅱ)以及光化学猝灭系数qP、叶绿素含量均呈下降趋势,而非光学猝灭系数NPQ和交替呼吸途径的容量水平则呈上升趋势。较之在CuCl2处理下的菜豆幼苗,用交替呼吸途径抑制剂预处理后的菜豆再置于CuCl2的胁迫下,则会导致Fv/Fm、Fv′/Fm′、Y(Ⅱ)、qP以及叶绿素含量的进一步下降和NPQ的进一步上升。上述观察表明,在CuCl2胁迫下交替呼吸途径可以缓解PSⅡ光化学效率的下降、维持PSⅡ反应中心的开放程度、减少天线色素的热耗散以及缓解叶绿素含量的降低,从而保护菜豆叶片光系统Ⅱ免受CuCl2胁迫的伤害。
交替呼吸途径;CuCl2胁迫;菜豆;叶绿素荧光参数
近年来由于重金属污染而引起的环境问题越来越受到人们的重视。土壤中的重金属被植物吸收并大量积累在根、茎、叶等器官中,进而通过生物链进入人体并危及人类健康[1]。铜作为植物生长和代谢的必需微量元素,在植物正常生长发育过程中起着重要的作用[2]。作为叶绿素形成过程中一些酶及蛋白质的结构及催化组分,适量Cu2+可促进叶绿素a和叶绿素b的合成;Cu2+也是叶绿体质体蓝素的构成组分,可参与光合电子传递过程[3~4]。然而过量的Cu2+不仅抑制叶绿素的合成,破坏叶绿体结构;还导致光合电子传递的紊乱,造成PSⅡ对光能利用率的下降和过剩还原力的积累,并影响植物的生长和发育[5~6]。
线粒体是植物绿色细胞中重要的能量代谢中心之一,与叶绿体之间存在着密切的能量交流。其中植物线粒体具有一条对氰化物不敏感的电子传递途径,即抗氰途径或称为交替呼吸途径[7]。大量的研究发现,在逆境胁迫下交替呼吸途径被激活[8],并具有维持线粒体电子传递的顺利进行、加速TCA循环中碳骨以及中间产物的生成、减少活性氧产生等多种生理功能[9~11]。同时,交替呼吸途径在光合和呼吸两大代谢的联系中扮演着重要的角色[7]。在强光等环境下,当叶绿体光化学反应所形成的还原性物质NADPH超过了碳同化的需求时,过多的NADPH以苹果酸的形式通过苹果酸—草酰乙酸穿梭进入线粒体而被交替呼吸途径以热的形式耗散掉[12~14]。因此,交替呼吸途径被认为能够避免叶绿体内NADPH过度积累,从而优化了光合的能量代谢,并防御和减轻了PSⅡ光抑制的发生[15]。
虽然交替呼吸途径缓解强光、干旱等逆境胁迫下PSⅡ光抑制的研究已有一定报道。但是,交替呼吸途径对于重金属Cu2+胁迫下植物光系统Ⅱ是否具有一定的保护作用尚未见报道。基于此,本文以重要的农作物菜豆为实验材料,利用交替氧化酶抑制剂水杨基氧肟酸(salicylhy droxamatesalicyl hydroxamate,SHAM)控制叶片内AOX活性,通过比较不同Cu2+胁迫下菜豆叶片叶绿素荧光参数的变化,以期探明交替呼吸途径对Cu2+胁迫下菜豆叶片光系统Ⅱ的保护作用。
1 材料和方法
1.1 材料
供试菜豆品种为“农普”12号菜豆(PhaseolusvulgarisL. cv Nongpu No.12),购自于广州市农业科学研究院。种子经蒸馏水清洗后用1%的次氯酸钠消毒15~20 min,再用蒸馏水进行充分清洗,然后置于培养箱中催芽2 d。挑选露白一致的种子种植于50 mL小锥形瓶中,加入Hoagland全营养液进行培养,培养温度为25℃/20℃(昼/夜),光照强度为100 μmol·m-2·s-1,光照周期为12 h。
1.2 材料处理
选取生长2周龄、长势一致的菜豆幼苗转移至150 mL的三角瓶中,开展以下实验。实验一:将CuCl2加入到Hoagland全营养液中,共设置0(对照,CK)、600、1 000、2 000、3 000 μmol·L-15个处理浓度,幼苗处理24 h后进行各指标测定。实验二:采用1 mmol·L-1SHAM溶液抑制菜豆叶片交替呼吸途径,溶剂为1%的乙醇,进行以下四种处理,(1)将SHAM喷洒于菜豆叶片表面,保持湿润5 h后,再将植株移至Hoagland全营养液中处理24 h;(2)将1%的乙醇溶液喷洒于菜豆叶片表面,保持湿润5 h后,将植株移至Hoagland全营养液中处理24 h;(3)将SHAM喷洒于菜豆叶片表面,保持湿润5 h后,将植株移至2 000 μmol·L-1的CuCl2溶液中处理24 h;(4)将植株移至2 000 μmol·L-1的CuCl2溶中处理24 h。每组4个平行处理。
1.3 叶绿素含量的检测
叶绿素含量的测定参照Arnon的方法[16],并加以改良。称取菜豆叶片0.08 g,切碎于5 mL离心管中,加入4 mL 80%丙酮提取液,暗处浸提过夜至叶片发白,摇晃均匀后取浸提液,使用分光光度计分别在645和663 nm下测定光吸收值,对照为80%的丙酮。
1.4 叶绿素荧光参数的测定
采用脉冲调制式叶绿素荧光仪(PAM-2500 Waltz,Germany)对各组菜豆幼苗叶片的叶绿素荧光参数进行测定。测定地点在培养室,空气湿度45%,温度23℃。参照Demmig-Adams等[17]的方法,测定前将每组供试材料暗处理25 min,之后将经过暗适应的菜豆幼苗叶片照射测量光,得到初始荧光最小荧光参数Fo;紧接着打开饱和脉冲光,得到暗适应下最大荧光参数Fm。当所测材料在作用光的实时荧光Fs达到稳态后20 s打开饱和脉冲光,测得最大荧光Fm′和稳态荧光产量Ft,关闭光化光,在远红光下,测得最小荧光参数Fo′。
根据上述参数计算出PSⅡ的光适应下最大光化学效率:
Fv′/Fm′=(Fm′-Fo′)/Fm′
(1)
PSⅡ潜在最大光化学效率:
Fv/Fm=(Fm-Fo)/Fm
(2)
PSⅡ的实际光化学效率:
Y(Ⅱ)=(Fm′-Ft)/Fm′
(3)
化学淬灭系数:
qP=(Fm′-Ft)/(Fm′-Fo)
(4)
非光化学猝灭系数:
NPQ=Fm/Fm′-1[18~19]
(5)
1.5 植物交替呼吸途径容量的检测
将处理后的菜豆叶片称重并剪成小块,加入氰化钾,以抑制细胞色素呼吸途径,之后参照Clark氧电极方法进行交替呼吸途径容量的测定[20]。
1.6 数据分析
采用Excel和origin统计软件完成试验原始数据处理和制图,实验数值均用平均值±标准差表示(n=4)。数据采用双总体t检验,检验在P<0.05水平上的差异显著性。
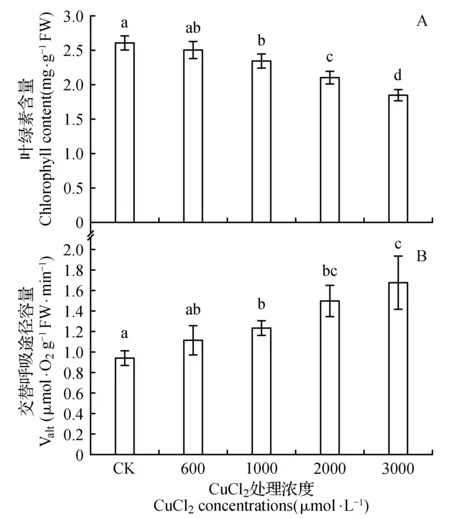
图1 不同浓度氯化铜胁迫对菜豆叶片叶绿素含量(A)及交替呼吸途径容量(B)的影响 不同字母表示在P<0.05水平上差异显著,下同。Fig.1 The level of Chlorophyll content(A) and the capacity of the alternative respiratory pathway(B) under treatment with different CuCl2 concentrations Different letteres denote significant difference(P<0.05),the same as below.
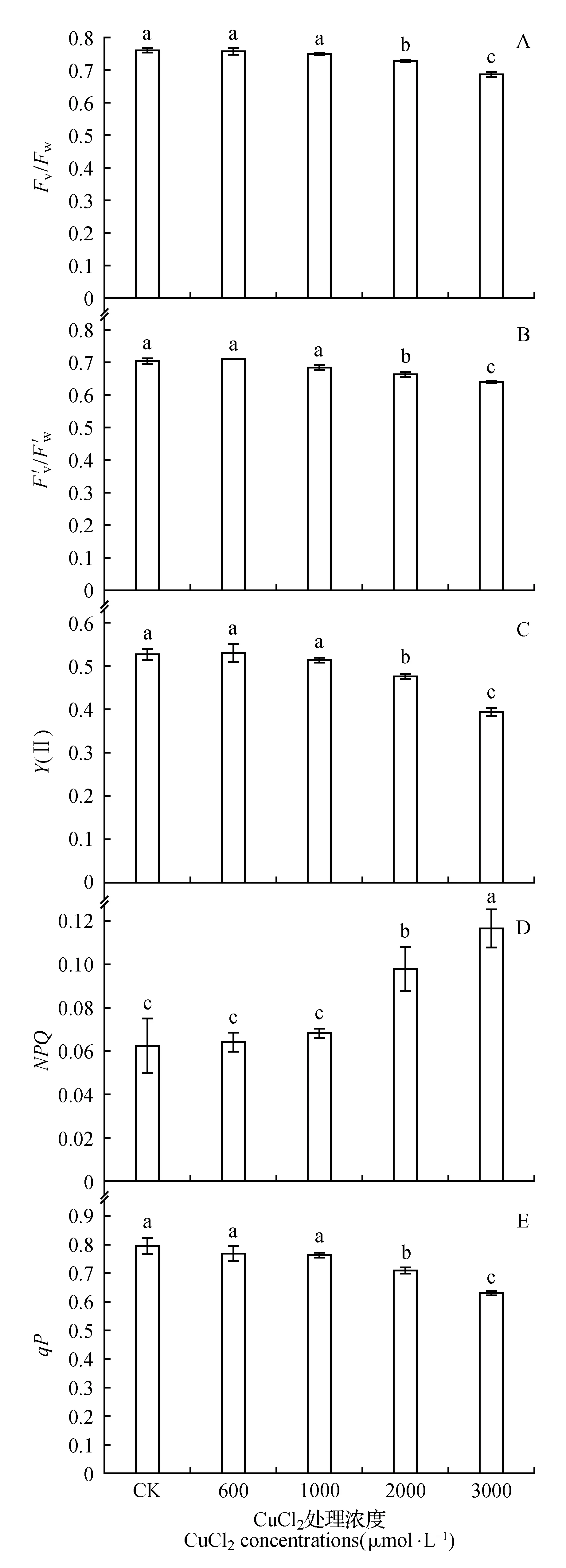
图2 不同浓度氯化铜胁迫对菜豆叶片Fv/Fm(A)、Fv′/Fm′(B)、Y(Ⅱ)(C)、NPQ(D)、qP(E)的影响Fig.2 The effects of CuCl2 stress on Fv/Fm(A),Fv′/Fm′(B),Y(Ⅱ)(C),NPQ(D) and qP(E) on PSⅡ of bean leaves

图3 CuCl2胁迫下SHAM处理对菜豆叶片Fv/Fm(A),Fv′/Fm′(B)、Y(Ⅱ)(C)、NPQ(D)、qP(E)以及菜豆叶片叶绿素含量(F)的影响Fig.3 The effects of SHAM treatment on the levels of Fv/Fm(A),Fv′/Fm′(B),Y(Ⅱ)(C),NPQ(D),qP(E) and Chlorophyll content(F) under CuCl2 stress
2 结果与分析
2.1 CuCl2胁迫下对菜豆叶片叶绿素含量及交替呼吸途径容量的影响
随着CuCl2浓度的增加,叶绿素含量呈下降趋势,叶片交替呼吸途径容量呈上升趋势,但600 μmol·L-1CuCl2处理下,叶绿素含量以及叶片的交替呼吸途径容量与对照相比无显著差异(图1)。
2.2 CuCl2胁迫下对菜豆叶片叶绿素荧光参数的影响
CuCl2处理浓度低于1 000 μmol·L-1时并未引起菜豆叶片Fv/Fm、Fv′/Fm′、Y(Ⅱ)、NPQ和qP的明显变化,仅qP在1 000 μmol·L-1时稍有下降;当CuCl2胁迫浓度高于2 000 μmol·L-1时Fv/Fm、Fv′/Fm′、Y(Ⅱ)和qP均随着处理浓度的增加而下降,而NPQ则随着处理浓度的增加而明显上升(图2)。
2.3 交替呼吸途径对CuCl2胁迫下菜豆叶片叶绿素荧光参数及叶绿素含量的影响
上述结果表明,2 000 μmol·L-1的CuCl2胁迫导致了菜豆叶片光抑制的发生,也诱导了交替呼吸途径容量的显著性提高。因而在此胁迫浓度下,进一步检验交替呼吸途径对Cu2+胁迫下菜豆叶片光系统Ⅱ的保护作用。
如图3所示,与对照相比,对植物叶片施加1 mmol·L-1的SHAM抑制其交替呼吸途径后,并未引起叶片Fv/Fm(A)、Fv′/Fm′(B)、Y(Ⅱ)(C)、NPQ(D)、qP(E)以及叶绿素含量(F)的明显变化;而抑制交替呼吸途径后再经2 000 μmol·L-1CuCl2胁迫后的菜豆叶片,不论是与对照还是与单CuCl2胁迫处理的菜豆相比,其叶绿素荧光参数Fv/Fm(A)、Fv′/Fm′(B)、Y(Ⅱ)(C)、qP(E)以及叶绿素含量(F)的数值均显著降低,但Fv/Fm(A)、Fv′/Fm′(B)的下降程度低于Y(Ⅱ)(C)、qP(E)以及叶绿素含量(F)的下降程度;而NPQ(D)则显著升高。
3 讨论
叶绿素荧光参数作为评估PSⅡ功能的良好指标,可有效反映环境胁迫对植物光合结构的影响[21]。Fv/Fm表征了PSⅡ最大(或潜在)的光化学效率。本实验研究发现,在CuCl2浓度高于2 000 μmol·L-1的胁迫下,Fv/Fm显著降低(图2A),表明高浓度Cu2+胁迫造成了菜豆叶片PSⅡ反应中心的失活或破坏。YⅡ反映了叶片在光下的实际光化学效率,其大小取决于qP和Fv′/Fm′,其中qP是开放的PSⅡ反应中心数量的量度,而Fv′/Fm′是开放的PSⅡ的激发能捕获效率[21]。本实验结果显示,在CuCl2浓度高于2 000 μmol·L-1的胁迫下,Y(Ⅱ)(图2C)显著下降,且伴随着Fv′/Fm′(图2B)和qP(图2E)的显著降低,说明高浓度Cu2+胁迫导致了菜豆叶片PSⅡ反应中心开放比例和激发能捕获效率的下降,从而降低了PSⅡ的运行效率。同时,高浓度Cu2+胁迫导致了NPQ(图2D)的显著升高。由于NPQ反映了PSⅡ天线色素吸收的光能以热的形式耗散掉的部分,NPQ的上升反映了在高浓度Cu2+胁迫下更多的光能无法用于光化学反应,而以热的形式被耗散。前人的研究表明,过量的Cu2+可以导致QB结合蛋白以及PSⅡ氧化侧或PSⅡ还原侧一些电子传递相关蛋白结构的改变,从而导致PSⅡ电子传递的紊乱[22~24]。因此,高浓度Cu2+可能是通过影响PSⅡ中电子传递体的功能而导致了菜豆叶片叶绿素荧光参数的变化。此外,本研究发现,随着Cu2+胁迫浓度的增加,叶绿素含量随之降低(图2F),推测这可能是由于Cu2+会通过取代叶绿体中蛋白质上的Fe2+或Mg2+破坏叶绿体的结构,进而造成叶绿素的降解所致[25]。由于叶绿素的含量也影响着PSⅡ的光能利用率,因此,Cu2+所造成的叶绿素荧光参数的变化应是PSⅡ中电子传递体的功能改变以及叶绿素结构被破坏综合作用的结果。
本研究发现,CuCl2胁迫诱导了交替呼吸途径容量的增加(图1B)。进一步实验发现,尽管在非胁迫条件下利用抑制剂(SHAM)抑制交替呼吸途径并未引起叶绿素荧光参数以及叶绿素含量的显著性变化(图3),但在2 000 μmol·L-1的CuCl2胁迫下,抑制交替呼吸途径会导致叶片Fv/Fm、Fv′/Fm′、Y(Ⅱ)、qP和叶绿素含量水平的进一步下降,以及NPQ水平的进一步上升(图3)。这一观察提示了,在Cu2+胁迫下,交替呼吸途径有助于减缓PSⅡ光化学效率的下降、促进PSⅡ反应中心的开放,减低PSⅡ的光能的耗散,以及减缓叶绿素的降解。因此,本文认为,在Cu2+胁迫下交替呼吸途径具有对PSⅡ的保护作用。
以前的研究发现,在强光照射下,叶绿体光化学反应所产生的部分还原性物质,在通过苹果酸穿梭的形式转移至线粒体后,被交替呼吸途径氧化,从而以热的形式耗散掉[26]。因此,交替呼吸途径被认为能够避免叶绿体中还原性物质过度积累,从而增加了PSⅡ反应中心的开放(氧化性)程度,减轻了强光照射下PSⅡ光抑制的发生[26]。尽管Cu2+胁迫在性质上和强光照射不同,但本文发现Cu2+胁迫也导致了菜豆叶片PSⅡ反应中心开放比例的下降,并继而降低了PSⅡ的运行效率和功能。因此,本文推测,交替呼吸途径有可能通过消耗叶绿体中的部分还原物质而帮助叶片在Cu2+胁迫下维持PSⅡ反应中心开放比例,从而参与了对PSⅡ的保护作用。同时,交替呼吸途径被发现能通过调节碳代谢而促进叶绿素合成的增加[27]。因此,考虑到叶绿素对PSⅡ的影响,交替呼吸途径也可能同时通过调节叶绿素的含量而有助于在Cu2+胁迫下PSⅡ的运行。
综上,本文推测在Cu2+胁迫会通过影响光合电子的传递和叶绿素的合成来抑制菜豆PSⅡ的功能;而CuCl2胁迫下交替呼吸途径的上升对PSⅡ能起到一定的保护作用。
1.Sharma R K,Agrawal M.Biological effects of heavy metals:an overview[J].Journal of Environmental Biology,2005,26(2 Suppl):301-313.
2.Yruela I.Copper in plants[J].Brazilian Journal of Plant Physiology,2005,17(1):145-156.
3.Van Assche F,Clijsters H.Effects of metals on enzyme activity in plants[J].Plant,Cell & Environment,1990,13(3):195-206.
4.Pádua M,Cavaco A M,Aubert S,et al.Effects of copper on the photosynthesis of intact chloroplasts:interaction with manganese[J].Physiologia Plantarum,2010,138(3):301-311.
5.Pilon M,Abdel-ghany S E,Cohu C M,et al.Copper cofactor delivery in plant cells[J].Current Opinion in Plant Biology,2006,9(3):256-263.
6.Hsu B D,Lee J Y.Toxic effects of copper on photosystem Ⅱ of spinach chloroplasts[J].Plant Physiology,1988,87(1):116-119.
7.Millenaar F F,Lambers H.The alternative oxidase:in vivo regulation and function[J].Plant Biology,2003,5(1):2-15.
8.Feng H Q,Sun K,Li M Q,et al.The expression,function and regulation of mitochondrial alternative oxidase under biotic stresses[J].Molecular Plant Pathology,2010,11(3):429-440.
9.Bartoli C G,Gomez F,Gergoff G,et al.Up-regulation of the mitochondrial alternative oxidase pathway enhances photosynthetic electron transport under drought conditions[J].Journal of Experimental Botany,2005,56(415):1269-1276.
10.Dinakar C,Vishwakarma A,Raghavendra A S,et al.Alternative oxidase pathway optimizes photosynthesis during osmotic and temperature stress by regulating cellular ROS,malate valve and antioxidative systems[J].Frontiers in Plant Science,2016,7:68.
11.Smith C A,Melino V J,Sweetman C,et al.Manipulation of alternative oxidase can influence salt tolerance inArabidopsisthaliana[J].Physiologia Plantarum,2009,137(4):459-472.
12.Tcherkez G,Boex-fontvieille E,Mahé M,et al.Respiratory carbon fluxes in leaves[J].Current Opinion in Plant Biology,2012,15(3):308-314.
13.Yoshida K,Terashima I,Noguchi K.Up-regulation of mitochondrial alternative oxidase concomitant with chloroplast over-reduction by excess light[J].Plant & Cell Physiology,2007,48(4):606-614.
14.Noguchi K,Yoshida K.Interaction between photosynthesis and respiration in illuminated leaves[J].Mitochondrion,2008,8(1):87-99.
15.Zhang L T,Gao H Y,Zhang Z S,et al.Multiple effects of inhibition of mitochondrial alternative oxidase pathway on photosynthetic apparatus inRumexK-1 leaves[J].Biologia Plantarum,2012,56(2):365-368.
16.Arnon D I.Copper enzymes in isolated chloroplasts.polyphenoloxidase inBetavulgaris[J].Plant Physiology,1949,24(1):1-15.
17.Demmig-adams B,Adams Ⅲ W W.Xanthophyll cycle and light stress in nature:uniform response to excess direct sunlight among higher plant species[J].Planta,1996,198(3):460-470.
18.Genty B,Briantais J M,Baker N R.The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence[J].Biochimica et Biophysica Acta(BBA) -General Subjects,1989,990(1):87-92.
19.Bilger W,Björkman O.Role of the xanthophyll cycle in photoprotection elucidated by measurements of light-induced absorbance changes,fluorescence and photosynthesis in leaves ofHederacanariensis[J].Photosynthesis Research,1990,25(3):173-185.
20.Bingham I J,Farrar J F.Activity and capacity of respiratory pathways inharley roots deprived of inorganic nutrients[J].Plant Physiology Biochemistry,1989,27(6):847-854.
21.Krause G H,Weis E.Chlorophyll fluorescence and photosynthesis:the basics[J].Annual Review of Plant Physiology and Plant Molecular Biology,1991,42(1):313-349.
22.Mohanty N,Vass I,Demeter S.Copper toxicity affects photosystem Ⅱ electron transport at the secondary quinone acceptor,QB[J].Plant Physiology,1989,90(1):175-179.
23.Bohner H,Böhme H,Böger P.Reciprocal formation of plastocyanin and cytochrome c-553 and the influence of cupric ions on photosynthetic electron transport[J].Biochimica et Biophysica Acta(BBA)-Bioenergetics,1980,592(1):103-112.
24.Samuelsson G,Öquist G.Effects of copper chloride on photosynthetic electron transport and chlorophyll-protein complexes ofSpinaciaoleracea[J].Plant & Cell Physiology,1980,21(3):445-454.
25.Karimi P,Khavarinejad R A,Niknam V,et al.The Effects of Excess Copper on Antioxidative Enzymes,Lipid Peroxidation,Proline,Chlorophyll,and Concentration of Mn,Fe,and Cu inAstragalusneo-mobayenii[J].Scientific World Journal,2012,2012(4):257-274.
26.Zhang L T,Zhang Z S,Gao H Y,et al.The mitochondrial alternative oxidase pathway protects the photosynthetic apparatus against photodamage inRumexK-1 leaves[J].BMC Plant Biology,2012,12(1):40.
27.Zhang D W,Yuan S,Xu F,et al.Light intensity affects chlorophyll synthesis during greening process by metabolite signal from mitochondrial alternative oxidase inArabidopsis[J].Plant Cell & Environment,2016,39(1):12-25.
The National Natural Science Foundation of China(31560070);The Fundamental Research Funds for the Gansu Universities;Gansu Provincial Department of Financeand Gansu University Research Project;Northwest Normal University Innovation Team Project
introduction:XIE Jia-Jia(1993—),female,senior engineer,mainly engaged in plantphysiology research work.
date:2017-04-05
ProtectiveEffectsofAlternativeRespiratoryPathwayonPhotosystemⅡinPhaseolusvulgarisunderCuCl2Stress
XIE Jia-Jia LU Li-Na SHI Dai-Long WANG Qing-Wen JIA Ling-Yun FENG Han-Qing*
(College of Life Science,Northwest Normal University,Lanzhou 730070)
With “Nongpu” No.12 bean seedling leaves(PhaseolusvulgarisL.), we used the AOX inhibitor salicylhydroxamic acid(1 mmol·L-1; SHAM) to inhibit AOX activity in vivo, and studied the protective effects of alternative respiratory pathway on the photosystem Ⅱ under the CuCl2stress. The treatment with CuCl2caused a significant decrease in the ratio ofFv/Fm(the potential maximal photochemical efficiency of PSⅡ),Fv′/Fm′(the maximum quantum efficiency of PSⅡ photochemistry at illumination),Y(Ⅱ)(effective photochemical quantum yield of PSⅡ photosynthetic),qP(photochemical quenching coefficient), and the chlorophyll content, but the levels ofNPQ(non-photochemical quenching) and the capacity of the alternative respiratory pathway were significantly increased. Compared with the bean seedling under CuCl2stress, the CuCl2-stressed bean seedling pretreated with inhibitor of alternative respiratory(salicylhydroxamic acid) had lower levels ofFv/Fm,Fv′/Fm′,Y(Ⅱ),qPand chlorophyll content, and higher levels ofNPQ. These observations suggest that under the CuCl2stress, the alternative respiratory pathway can protect the photosystem Ⅱ of the bean leaves from CuCl2stress by alleviating the decrease of the photochemical efficiency of PSⅡ, maintaining the proportion of open PSⅡ centres, reducing the heat dissipation of the antenna pigment and chlorophyll content disruption.
alternative respiratory pathway;CuCl2stress;PhaseolusvulgarisL.;chlorophyll fluorescence
国家自然科学基金(31560070);甘肃省高等学校科研业务费;甘肃省高等学校科研项目;西北师范大学创新团队项目
谢佳佳(1993—),女,硕士研究生,主要从事植物生理生态方面研究工作。
* 通信作者:E-mail:fenghanq@nwnu.edu.cn
2017-04-05
* Corresponding author:E-mail:fenghanq@nwnu.edu.cn
Q945.79
A
10.7525/j.issn.1673-5102.2018.01.009
