1-脱氧野尻霉素对肥胖小鼠脂代谢的影响及机理
2018-01-08曾艺涛黄先智丁晓雯
王 玲,曾艺涛,黄先智,丁晓雯,*
(1.西南大学食品科学学院,重庆 400716;2.家蚕基因组生物学国家重点实验室,重庆 400716)
1-脱氧野尻霉素对肥胖小鼠脂代谢的影响及机理
王 玲1,曾艺涛1,黄先智2,丁晓雯1,*
(1.西南大学食品科学学院,重庆 400716;2.家蚕基因组生物学国家重点实验室,重庆 400716)
探究1-脱氧野尻霉素(1-deoxynojirimycin,DNJ)对营养性肥胖的脂代谢调控作用及其途径,旨在为开发DNJ降糖、降脂减肥产品提供依据。通过饲喂高脂饲料建立肥胖小鼠模型,之后喂食普通饲料40 d,同时实验组灌胃不同剂量(8.0、4.0、2.0 mg/(kg·d),以体质量计)DNJ,用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)法测定小鼠的血脂水平、脂肪细胞因子、脂肪酸合成及氧化过程中相关酶活力。结果显示,与阴性对照组比较,在8.0 mg/(kg·d)剂量组中DNJ可使雌、雄鼠体质量分别下降9.06%、14.07%,肝脂含量分别下降4.13%、27.82%,腹腔脂肪系数分别下降9.00%、34.30%,血清总胆固醇含量分别下降11.57%、35.13%,总甘油三酯含量分别下降46.89%、30.65%,高密度脂蛋白含量分别增加28.86%、7.00%,游离脂肪酸含量分别下降10.60%、10.20%,内脂素含量分别下降38.44%、26.76%,脂联素含量分别上升29.66%、26.96%,肝脏中乙酰辅酶A羧化酶活力分别下降17.03%、15.52%,脂肪酸合成酶活力分别下降23.53%、21.13%,肉毒碱脂酰转移酶Ⅰ活力分别上升20.38%、17.20%,酰基辅酶A氧化酶活力分别上升11.00%、16.29%。上述结果表明,肥胖小鼠在控制饮食的同时摄入适量DNJ可以有效控制脂肪的合成、促进脂肪的氧化分解,达到调控血脂、减少脂肪积累、控制体质量的目的。DNJ对雌、雄鼠脂代谢调控的作用途径不同,其对雄鼠的降脂效果更显著。
1-脱氧野尻霉素;血脂;脂肪因子;酶活力
肥胖是一种由多种因素引起的慢性代谢疾病,其中多发生的是营养性肥胖,即能量摄入过多造成的脂肪堆积异常。肥胖与糖、脂代谢异常互为作用,易导致机体功能发生紊乱,引发糖尿病、高脂血症、动脉粥样硬化、心脑血管疾病等[1-2]。现今针对肥胖的常用治疗方法除控制饮食、加强运动外,还有用西布曲明、奥利司他等药品的药物治疗法[3]。药物疗法虽然效果显著,但周期较长,且副作用较大。因此,研发毒副作用低的天然减肥产品成为相关学科关注的热点。
1-脱氧野尻霉素(1-deoxynojirimycin,DNJ)是一种哌啶类多羟基生物碱[4],在桑树中有着较高的含量,已有3 种人工合成途径可用于生产[5-6]。由于其特殊的结构以及丰富的来源,受到国内外学者的广泛关注。大量研究证明,DNJ作为一种糖苷酶抑制剂,对糖尿病的治疗具有显著效果[7-10]。但是,针对其在降脂减肥方面的研究则比较有限,且不够深入。有研究显示,DNJ可以调控机体血脂水平,缓解高脂血症,抑制脂肪堆积,控制体质量增加[11-12],但对其作用机制未有完整阐述。本研究以高脂饲料诱导的肥胖小鼠为研究对象,建立营养性肥胖小鼠模型,探索在减少能量摄入的同时辅以DNJ摄入,观察DNJ对肥胖的影响以及其作用途径,期望为开发DNJ降脂减肥产品提供依据。
1 材料与方法
1.1 材料与试剂
100 只4 周龄清洁级昆明小鼠(雌雄各半,体质量(20±2) g)(许可证号:SCXK(渝)2007-006)、基础饲料,由重庆腾鑫比尔实验动物销售有限公司提供。
高脂饲料配方按胆固醇2%、猪油10%、白糖10%、基础饲料78%的比例[3]由本课题组自行配制。
DNJ(纯度≥98%) 北京德威钠生物技术有限公司;总甘油三酯(total triglyceride,TG)测定试剂盒、总胆固醇(total cholesterol,TC)测定试剂盒、高密度脂蛋白(high-density lipoprotein,HDL)测定试剂盒、低密度脂蛋白(low-density lipoprotein,LDL)测定试剂盒四川迈克生物技术股份有限公司;游离脂肪酸(free fatty acid,FFA)、脂联素(adiponectin,ADP)、内脂素、脂肪酸合成酶(factty acid synthetasein,FAS)、乙酰辅酶A羧化酶(acetyl CoA carboxylasec,ACC)、酰基辅酶A氧化酶(acyl-CoA oxidase,ACO)、肉毒碱脂酰转移酶Ⅰ(carnitine palmitoyl transferase-1,CPTⅠ)酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒 厦门慧嘉生物科技有限公司。
1.2 仪器与设备
7020型全自动生化分析仪 日本日立公司;F6/10匀浆机 上海弗鲁克流体机械制造有限公司;M680型酶标仪 美国伯乐公司;H2500R-2型冷冻离心机湘仪离心机仪器有限公司。
1.3 方法
1.3.1 DNJ溶液配制
用0.9 g/100 mL的NaCl溶液配制质量浓度分别为0.2、0.4、0.8 mg/mL的DNJ溶液,4 ℃保存备用。
1.3.2 肥胖小鼠模型建立
[11,13]的方法,100 只4 周龄小鼠适应性喂养5 d后,随机挑选10 只作为阴性对照组,用基础饲料饲喂4 周,另外90 只作为实验组,用高脂饲料饲喂4 周,根据式(1)计算肥胖度。
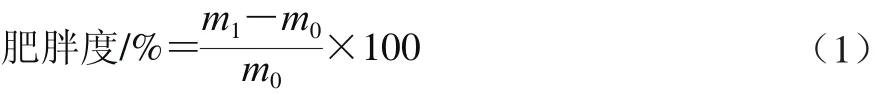
式中:m1为实验组实际体质量/g;m0为阴性对照组平均体质量/g。
随机挑选80 只肥胖度大于20%的小鼠用做后续实验,将其分为4 组(每组20 只,雌雄各半):阴性对照组,DNJ高、中、低剂量组。各组小鼠按每只5 g/d的饲喂量持续用基础饲料喂养40 d,同时阴性对照组以0.5 mL/d灌胃生理盐水,高、中、低剂量组分别以8.0、4.0、2.0 mg/(kg·d)灌胃DNJ。实验期间小鼠自由饮水,5 d称1 次体质量,一周换2 次垫料,室温(22±2)℃,12 h轮换照明。
1.3.3 样品采集及指标测定
灌胃结束后,小鼠禁食不禁水12 h,称体质量,眼球取血,解剖,摘取腹腔脂肪组织和肝脏,参考文献[11]处理后称质量。按照式(2)~(4)计算相关指标[14]。

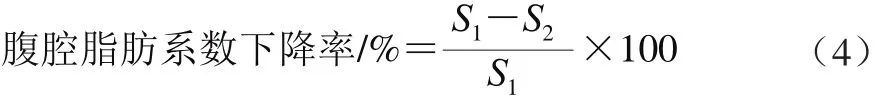
式中:m1为小鼠初始体质量/g;m2为小鼠终体质量/g;m3为小鼠腹腔脂肪质量/g;S1为阴性对照组小鼠腹腔脂肪系数/%;S2为DNJ剂量组小鼠腹腔脂肪系数/%。
参考文献[15]的血样处理方法,釆用全自动生化分析仪测定血脂水平;用ELISA试剂盒测定血清FFA、ADP、内脂素含量。以1∶7(m/V)的比例向肝脏中加入磷酸盐缓冲液(pH 7.4)进行匀浆,3 000 r/min离心20 min,取上清液按照试剂盒说明书的方法测定FAS、ACC、ACO、CPTⅠ活力。
烘至恒质量的滤纸冷却后称其质量(m/g);称取充分研磨的肝脏样品质量(m1/g);滤纸包裹样品后放入带盖玻璃瓶中,加入10 mL石油醚,密封,100 W、55 ℃超声2 次,每次40 min,取出纸包于105 ℃烘干至恒质量,冷却后称其质量(m2/g)。按式(5)计算肝脏脂肪含量。
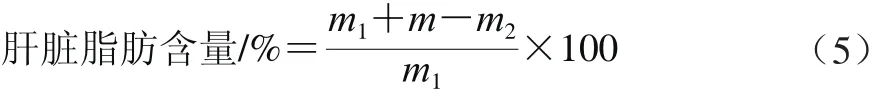
1.4 数据统计分析
采用SPSS 13.0软件对实验数据进行统计分析及显著性检验;P<0.05为差异显著,P<0.01为差异极显著。数据结果用±s表示。
2 结果与分析
2.1 DNJ对肥胖小鼠体质量的影响
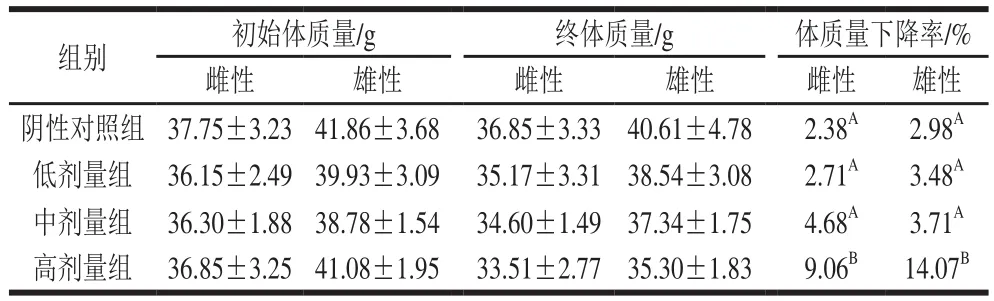
表1 DNJ对肥胖小鼠体质量的影响(n=10)Table 1 Effect of DNJ on body weight of obese mice (n= 10)
肥胖的一个重要表现为体质量的过度增加,有效控制体质量增加就意味着控制肥胖,抑制肥胖可能导致的冠心病、脂肪肝、糖尿病、高血压等各种疾病的发生率[1-2]。由表1可知,灌胃DNJ 40 d后,各剂量组的雌、雄鼠体质量下降率均高于各自的阴性对照组,但中、低剂量组差异均不显著(P>0.05),高剂量组均为极显著(P<0.01)。可见控制饮食的同时长期灌胃适量DNJ可以有效控制体质量增加、抑制肥胖。
2.2 DNJ对肥胖小鼠肝脏脂肪含量的影响
肝脏脂肪含量过高可能会形成脂肪肝,导致肝硬化、肝纤维化的发生,严重损害机体健康[16]。DNJ对肥胖小鼠肝脏脂肪含量的影响如表2所示。灌胃DNJ 40 d后,与阴性对照组相比,各剂量组雌鼠的肝脏脂肪含量的下降不具有显著性(P>0.05);而各剂量组雄鼠的肝脏脂肪含量均呈极显著下降趋势(P<0.01),且表现出明显的剂量-效应关系。可见,对于控制饮食的肥胖雄鼠,灌胃实验剂量的DNJ能减少肝脏脂肪的积累,降低脂肪肝的发生。
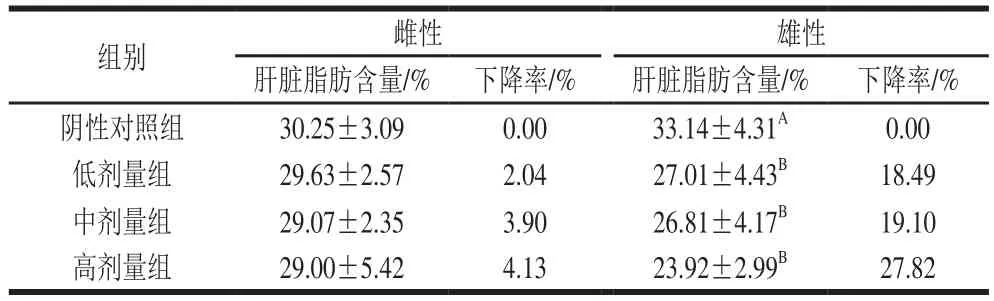
表2 DNJ对肥胖小鼠肝脏脂肪含量的影响Table 2 Effect of DNJ on liver fat content in obese mice
2.3 DNJ对肥胖小鼠腹腔脂肪系数的影响
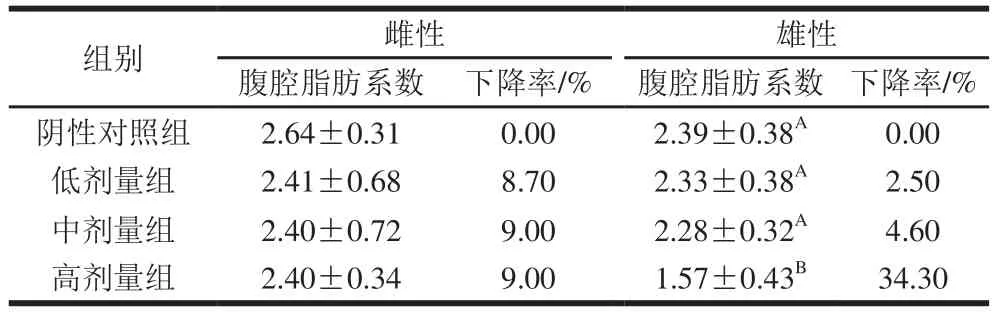
表3 DNJ对肥胖小鼠腹腔脂肪系数的影响Table 3 Effect of DNJ on intra-abdominal fat to body weight in obese mice
长期高脂饮食所导致的营养性肥胖通常为腹型肥胖,其典型特征是腹腔中脂肪堆积过多[17]。DNJ对肥胖小鼠腹腔脂肪系数的影响从表3可以看出,在灌胃DNJ 40 d后,与阴性对照组相比,低、中、高剂量DNJ对雌鼠腹腔脂肪系数的降低不显著(P>0.05);但高剂量DNJ可以极显著地降低雄鼠的腹腔脂肪系数(P<0.01)。说明对于控制饮食的肥胖雄鼠,灌胃适量DNJ能有效抑制腹部脂肪的形成。
有研究表明,当机体脂肪含量过多时,脂肪组织可能会加速TG的分解,其分解代谢产物经循环到达肝脏后又重新合成TG,造成肝脏中脂肪合成速率大于脂肪输出及代谢的速率,从而形成脂肪肝[16,18]。可见腹腔脂肪组织的形成与肝脏脂肪含量之间存在一定关系,DNJ可抑制雄鼠腹腔脂肪的形成与上述DNJ可抑制雄鼠脂肪肝形成的结论是一致的。
2.4 DNJ对肥胖小鼠血脂水平的影响
肥胖与脂代谢紊乱互为作用,其严重后果表现为血液中的脂蛋白含量发生异常,即TC、TG、LDL中一种或几种含量过高,HDL含量过低。任何一种脂蛋白水平的异常都会导致动脉粥样硬化的发生[19-21]。DNJ对肥胖小鼠血脂水平的影响由表4可知,灌胃DNJ 40 d后,与阴性对照组比较,高剂量组雌鼠血清TC含量下降11.57%(P<0.05),低、中、高剂量组雄鼠TC分别下降25.38%、28.20%、35.13%(P<0.01);低、中、高剂量的DNJ分别使雌鼠血清TG含量下降25.42%、42.37%、46.89%(P<0.01),雄鼠TG含量下降27.00%、28.46%、30.65%(P<0.01);各剂量组雌、雄鼠血清LDL含量均无显著变化(P>0.05);低、中、高剂量的DNJ使雌鼠血清HDL含量分别上升21.65%、23.71%、28.86%(P<0.01),但对雄鼠HDL含量无显著影响(P>0.05)。
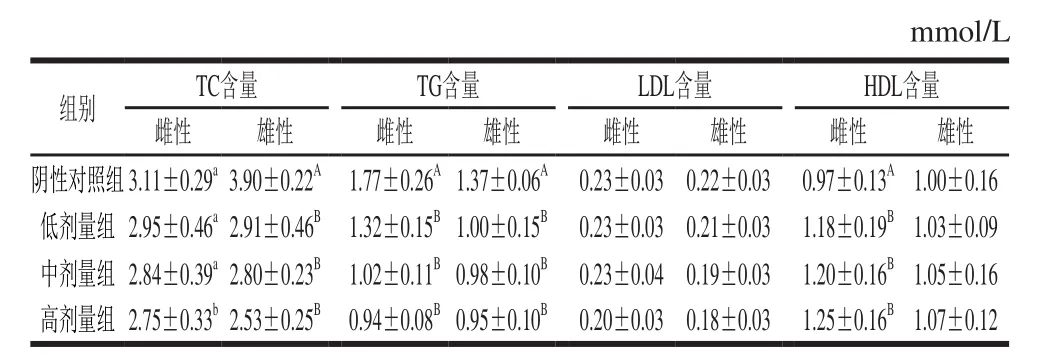
表4 DNJ对肥胖小鼠血脂水平的影响Table 4 Effect of DNJ on blood lipid levels in obese mice
由上述结果可知,对于控制饮食的肥胖鼠,DNJ可以调控血脂水平,可能的作用机制一方面是DNJ通过抑制脂肪组织的合成、降低脂肪细胞的脂解作用,使进入肝脏中的分解代谢产物减少,肝脏合成内源性TG减少,使得血液中的TG水平降低;另一方面DNJ可以通过增加血液中HDL含量来加速TC向肝脏的运输,从而加快TC向胆汁酸的转化,降低血液中TC含量。
2.5 DNJ对肥胖小鼠血清中FFA、内脂素、ADP含量的影响
肥胖机体中形成的脂肪组织在储存能量的同时,其脂解作用也有所增加,导致血清中FFA含量增加。过多FFA不仅使肝脏合成TG的原料增多,造成脂肪肝,还会对细胞产生毒性作用[22-23]。脂肪组织在进行脂代谢的同时,还是一个重要的内分泌器官,如内脂素、ADP、瘦素等脂肪细胞因子也参与脂肪细胞形成及其他脂代谢过程[17]。DNJ对肥胖小鼠血清中FFA、内脂素、ADP含量的影响如表5所示。

表5 DNJ对肥胖小鼠血清中FFA、内脂素、ADP水平的影响Table 5 Effect of DNJ on FFA, visfatin and adiponectin levels in obese mice
从表5可以看出,灌胃DNJ 40 d后,高剂量DNJ分别使肥胖雌、雄鼠血清FFA浓度下降10.60%、10.20%(P<0.05),可见对于控制饮食的肥胖鼠,一定剂量DNJ可通过控制脂肪组织的形成来降低FFA含量,减少肝内脂肪的合成,同时降低对肝细胞的损伤及毒性。研究显示,内脂素在促进前脂肪细胞的分化和以葡萄糖及脂肪酸为原料合成TG方面具有重要作用;机体的肥胖度增加,则内脂素含量也增加[24-25]。高剂量组雌鼠的血清内脂素含量下降38.44%(P<0.05),低、中、高剂量组雄鼠内脂素含量分别下降16.81%、22.39%、26.76%(P<0.01)。说明对于控制饮食的肥胖鼠,适量DNJ可以降低内脂素的分泌来减少TG的合成,抑制过多脂肪的形成。这与上述适量DNJ可以降低血清TG含量、控制体重增加的结果一致。ADP含量通常和TG、LDL含量呈负相关,与HDL含量呈正相关,且能促进脂肪的氧化[26]。由表5可知,中、高剂量组雌鼠血清ADP含量分别上升22.12%、29.66%(P<0.05),高剂量组雄鼠ADP含量极显著上升26.96%(P<0.01)。说明对于控制饮食的肥胖鼠,适量DNJ可以降低血清TC、TG水平及腹脂系数可能是通过增加ADP含量,以促进脂肪的分解消耗起作用的。
2.6 DNJ对肥胖小鼠肝脏中ACC、FAS活力的影响
葡萄糖经糖酵解后形成的丙酮酸在线粒体中经氧化脱羧反应后生成乙酰辅酶A,转运出线粒体的乙酰辅酶A在ACC作用下形成丙二酸单酰辅酶A,再经FAS酶系的一系列催化作用生成长链脂肪酸[15]。可见FAS和ACC在脂肪的合成途径中发挥着重要作用,可以说它们是脂肪合成的限速酶。DNJ对肥胖小鼠肝脏中ACC、FAS活力的影响见表6。

表6 DNJ对肥胖小鼠肝脏中ACC、FAS活力的影响Table 6 Effect of DNJ on acetyl CoA carboxylasec and factty acid synthetase activities in the liver of obese mice
从表6可以看出,灌胃DNJ 40 d后,与阴性对照组相比,中、高剂量组DNJ的雌鼠肝脏中ACC活力分别下降16.15%(P<0.05)、17.03%(P<0.01),高剂量组雄鼠ACC活力下降15.52%(P<0.05);中、高剂量组雌鼠肝脏中FAS活力分别下降19.76%、23.53%(P<0.01),雄鼠FAS活力分别下降16.35%(P<0.05)、21.13%(P<0.01)。这一结果表明,对于控制饮食的肥胖鼠,一定剂量DNJ能够通过抑制脂肪酸合成途径中关键酶的活性来减缓脂肪酸的合成,从而抑制TG的形成。另外有文献表明,ADP可以使单磷酸腺苷蛋白激酶(adenosine 5’-monophosphate activated protein kinase,AMPK)磷酸化,后者会导致ACC活力下降[27]。实验结果显示,DNJ可使ADP含量增加,这可能是ACC活力下降的一个重要原因。
2.7 DNJ对肥胖小鼠肝脏中CPTⅠ、ACO活力的影响
脂肪进行氧化产能的主要方式是β氧化,该反应是在线粒体基质中进行的。长链脂肪酸需与极性肉碱分子结合后,在CPTⅠ作用下转移至线粒体内,与肉碱分离后在ACO作用下进行氧化分解,产生能量以供机体需要[15]。CPTⅠ和ACO作为脂肪酸氧化过程中的关键酶,其活性高低直接影响着机体的脂代谢状况。DNJ对肥胖小鼠肝脏中CPTⅠ、ACO活力的影响见表7。

表7 DNJ对肥胖小鼠肝脏中CPTⅠ、ACO活力的影响Table 7 Effect of DNJ on carnitine palmitoyl transferase-1 and acyl-CoA oxidase in obesity mice
从表7可以看出,灌胃DNJ 40 d后,与阴性对照组比较,中、高剂量DNJ使雌、雄鼠肝脏中CPTⅠ活力分别增加13.11%(P<0.05)、20.38%(P<0.01)和10.75%(P<0.05)、17.20%(P<0.01);高剂量DNJ使雌、雄鼠肝脏中ACO活力分别增加11.00%(P<0.05)、16.29%(P<0.01)。可见,对于控制饮食的肥胖鼠,适量DNJ可以通过提高脂肪酸氧化酶的活性来加速脂肪的分解代谢,促进脂肪消耗,达到控制肥胖的目的。
3 讨 论
DNJ作为一种特殊生物碱在桑树中有着较高的含量,国内外学者在研究其降糖作用时发现其同样具有降脂作用。Tsuduki等[28]用5 mg/(kg·d)剂量的DNJ灌胃高脂饮食的小鼠12 周后,发现小鼠的肝脏脂肪含量及腹腔脂肪含量均表现为显著下降。本实验结果同样显示,8.0 mg/(kg·d)剂量的DNJ可使肥胖雄鼠的腹腔脂肪系数和肝脏脂肪含量极显著下降(P<0.01),表明DNJ可抑制白色脂肪组织的形成,减少肝脏中脂肪蓄积,具有抗脂肪肝作用。其研究结果还显示,DNJ剂量组小鼠的体质量变化与对照组相比并无显著性差异,而本实验结果显示,8.0 mg/(kg·d)剂量DNJ可使肥胖鼠的体质量明显下降(P<0.01),这可能是由灌胃时间和灌胃剂量的差异引起的。
血脂水平是机体脂代谢状况的直观反映,促使其含量处于正常范围是保障脂代谢过程稳定和机体健康的重要举措。本实验研究结果显示,高剂量DNJ可以调控肥胖小鼠的血脂水平,使雌、雄鼠TC、TG含量均显著下降(P<0.05,P<0.01),雌鼠HDL含量极显著增加(P<0.01);这与高岭等[29]发现桑叶可使患有高脂血症大鼠的HDL-胆固醇含量显著上升,TC、TG、LDL-胆固醇含量显著下降的结论基本一致。说明DNJ作为桑叶中的一种特殊成分,在调控脂代谢、控制血脂水平方面具有重要作用。但在LDL含量变化方面的结论不一致,考虑这可能是由于桑叶中含有多种成分及各成分之间的协同作用等原因引起的。因此,寻找多种具有降脂减肥作用的功能物质,探究多个组分之间的有效组合也是开发相关产品的一个研究方向。
ADP主要由脂肪组织合成、释放,在改善机体的脂代谢和碳水化合物代谢方面发挥重要作用[30]。Lee等[31]发现,3T3-L1脂肪细胞在DNJ作用下分泌的ADP增加,同时测定其mRNA的表达量也增加,这与本实验的研究结果一致。ADP可以增加胰岛素敏感性,降低血糖和FFA含量,加速肝脏和肌肉的脂肪酸氧化[30]。本实验结果表明,高剂量DNJ使肥胖小鼠的血清FFA含量呈显著性下降(P<0.05),同时肝脏中CPTⅠ、ACO活力显著上升(P<0.05,P<0.01),说明DNJ是通过刺激脂肪组织分泌更多的ADP来促使脂肪酸氧化酶的活性升高,从而加速脂肪酸的分解产能,减少血液中FFA含量。Hyun等[32]研究结果显示,DNJ处理组小鼠肝脏中ACC、FAS的mRNA表达量显著低于高脂组,本实验结果同样显示,高剂量DNJ使肥胖小鼠肝脏中ACC、FAS活力显著下降(P<0.05,P<0.01)。同时有研究表明[27],ADP通过使AMPK磷酸化导致ACC活性下降,表明DNJ可以抑制脂肪酸合成酶的活性,这种抑制作用与刺激ADP的分泌之间有着较大关系。
综合上述分析可见,DNJ对控制饮食的肥胖鼠具有一定的减肥作用。它的主要作用途径是通过调节脂肪细胞因子的分泌来控制脂肪酸代谢过程中的相关酶活性,抑制脂肪合成、加速脂肪氧化,达到调控血脂、减少脂肪积累、控制体质量的目的。由于作用方式具有性别差异,导致DNJ对雄鼠的降脂效果更显著。DNJ在控制肥胖方面的显著作用使研发相关降脂减肥产品成为现今科研领域的一个热点。但就本项研究而言,未能深入到基因水平不能从根本上阐述其减肥机制;且对于其他脂代谢相关酶及作用因子的影响也未涉及,这都是之后需要进一步探究的内容。
参考文献:
[1] LABIB M. The investigation and management of obesity[J]. American Journal of Clinical Pathology, 2003, 56(1): 17-25. DOI:10.1136/jcp.56.1.17.
[2] 孙志娟, 黄之瑜. 肥胖的研究进展[J]. 生理科学进展, 2001, 32(1):39-44. DOI:10.3321/j.issn:0559-7765.2001.01.009.
[3] 刘英华. 中链脂肪酸对肥胖小鼠脂代谢的调节作用及机制研究[D].北京: 中国人民解放军军事医学科学院, 2012: 12.
[4] 曾艺涛, 秦樱瑞, 杨娟, 等. DNJ对糖脂代谢机理的影响研究进展[J].食品工业科技, 2013, 34(22): 381-384.
[5] 周晓玲, 孙凌云, 张进, 等. 1-脱氧野尻霉素的来源及合成研究进展[J].蚕业科学, 2011, 37(1): 105-111. DOI:10.3969/j.issn.0257-4799.2011.01.018.[6] 梁明, 王鹏, 张会慧, 等. 1-脱氧野尻霉素的研究进展[J]. 安徽农业科学, 2012, 40(17): 9222-9223. DOI:10.3969/j.issn.0517-6611.2012.17.013.
[7] YATSUNAMI K, LCHIDA M, ONODERA S. The relationship between 1-deoxynojirimycin content and α-glucosidase inhibitory activity in leaves of 276 mulberry cultivars (Morus spp.) in Kyoto,Japan[J]. Journal of Natural Medicines, 2008, 62(1): 63-66.DOI:10.1007/s11418-007-0185-0.
[8] YATSUNAMI K, MURATA K, KAMEI T. 1-Deoxynojirimycin content and alfa-glucosidase inhibitory activity and heat stability of 1-deoxynojirimycin in silkworm powder[J]. Food and Nutrition Sciences, 2011, 2(2): 87-89.
[9] 李有贵, 储一宁, 钟石, 等. 59 份野生桑桑叶中的DNJ含量及粗提物对α-糖苷酶的抑制活性[J]. 蚕业科学, 2010, 36(5): 729-737.
[10] 李有贵, 钟石, 吕志强, 等. 桑叶1-脱氧野尻霉素(DNJ)对α-糖苷酶的抑制动力学研究[J]. 蚕业科学, 2010, 36(5): 885-888.
[11] TSUDUKI T, NAKAMURA Y, HONMA T, et al. Intake of 1-deoxynojirimycin suppresses lipid accumulation through activation of the β-oxidation system in rat liver[J]. Journal of Agricultural and Food Chemistry, 2009, 57(22): 11024-11029. DOI:10.1021/jf903132r.
[12] 仝义超. 桑叶降血糖降血脂研究及其产品开发[D]. 杭州: 浙江工商大学, 2010: 57-59.
[13] 戴宇飞, 龚凤英, 朱惠娟, 等. 西布曲明对肥胖小鼠葡萄糖代谢的影响[J]. 中国卫生检验杂志, 2012, 22(5): 1023-1027; 1030.
[14] 董婧. 肉碱对鲤鱼幼鱼脂肪酸代谢调控作用的研究[D]. 长春: 吉林农业大学, 2014: 27.
[15] 杨丽聪. 咖啡碱和儿茶素组合对小鼠脂肪代谢的影响[D]. 南昌: 江西农业大学, 2011: 11.
[16] 钟文. 蛇床子素调节脂肪肝大鼠脂肪组织和培养细胞内脂肪酸代谢的机制研究[D]. 苏州: 苏州大学, 2012: 1-2.
[17] 孙博喻, 张冰, 林志健, 等. 腹型肥胖的研究进展[J]. 中华中医药学刊, 2015, 33(1): 80-83.
[18] 胡爱儒. 生物化学[M]. 5版. 北京: 人民卫生出版社, 2000: 111-112.
[19] LAVIE C J, MCAULEY P A, CHURCH T S. Obesity and cardiovascular diseases[J]. Journal of the American College of Cardiology, 2014, 63(14):1345-1354. DOI:10.1016/j.jacc.2014.01.022.
[20] ATKINSON R L. Current status of the fi eld of obesity[J]. Trends in Endocrinology & Metabolism, 2014, 25(6): 283-284. DOI:10.1016/j.tem.2014.03.003.
[21] PRICE S A, GORELIK A, FOURLANOS S, et al. Obesity is associated with retinopathy and macrovascular disease in type 1 diabetes[J]. Obesity Research & Clinical Practice, 2014, 8(2): 178-182. DOI:10.1016/j.orcp.2013.03.007.
[22] PICKERSGILL L, LITHERLAND G J, GREENBERG A S, et al. Key role for ceramides in mediating insulin resistance in human muscle cells[J]. Journal of Biological Chemistry, 2007, 282(17): 12583-12589.DOI:10.1074/jbc.M611157200.
[23] NAWARATNE R, GRAY A, JØRGENSEN C H, et al. Regulation of insulin receptor substrate 1 pleckstrin homology domain by protein kinase C: role of serine 24 phosphorylation[J]. Molecular Endocrinology, 2006, 20(8): 1838-1852. DOI:10.1210/me.2005-0536.
[24] 王欣, 刘芳, 陆俊茜, 等. 血清脂联素、内脂素水平与代谢综合征的相关性[J]. 上海医学, 2008, 31(1): 30-33.
[25] 杨箐岩, 陈瑞芳, 刘戈力, 等. 单纯性肥胖儿童血浆内脂素水平与相关因素分析[J]. 中国实用儿科杂志, 2008, 23(3): 187-189.DOI:10.3969/j.issn.1005-2224.2008.03.011.
[26] 王遂军, 贾伟平, 包玉倩, 等. 血清脂联素与肥胖的关系[J].中华内分泌代谢杂志, 2005, 21(1): 36-38. DOI:10.3760/j.issn:1000-6699.2005.01.012.
[27] 童玉, 黄丹珊, BRYER-ASH M. 球形脂联素、葡萄糖和游离脂肪酸对胰岛β细胞单磷酸腺苷激活的蛋白激酶和乙酰辅酶A羧化酶磷酸化的影响[J]. 北京大学学报(医学版), 2006, 38(6): 609-613.DOI:10.3321/j.issn:1671-167X.2006.06.010.
[28] TSUYOSHI T, IKUKO K, TOSHIYUKI K, et al. Intake of mulberry 1-deoxynojirimycin prevents diet-induced obesity through increases in adiponectin in mice[J]. Food Chemistry, 2013, 139(1/2/3/4): 16-23.
[29] 高岭, 凌学静, 刘俊权. 桑叶茶对高脂血症大鼠脂代谢的影响及其抗氧化作用[J]. 宁夏医学院学报, 2000, 22(2): 93-94. DOI:10.3969/j.issn.1674-6309.2000.02.006.
[30] YAMAUCHI T, KAMON J, WAKI H, et al. The fat-derived hormone adiponectin reverses insulin resistance associated with both lipoatrophy and obesity[J]. Nature Medicine, 2001, 7(8): 941-946.
[31] LEE S M, DO H J, SHIN M J, et al. 1-Deoxynojirimycin isolated from a Bacillus subtilis stimulates adiponectin and GLUT4 expressions in 3T3-L1 adipocytes[J]. Journal of Microbiology and Biotechnology,2013, 23(5): 637-643.
[32] HYUN J D, JI H C, JI W H, et al. 1-Deoxynojirimycin isolated from bacillus subtilis improves hepatic lipid metabolism and mitochondrial function in high-fat-fed mice[J]. Food and Chemical Toxicology, 2015,75: 1-7.
Effect and Mechanism of 1-Deoxynojirimycin on Lipid Metabolism in Obese Mice
WANG Ling1, ZENG Yitao1, HUANG Xianzhi2, DING Xiaowen1,*
(1. College of Food Science, Southwest University, Chongqing 400716, China;2. State Key Laboratory of Silkworm Genome Biology, Chongqing 400716, China)
This study explored the regulatory effect of 1-deoxynojirimycin (DNJ) on lipid metabolism in obese mechanism rats as well as the underlying mechanism of action to provide valuable information for the development of DNJ-based antilipemic and antidiabetic agents. An obese mouse model was created by feeding mice on a high-fat diet, and then all mice were fed on a normal diet for 40 days. During this period, the animals in the experimental groups were gavaged with DNJ at different doses (8.0, 4.0 and 2.0 mg/ (kg·d)). At the end, serum biochemical indicators, serum adipocytokines, and the enzyme activities involved in the synthesis and oxidation of fatty acids were determined by enzyme linked immunosorbent assay (ELISA) kits. Compared with the negative control group, DNJ at 8.0 mg/(kg·d) reduced the body weight of obese female and male mice by 9.06% and 14.07%, decreased liver fat content by 4.13% and 27.82%, intra-abdominal fat to body weight ratio by 9.00% and 34.30%, serum total cholesterol (TC) level by 11.57% and 35.13%, triglyceride level by 46.89% and 30.65%, high-density lipoprotein (HDL) level by 28.86% and 7.00%, free fatty acid (FFA) content by 10.60%and 10.20% and visfatin level by 38.44% and 26.76%, increased adiponectin level by 29.66% and 26.96%, decreased acetyl CoA carboxylasec (ACC) activity in the liver by 17.03% and 15.52% and fatty acid synthetasein (FAS) activity by 23.53%and 21.13%, and elevated carnitine palmitoyl transferase (CPT) activity by 20.38% and 17.20% and acyl-CoA oxidase(ACO) activity by 11.00% and 16.29%, respectively. These results suggested that when combined with less energy intake,DNJ can improve blood lipid levels, reduce fat accumulation and control body weight by inhibiting fatty acid synthesis and accelerating fatty acid oxidation. In addition, DNJ has a better effect on male mice than female ones.
1-deoxynojirimycin; blood lipid; adipocytokines; enzyme activity
10.7506/spkx1002-6630-201801031
S888.9
A
1002-6630(2018)01-0207-06
2016-10-20
国家现代农业(家蚕)产业技术体系建设专项(CARS-22-0503);公益性行业(农业)科研专项(201303053)
王玲(1993—),女,硕士研究生,研究方向为食品安全与功能食品。E-mail:1528542433@qq.com
*通信作者简介:丁晓雯(1963—),女,教授,博士,研究方向为食品安全与功能食品。E-mail:xiaowend@sina.com
王玲, 曾艺涛, 黄先智, 等. 1-脱氧野尻霉素对肥胖小鼠脂代谢的影响及机理[J]. 食品科学, 2018, 39(1): 207-212.
DOI:10.7506/spkx1002-6630-201801031. http://www.spkx.net.cn
WANG Ling, ZENG Yitao, HUANG Xianzhi, et al. Effect and mechanism of 1-deoxynojirimycin on lipid metabolism in obese mice[J]. Food Science, 2018, 39(1): 207-212. (in Chinese with English abstract)
10.7506/spkx1002-6630-201801031. http://www.spkx.net.cn
