温室条件下水花生对富营养化水体浮游生物和水质的影响
2018-01-06李印霞刘碧波饶本强李敦海
李印霞,刘碧波,饶本强,李敦海
(1.河南工程学院,郑州 451191;2.信阳师范学院,河南信阳 46400;3.中国科学院水生生物研究所,武汉 430072)
温室条件下水花生对富营养化水体浮游生物和水质的影响
李印霞1,刘碧波1,饶本强2,李敦海3
(1.河南工程学院,郑州 451191;2.信阳师范学院,河南信阳 46400;3.中国科学院水生生物研究所,武汉 430072)
【目的】研究温室条件下水花生对巢湖西半湖富营养化水体浮游生物群落组成及水质的影响。【方法】将备用水花生植株移入盛有湖水的塑料桶中,每3天取一次样,监测水体浮游植物和浮游动物生物量、水体总氮、总磷、氨氮和硝态氮含量及pH值动态变化。实验进行至24天时,监测水体中化感物质、微囊藻毒素及溶解氧的含量。【结果】水花生对蓝藻生长及微囊藻毒素合成抑制作用显著,增加了藻类的物种多样性,同时增大浮游动物密度,引起浮游植物及浮游动物的种群演替。此外,水花生能够有效去除水体氮、磷营养盐和降低水体pH值。【结论】水花生对于富营养化水体和蓝藻的防治具有较好的效果,使水生态系统生物物种组成更加完善,能够起到一定的生态修复的作用。
水花生;富营养化;浮游植物;浮游动物;生物量;营养盐
随着社会经济的不断发展,大量污废水排放入湖泊导致水体富营养化日益加剧[1-2],进而导致水华暴发,生物多样性降低,水生态系统破坏[3-4]。近些年来巢湖西半湖的水质已降至V类,甚至劣V类[5]。巢湖湖泊水体中较高的营养盐浓度是巢湖蓝藻水华发生的主要成因[6]。另外现场探察发现水华暴发时巢湖西半湖靠近湖岸带经常富集大量水花生。先前大量研究发现水生植物能够有效地抑制藻类的生长[7-10],尤其是水花生(Alternanthera Philoxeroides),能够有效降低水体富营养化,对于水华的治理有着很好的应用前景[11-12]。水花生又名空心莲子草、喜旱莲子草、水苋菜、革命草,苋科、莲子草属,多年生宿根草本植物,多分布于淡水水体或河湖沼泽区。近年来,水花生因其具有极强的生态适应性和抗污耐寒能力,已成为水体生态修复的首选物种之一,被广泛应用于各类污水生态处理中。本试验探讨了温室条件下水花生对水华期间巢湖西半湖水体浮游生物的影响及水质净化效果,以便为巢湖更好地实现水环境的生物治理提供科学依据。
1 材料方法
1.1 试验材料准备
水花生取自巢湖西半湖的湖滨区。同一区域内选取含根、茎、叶、嫩芽齐全的水花生,经自来水冲洗去除污垢和杂质后放置于盛有自来水的大塑料盆中(底部直径50 cm,高25 cm),饥饿培养3 d。选取长势良好、须根发达和植株高度大致相同的水花生,将其含有较发达须根的茎叶处(距枝端7 cm节处,株高25 cm左右)截断备用。
试验用水取自巢湖西半湖湖水,属于重度富营养化水体。水体初始总氮(TN)、总磷(TP)、和氨氮(NH4+-N) 的浓度分别为(5.19±0.21)mg/L、(0.63±0.05)mg/L 和(0.516±0.07)mg/L。
1.2 试验方法
试验从2014年8月1日开始,用5 L采样器取巢湖西半湖富营养化湖水300 L于塑料桶中(底部直径77 cm,高81 cm),混合均匀后,用5 L采样器取水样到6个敞口50 L塑料桶(底部直径31 cm,高50 cm)中。以湖水为培养液,分别将备用水花生植株(湿重0.5 kg)移入3个塑料桶(80%表面覆盖率),另3个桶作为试验对照。水花生的培养在温室大棚内进行,试验期为24 d。期间每3 d用1 L采样器采集桶中水样,进行浮游生物和水质理化指标测定。
1.3 浮游生物测定
1.3.1 浮游植物和浮游动物的鉴定与计数
水样采集时,于上午9点水样采集完成后立即带回进行处理分析。取1 L水样于2个塑料瓶,分别用4%Lugol's碘液、4%甲醛溶液固定水样,静置沉淀48 h后,虹吸移除上清液,定容浓缩液[13],通过光学显微镜(CX21,Olympus,Tokyo,Japan)鉴定浮游植物和浮游动物的种类,并计数。如若微囊藻是群体,需通过超声波细胞粉碎仪(Branson Digital SonifierR,Branson Ultrasonics Corporation,USA)打散成为单细胞再进行记数。浮游植物和浮游动物密度分别通过浮游植物计数框(规格为0.1 mL)[6,14]和浮游动物计数框(规格为1 mL)[15-16]显微镜下计数获得。
1.3.2 浮游植物叶绿素a测定
水样带回试验室后立即加入微量碳酸镁溶液(10 ng/L)固定。量取250 mL水样,将浮游植物抽滤至 0.45 μm 微孔纤维滤膜(Whatman GF/C,Kent,UK)上。在避光条件下,将滤膜浸泡在90%的丙酮溶液,研磨、4℃抽提过夜、离心,测定其在750、664、647及630 nm 4种波长下吸光度值,根据Jeffrey-Humphreyde公式进行换算叶绿素a含量[6]。
1.4 水质理化指标测定
总氮(TN)和总磷(TP)分别采用紫外分光光度法和硫酸消解法进行测定。用0.45 μm微孔纤维滤膜(Whatman GF/C,Kent,UK)抽滤水样,分别用紫外分光光度法、纳氏比色法测定硝态氮(NO3--N)和氨氮(NH4+-N)[17]。pH值和溶解氧(DO)分别通过pH仪(YSI pH60,USA)和溶氧仪(YSI 550A)测定。
1.5 水体中有机成分测定
水体中醇类、酯类、酸类等有机物组成成分采用气质联用技术(GC-MS)鉴定及分析[18]。水体中微囊藻毒素(MC-RR,MC-LR,MC-LR[D-Asp3])通过高效液相色谱仪(Shimadzu CLASS-LC10)测定[19]。
2 结果
2.1 水花生对富营养化水体浮游藻类组成的影响
从图1硅藻门、绿藻门、蓝藻门生物量百分比的变化中可以看出,在试验期24 d中,无水花生的对照处理中蓝藻生物量占77%。至试验结束时,与对照相比,硅藻和绿藻的生物量明显增加,而蓝藻生物量仅占41%(图1)。这说明水花生对蓝藻的控藻作用十分明显,有利于降低蓝藻水华的发生。由图2中可见,初始培养(0 d)至9 d时,蓝藻细胞数量百分比均大于90%。但到12 d时,绿藻和硅藻细胞密度分别增大至0.113个/L和0.064个/L,而蓝藻细胞密度降为0.264个/L。到第15天时,硅藻、绿藻及蓝藻的藻细胞密度分别为0.075 9个/L、0.117个/L和0.168个/L,这说明水花生增大了藻类的物种多样性,从而在一定程度上避免某种藻华的爆发。
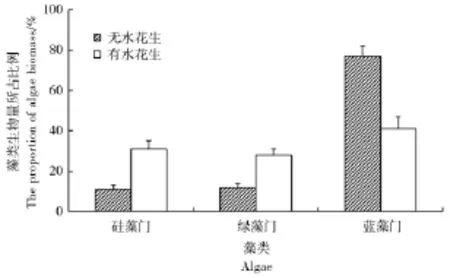
图1 水花生对不同种类藻类生物量的影响(24 d培养)Figure 1 Effect of Alternanthera Philoxeroides on biomass of different alga(culture for 24 days)
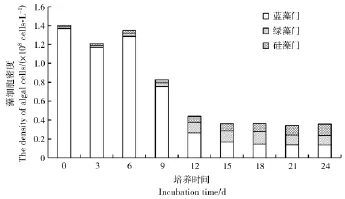
图2 水花生处理过程中不同种类藻细胞密度的变化Figure 2 Changes of algal cell density during the treatment of Alternanthera Philoxeroides on different alga(culture for 24 days)
2.2 水花生对富营养化水体叶绿素a含量的影响
由图3可知,第6天时,处理组出现一次藻类叶绿素a含量的大量增加。从第9天开始,处理组中藻类叶绿素a含量出现大幅度降低至试验结束时水花生处理组藻类叶绿素a含量已降至0.062 5 mg/L,而对照组藻类叶绿素a含量仍维持在较高水平。由此可以看出,水花生能够有效抑制浮游藻类的生长繁殖,说明水花生起到了很好的控藻作用。
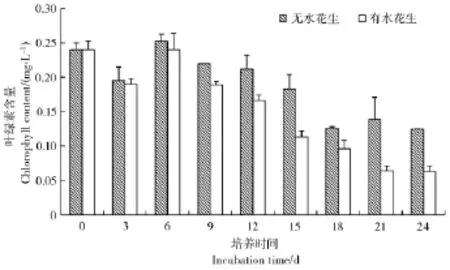
图3 水花生处理过程中藻类叶绿素a含量的变化Figure 3 Content changes of chlorophyll a during the treatment of Alternanthera Philoxeroides on different alga(culture for 24 days)
2.3 水花生对富营养化水体浮游动物的影响
从图4中看出,在试验的0~15 d中,3种的浮游动物的密度是逐渐增大的。在第15天时,桡足类和轮虫的密度均达到各自的最大值,即分别为309和19 ind/L,且3种浮游动物的密度值表现为:桡足类>轮虫>枝角类。第18天时,浮游动物的密度又出现大幅度下降。第18天至24天,轮虫密度在逐渐增大,桡足类的密度逐渐下降。在第24天,水花生处理组的不同浮游动物密度均显著高于对照组。在处理组中,3种浮游动物的密度值从大到小呈现为:轮虫>枝角类>桡足类。
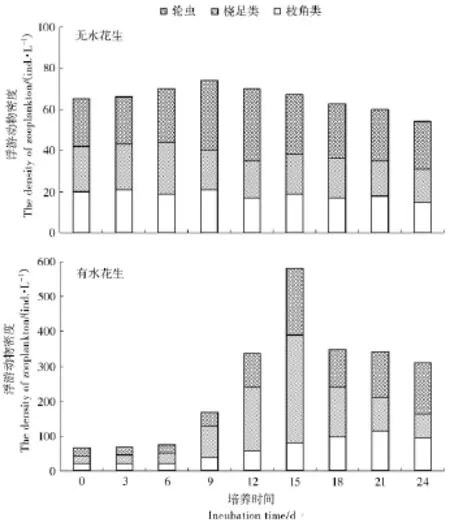
图4 水花生处理过程中不同种类浮游动物密度的变化Figure 4 Changes of density during the treatment of Alternanthera Philoxeroides on different zooplankton(culture for 24 days)
2.4 水花生对试验水质的影响
图5表明,在试验处理过程中,与对照组相比,水花生处理组富营养化水体的总氮(TN)和总磷(TP)含量是逐步且显著降低的,TN由试验起始时的5.2 mg/L最终降至1.2 mg/L,TP则由初始的0.53 mg/L最终降至0.11 mg/L。而对照组中水体中TN和TP变化不显著。可见,水花生对于富营养化水体中营养物质氮、磷的去除有显著的效果。另外,水体中氨氮(NH4+-N)和硝态氮(NO3--N)测定结果表明,试验过程中水花生处理组的NH4+-N浓度是逐步且明显减小的,而NO3--N浓度却出现明显增大(见图 6)。
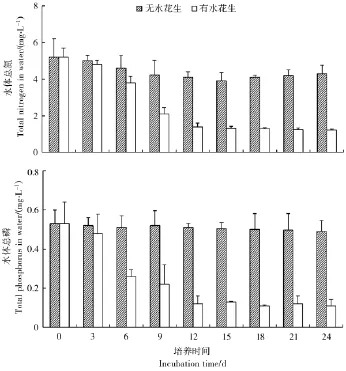
图5 水花生处理过程中水体总氮、总磷的变化Figure 5 Changes of TN and TP during treatment of Alternanthera Philoxeroides on experimental water
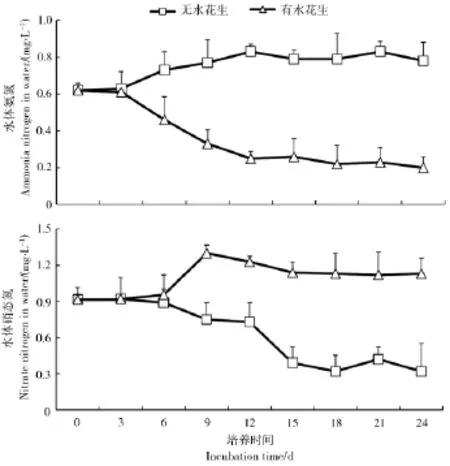
图6 水花生处理过程中水体氨氮、硝态氮的变化Figure 6 Changes of NH4+-N and NO3--N during treatment of Alternanthera Philoxeroides on experimental water
经测定,试验开始时水体的pH为10.51。水花生处理的3~9 d中,水体的pH值出现显著降低,随后呈现稳定性波动(pH=7.2左右)。在对照组中,第3 d时,水体pH也出现显著降低,随后呈现轻微的升高和波动,试验结束时pH值达到9.8左右。
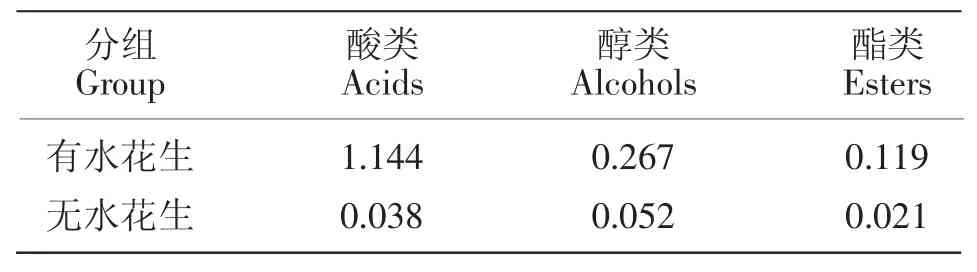
表1 第24天时水体中有机物含量Table 1 The content of organic matters in water on the 24th daymmol·L-1

图7 水花生处理过程中水体pH值的变化Figure 7 Changes of pH values during treatment of Alternanthera Philoxeroides on experimental water

表2 第24天时水体中溶解氧(DO)含量Table 2 The content of dissolved oxygen(DO)in water on the 24th day mg·L-1
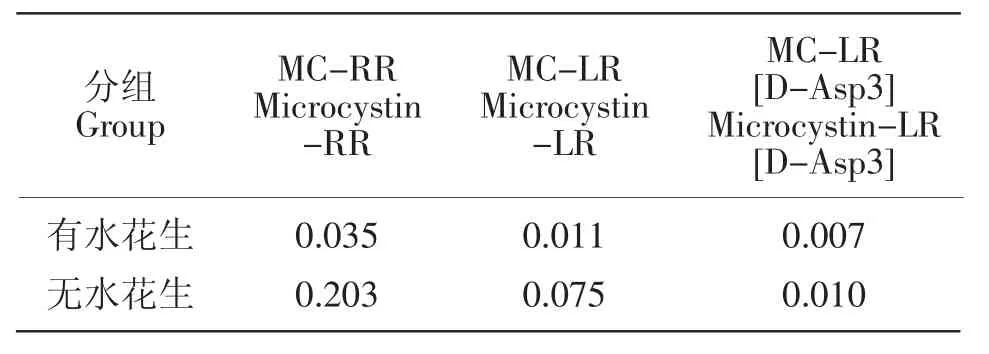
表3 第24天时水体中微囊藻毒素含量Table 3 The content of microcystins in water on the 24th day μg·L-1
3 讨论
水生植物可通过竞争水体中营养盐、光照等抑制藻类的生长[7-10]。国内外也日益重视水花生与水华藻类的相互作用研究[11-14]。有文献报道水花生根部可分泌一些化感物质从而胁迫浮游藻类的生长[10,12]。本试验对照组叶绿素a含量显著高于水花生处理组(见图3),说明水花生很可能抑制了浮游藻类的生长。处理组中不同浮游藻类种类的生物量比例发生了较大变化(见图1),试验初始时蓝藻占绝对优势,随着水花生处理过程的进行,硅藻和绿藻的生长速度远远大于蓝藻,且其生物量比例有了很大提高。这说明水花生对蓝藻可能有着较强的抑制作用。一方面可能是蓝藻适宜生长在富营养化程度较高的水体中,而试验中水花生吸收了大量氮、磷营养盐(见图5、图6);另一方面,第24天时水花生处理组水体中酸类、醇类、酯类含量显著高于对照组(P<0.05)(见表1),表明水花生释放的信号物质对微囊藻可能具有一定的化感抑制效应。已有文献报道高浓度水花生浸提液可以诱导植物产生氧化胁迫,进而影响微囊藻或其他植物正常的光合作用,导致细胞死亡[20-22]。
本试验中,处理组浮游植物生物量虽然降低了,但是浮游动物的生物量却显著增加,且不同种类的浮游动物的生物量呈现不同的变化。试验之初枝角类和桡足类是优势种群,而到了试验后期轮虫和枝角类生物量迅速增大(见图4)。在本试验中,浮游动物没有受到鱼类的捕食压力,浮游动物的生物量调控主要受到其饵料的影响。轮虫和枝角类都喜欢摄食细菌、单细胞绿藻和硅藻等,水花生处理过程绿藻的生物量比例大大增加了,有利于浮游动物摄食;此外,轮虫繁殖周期较短,有利于其在短期内大量增殖。本试验中,水花生造成蓝藻生物量的大幅度降低,而在一定程度上促进了绿藻和硅藻生物量的增加,从而刺激了浮游动物的生物量的增大。我们镜检发现,试验初始水体中蓝藻为优势浮游藻类,且微囊藻占蓝藻的绝大多数,其中主要是铜绿微囊藻。铜绿微囊藻为群体状态,形体较大,不适于浮游动物食用。此外,微囊藻产生的毒素也对浮游动物的生理代谢产生有害影响见。由表2可知,第24天时水花生处理组水体中3种微囊藻毒素(MCRR,MC-LR,MC-LR[D-Asp3])的含量均显著低于对照组,表明水花生抑制微囊藻生长的同时可能也抑制了微囊藻毒素的合成。有文献指出水花生所分泌的酸类等化感物质很可能是通过破坏细胞膜上离子通道的途径产生作用[24],也可能通过诱导藻细胞的信号分子调控微囊藻毒素合成基因的表达[25]。可见,微囊藻毒素与水花生释放的化感物质之间存在复杂的作用关系[26],微囊藻毒素可能通过与酸类、醇类、酯类等化感物质的相互作用调控藻类的生长,从而在蓝藻、绿藻、硅藻等藻类的演替中起重要作用。因此,微囊藻占主要地位时,浮游动物基本上处于饥饿和毒害状态而不利于它们增殖。当绿藻逐渐占优势时,将比较适于食用,所以浮游动物的生物量大增。
试验中,水花生能够显著降低富营养化水体的总氮和总磷含量,说明水花生对于富营养化水体中氮、磷营养盐的去除效果较好(见图5)。因此,在实践中利用水花生治理富营养化水体和防治蓝藻水华具有一定的理论依据,即通过水花生的脱氮、除磷作用而达到控藻的目的,从而降低蓝藻水华的发生。此外,我们还发现,试验过程中水花生处理组中NH4+-N浓度逐步减小,而NO3--N浓度却出现明显增大(图6)。这可能是由于水花生处理组发生了较多的硝化反应,从而将大量的氨氮转化为硝态氮。溶解氧(DO)是生物硝化正常进行的重要影响因素之一[27],表3表明第24天时水花生处理组水体中DO显著高于对照组。可见,水花生处理组有利于硝化反应的进行。另外,pH值也是硝化反应的必需要素,因为硝化过程需要硝化细菌的参与,而硝化细菌需要在6.5~8.5范围内进行[28]。本研究中pH值的测定结果与此观点相吻合(见图7)。试验中水花生处理组pH值保持在中性范围,而对照组pH值基本维持在9.8左右。因此,对照组中的高pH值将不利于硝化过程的进行。这在一定程度上解释了为什么微囊藻逐渐消失的现象,微囊藻通常喜欢碱性的环境。水花生之所以能够降低试验水体pH值,原因可能是水花生产生并释放了化感物质导致了水体发生相关水化学变化的结果。表1结果表明培养过程中水花生释放了1.144 mmol/L酸性物质,显著高于对照组。另有研究表明,硝化过程在pH7.5以下时进展较为缓慢[28],而本试验中水花生处理组pH较长时间维持在7.2左右,因此硝化作用并不强烈,且硝态氮和铵态氮保持着较为稳定的水平。
4 结论
①水花生对于蓝藻的生长及毒素的合成有较好的抑制作用,并在一定程度上促进绿藻、硅藻的生长,增加藻类的生物多样性。
②水花生能够促进浮游动物的增殖,使水生态系统生物物种组成更加完善。
③水花生对水体的氮、磷营养盐的去除率高,有较好的脱氮、除磷效果。
④水花生释放的化感物质可降低水体pH值,可促进水体进行硝化反应。
⑤水花生对于富营养化水体和蓝藻的防治具有较好的效果,能够起到一定的生态修复的作用。
[1]RENAUD S L,PICK F R,FORTIN N.Effect of light intensity on the relative dominance of toxigenic and nontoxigenic strains of Microcystis aeruginosa[J].Applied and Environmental Microbiology,2011:7016-7022.
[2]OKELLOW W,OSTERMAIER V,PORTMANN C,et al.Spatial isolation favours the divergence in microcystin net production by Microcystis in Ugandan freshwater lakes[J].Water Research,2010(44):2803-2814.
[3]RINTA-KANTO J M,KONOPKO E A,DEBRUYN J M,et al.Lake Erie Microcystis:relationship between microcystin production,dynamics of genotypes and environmental parameters in a large lake[J].Harmful Algae,2009,8(5):665-673.
[4]SEDMAK B,ELERSEK T.Microcystins induce morphological and physiological changes in selected representative phytoplanktons[J].Microbiological Ecology,2005(50):298-305.
[5]LI Y X,LI D H.Physiological variations of bloom-forming Microcystis(Cyanophyceae)related to colony size changes during blooms[J].Phycologia,2012,51(6):599-603.
[6]李印霞,饶本强,汪志聪,等.巢湖藻华易堆积区蓝藻时空分布的研究[J].长江流域资源与环境,2012(S2):25-31.
[7]周真明,梅玉龙,叶青,等.3种浮床植物系统对富营养化水体中藻类的抑制效果[J].华侨大学学报(自然科学版),2011,32(3):138-142.
[8]宋伟,周庆,王彦玲,等.几种植物净化能力的比较及浮床应用效果研究[J].江苏农业科学,2010(5):474-477.
[9]朱普平,王子臣,盛婧,等.不同覆盖度水葫芦对水体环境的影响[J].江苏农业科学,2011,39(2):471-472.
[10]汪丽,王国祥,唐晓燕,等.不同类型水生植物群落对蓝绿藻类的抑制作用[J].生态学杂志,2009,28(12):2567-2573.
[11]陈广,黄翔峰,何少林,等.高效藻类塘去除农村生活污水中的磷[J].中国给水排水,2006,22(9):43-45.
[12]张伟,韩士群,郭起金.凤眼莲、水花生、鲢鱼对富营养化水体藻类及氮、磷的去除作用[J].江苏农业学报,2012,28(5):1037-1041.
[13]蔡庆华.水域生态系统观测规范:中国生态系统研究网络(CERN)长期观测规范丛书[M].北京:中国环境科学出版社,2007:112-149.
[14]ELLEN VAN D,WOUTER J.VAN DE B.Impact of submerged macrophytes including charophytes on phyto-and zooplankton communities[J].Aquatic Botany,2002,72(3):261-274.
[15]金相灿,屠清瑛.湖泊富营养化调查规范[M].北京:中国环境科学出版社,1990:93-152.
[16]沈嘉瑞.中国动物志节肢动物门甲壳纲淡水桡足类[M].北京:科学出版社,1979:107-145.
[17]高月香,张永春.水文气象因子对藻华爆发的影响[J].水科学与工程技术,2006(2):10-13.
[18]周会.入侵植物水花生对草坪草马尼拉化感作用的研究[D].芜湖:安徽师范大学,2015.
[19]LI Y X,LI D H.Competition between toxic Microcystis aeruginosa and nontoxic Microcystis wesenbergii with Anabaena PCC-7120[J].J Appl Phycol,2012(24):69-78.
[20]张伟,韩士群,郭起金.凤眼莲、水花生、鲢鱼对富营养化水体藻类及氮、磷的去除作用[J].江苏农业学报,2012,28(5):1037-1041.
[21]李淑梅,王付娟.水花生不同部位水浸液对黑麦草种子的化感作用[J].种子,2016,35(6):96-98.
[22]黄永杰,周会,张丹丹,等.水花生及其根际土浸提液对马尼拉幼苗生长生理特性的影响[J].水土保持学报,2015,29(1):285-291.
[23]DEMOTT W R,ZHANG Q X,CARMICHAEL W W.Effects of toxic cyanobacteria and purified toxins on the survival and feeding of a copepod and three species of Daphnia[J].Limnol Oceanogr,1991(36):1346-1357.
[24]倪利晓,任高翔,陈世金,等.酚酸和不饱和脂肪酸对铜绿微囊藻的联合作用[J].环境化学,2011,30(8):1428-1432.
[25]SHAO J,WU Z,YU G,et al.Allelopathic mechanism of pyrogallol to Microcystis aeruginosa PCC7806(Cyanobacteria):from views of gene expression and antioxidant system [J].Chemosphere,2009,75(7):924-928.
[26]李伟英,石恬恬,孔令云,等.微囊藻毒素与酚类和脂肪酸类化感化合物相关关系的研究进展[J].安全与环境学报,2014,14(3):338-341.
[27]康媞,林铁.溶解氧对硝化反硝化反应的影响[J].贵州环保科技,2013,9(3):13-15.
[28]任杰,林炜铁,罗小春,等.硝化菌保藏特性及衰减动力学研究[J].中国生物工程杂志,2007,27(12):61-65.
Effects of Alternanthera Philoxeroides on Plankton and Water Quality from Eutrophic Water
LI Yin-xia1*,LIU Bi-bo1,RAO Ben-qiang2,LI Dun-hai3
(1.Henan Institute of Engineering,Department of Resource and Environmental Engineering,Zhengzhou 451191,China;2.Xinyang Normal University,Xinyang 464000,Henan,China;3.Key Laboratory of Algal Biology,Institute of Hydrobiology,Chinese Academy of Sciences,Wuhan 430072,China)
【Objective】A long-term experiment was set up to study the effects of Alternanthera Philoxeroides on phytoplankton community composition and water quality.The findings will provide a scientific basis for better biological control of aquatic environment.【Method】The experiment was carried out in Chaohu Experimental Base.Alternanthera Philoxeroides was transferred into the plastic bucket filled with lake water.The water samples were taken every 3 days,and the biomass of phytoplankton and zooplankton,the contents of total nitrogen(TN),total phosphorus(TP),ammonia nitrogen(NH4+-N)and nitrate nitrogen(NO3--N)in the water body,and the pH value were monitored.In addition,the contents of allelochemicals,microcystins and dissolved oxygen in the water were monitored on the 24th day.【Result】Experimental results showed that Alternanthera Philoxeroides could strongly inhibit the growth of cyanobacteria and the synthesis of microcystins,increase algal diversity and improve the density of zooplankton,and at the same time,Alternanthera Philoxeroides could cause populations succession of phytoplankton and zooplankton.Moreover,Alternanthera Philoxeroides could effectively remove the nutrition of nitrogen and phosphorus and decrease pH value.【Conclusion】Alternanthera Philoxeroides showed great effects on the prevention and treatment of eutrophic water and cyanobacteria,made the composition of biological species in aquatic ecosystem more scientific,and could play a certain role in ecological restoration.
Alternanthera Philoxeroides;eutrophication;phytoplankton;zooplankton;biomass;nutrition salts
X173 文献标志码:A 文章编号:1000-2650(2017)02-0260-06
10.16036/j.issn.1000-2650.2017.02.019
2016-10-08
河南省高等学校重点科研项目(15A610011);河南工程学院博士基金项目(D2014009)。
李印霞,博士,讲师,从事水体污染控制与治理研究,Email:liyinxia111@163.com。
(本文审稿:王应军;责任编辑:秦碧雯;英文审稿:刘益平)
