长期施肥对大麦-双季稻种植方式中大麦根际土壤微生物群落功能多样性的影响
2018-01-09徐一兰唐海明程爱武李益锋王跃平胡赛晶
徐一兰,唐海明,程爱武,李益锋,李 永,何 炜,王跃平,胡赛晶
(1.湖南生物机电职业技术学院,长沙 410127;2.湖南省土壤肥料研究所,长沙 410125;3.湖南省宁乡县农业局,湖南宁乡 410600)
长期施肥对大麦-双季稻种植方式中大麦根际土壤微生物群落功能多样性的影响
徐一兰1,唐海明2*,程爱武3,李益锋1,李 永3,何 炜3,王跃平3,胡赛晶3
(1.湖南生物机电职业技术学院,长沙 410127;2.湖南省土壤肥料研究所,长沙 410125;3.湖南省宁乡县农业局,湖南宁乡 410600)
【目的】微生物群落功能多样性是土壤质量变化的敏感指标,施肥措施与土壤微生物群落功能多样性关系密切。本文的目的在于探明不同施肥措施对土壤微生物群落功能多样性的影响。【方法】以双季稻主产区肥料长期定位试验田为研究对象,应用Biolog技术分析了化肥(MF)、秸秆还田+化肥(RF)、30%有机肥+70%化肥(LOM)、60%有机肥+40%化肥(HOM)、无肥对照(CK)不同施肥处理对大麦成熟期双季稻田根际土壤微生物功能多样性的影响,从根际土壤微生物功能多样性的角度评价施肥对土壤质量的影响。【结果】MF、LOM和HOM处理大麦根际土壤微生物对碳源的利用程度均显著高于其他处理,而RF处理大麦根际土壤微生物对碳源的利用程度低于CK处理。在大麦成熟期,Richness和Shannon指数大小顺序均表现为:HOM>LOM>RF>CK>MF,McIntosh指数均以HOM和LOM处理为最高,其次为RF和CK处理,MF处理最低。土壤微生物碳源利用的主成分分析结果表明,各施肥处理大麦根际土壤微生物群落利用的碳源主要为氨基酸类和糖类,不同施肥处理间碳源利用类型存在明显的差异。【结论】不同施肥处理对大麦根际土壤微生物功能多样性产生了不同影响,长期有机无机肥配施有利于维持稻田根际土壤微生物群落多样性。
不同施肥;双季稻田复种;大麦根际土壤;微生物群落;功能多样性
微生物是土壤中重要的组成部分之一,是土壤环境质量重要的指标,它对外界环境变化十分敏感,在土壤养分循环、肥力变化、生态环境等方面起着十分重要的作用[1]。根际土壤微生物具有繁殖快、数量多和代谢能力强的特点,对根际土壤养分循环、作物生长发育和养分特性等方面均有显著的影响[2]。土壤微生物群落功能多样性是土壤微生物群落状态与生态特征的有效指标[2]。目前,大量的研究者主要是采用Biolog微平板分析法开展土壤微生物多样性研究,它主要是探明土壤微生物对不同碳源利用能力及其代谢的差异,从而揭示土壤微生物功能多样性[3]。
土壤微生物与种植制度、作物种类、土壤类型、施肥制度、田间水分管理等农业措施的关系密切,施肥是影响其功能多样性关键因素之一,土壤微生物功能多样性易受肥料的种类、施用时期和用量等影响。施肥通过改变土壤的理化特性和生物活性,间接影响作物的生长发育和产量[4]。前人研究表明,施肥与土壤微生物群落结构关系密切。谭周进等认为,高比例的有机肥施肥处理对土壤微生物数量没有明显的影响,但显著增强了土壤微生物活性[5];Hu J.L.等研究表明,采用长期平衡施肥处理有利于增强土壤微生物量碳、氮和微生物功能活性[6];侯晓杰等研究表明,合理配施肥料有利于增加微生物对碳源的利用程度和微生物功能多样性[7];徐万里等认为,化肥及化肥配施有机肥处理均有利于增加土壤微生物多样性[8];R.D.Lovell等研究表明,长期施用无机氮肥降低了土壤微生物活性[9]。但是,由于各地的气候、土壤、种植制度和习惯多样,施肥对土壤微生物功能多样性影响的研究结果各异。
湖南是我国双季稻主产区,该区域稻田土壤肥力是水稻高产、稳产的基础。稻田经过长期定位施肥后各项理化指标均趋于稳定,因此研究长期定位施肥对稻田养分循环及生态环境等方面具有十分重要的意义。近年来,有学者开展了双季稻区不同施肥措施对水稻某一时期稻田土壤微生物群落功能多样性影响的研究[5,10],在大麦-双季稻多熟种植模式条件下,虽对早、晚稻成熟期稻田土壤微生物群落功能多样性开展了部分研究[11],但是不同施肥措施对大麦生育期土壤微生物群落功能多样性影响的研究还有待进一步开展。因此,本研究以长期肥料定位试验为平台,探索大麦生育期稻田根际土壤微生物功能在不同施肥条件下的响应机制,从而为稻田的可持续生产提供充分的理论依据。
1 材料和方法
1.1 试验地概况
不同施肥模式定位试验始于1986年,在湖南省宁乡县农技中心(112°18′E,28°07′N)内进行,为典型的双季稻主产区,海拔36.1 m,年均气温16.8℃,年平均降雨量1 553.70 mm,年蒸发量1 353.9 mm,无霜期274 d。试验地土壤为水稻土,河沙泥土种,种植制度为大麦-双季稻,肥力中等,排灌条件良好。1986年试验前耕层土壤(0~20 cm)基础肥力:有机质 29.39 g/kg、全氮 2.01 g/kg、全磷 0.59 g/kg、全钾20.6 g/kg、碱解氮144.1 mg/kg、有效磷12.87 mg/kg、速效钾33.0 mg/kg和pH为6.85。
1.2 试验设计及田间管理
试验设5个施肥处理:①化肥处理(MF:mineral fertilizer alone):施氮、磷、钾化肥,不施任何有机肥;②秸秆还田+化肥处理(RF:rice residues plus mineral fertilizer):施用晚稻秸秆与化肥处理;③30%有机肥处理(LOM:30%organic matter plus 70%mineral fertilizer):有机肥的氮含量占总施氮量的30%,其余70%的氮为化肥氮;④60%有机肥处理(HOM:60%organic matter plus 40%mineral fertilizer):有机肥的氮含量占总施氮量的60%,其余40%的氮为化肥氮;⑤无肥对照(CK:without fertilizer):不施任何肥料。
每个小区长10.00 m,宽6.67 m,面积66.7 m2,小区间用水泥埂隔开,埋深100 cm,高出田面35 cm。保证各小区不窜灌、窜排。2015年,大麦供试品种为宁麦8号(Hordeum vulgare L.),11月10日耕地和施基肥,11月11日大麦进行播种,2016年1月8日追肥,4月30日收获。各施肥处理总施N:157.5kg/hm2、P2O5:43.2 kg/hm2和 K2O:81.0 kg/hm2;施用有机肥的处理,有机肥均为腐熟鸡粪,30%有机肥和60%有机肥处理有机肥的施用量分别为:2670.0、5 340.0 kg/hm2(有机肥养分含量均为N:1.77%、P2O5:0.80%和K2O:1.12%);化肥处理N、P2O5、K2O的肥料种类分别为尿素、过磷酸钙和氯化钾;秸秆还田+化肥处理的秸秆还田量为3 000.0 kg/hm2(秸秆养分含量N:27.3 kg/hm2、P2O5:3.9 kg/hm2、K2O:56.7 kg/hm2);各处理以等氮量为基准,不足的氮、磷、钾肥用化肥补足;各施肥处理秸秆和有机肥均于稻田耕地时作基肥一次性施入;N和K2O作基肥和追肥2次施入,基肥在耕地时施入,追肥在分蘖期施用,基追肥比例均按7∶3施用;P2O5均在耕地时作基肥一次性施入。其他管理措施同常规大田生产。
1.3 样品采集与测定方法
试验经过30年的定位试验后,于2016年大麦的成熟期进行土壤样品的采集,每个小区采取多点取样采集根际土壤组成一个样品,重复3次。根际土壤取样方法采用“抖根法”,即先将植株根系从土壤中挖出,抖掉与根系松散结合的土体,然后将与根系紧密结合在0~4 mm范围的土壤用刷子刷下来作为根际土壤。土壤剔除石砾及植物残茬等杂物后,迅速装入塑料袋并置于冰盒中,运至实验室,4℃冰箱保存,Biolog分析在取样后48 h内进行。
试验使用Biolog-ECO微平板法进行测定[10],反应平板的第1个孔为不含任何C源的对照,其余每孔中含有1种C源和氧化还原染料四氮唑蓝。微生物利用碳源进行呼吸使氧化还原电势发生变化,并将四唑类(TV)从无色还原成紫色[12],通过测定反应平板各孔的吸光值及其变化来反映微生物群落代谢功能的多样性[13]。具体实验步骤是,取经预培养的新鲜土样10 g,加95 mL无菌的0.145 mol/L NaCl溶液在摇床上振荡15 min,然后用无菌水分步稀释至10-3,取上清液(125 μL)接种到反应平板的每个孔中,将接种好的反应平板放至25℃下培养,每隔12 h在波长为590 nm的Biolog读数器上读数,试验持续12 d。
1.4 数据处理
根据公式(1)计算反应平板孔中溶液吸光值平均变化率(average well color development,AWCD);根据公式(2)计算Shannon指数H(用于评估物种的丰富度);根据公式(3)计算McIntosh指数U(用于评估群落物种均匀度)[3,14]。
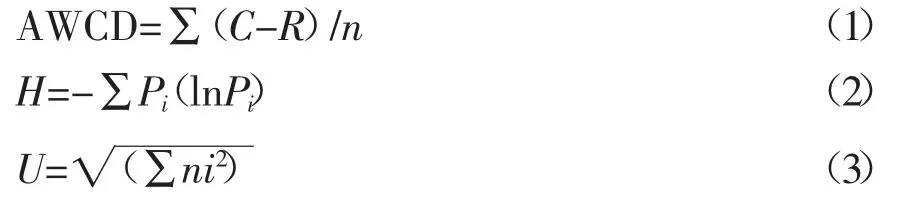
式中,C为每个有培养基孔的吸光值,R为对照孔的吸光值,n为培养基孔数,GN板n值为95。Pi为第i孔的相对吸光值与所有反应孔相对吸光值总和的比值,即:Pi=(C-R)/Σ(C-R)。
数据处理与相关分析采用Microsoft Excel 2003软件进行初步统计,方差分析、主成分分析和多重比较采用DPS 3.11软件进行,多重比较采用LSD法(P<0.05)分析。
2 结果与分析
2.1 板孔平均颜色变化率
平均颜色变化率(average well color development,AWCD)表征微生物群落碳源利用率,是土壤微生物群落利用单一碳源能力的一个重要指标,反映了土壤微生物活性、微生物群落生理功能多样性[3]。大麦成熟期,不同施肥处理大麦根际土壤AWCD变化如图1中所示,AWCD随培养时间的推迟不断增加,不同施肥处理均表现为在开始的36 h变化不大,在第36~108小时内快速升高,随后持续缓慢地升高直到实验结束。其中,化肥、30%有机肥和60%有机肥处理的快速增加过程一直持续到第108小时以后,而秸秆还田和无肥处理基本上在第108小时就结束了。
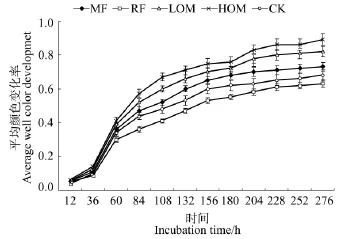
图1 大麦成熟期不同施肥处理根际土壤微生物吸光值AWCDFigure 1 AWCD changes with incubation progress at barley maturity stage with different fertilizer treatments
不同施肥处理对AWCD具有明显的影响。在土壤培养结束时,有机肥与化肥配施以及施用化肥处理的AWCD均高于秸秆还田和无肥处理;秸秆还田处理的AWCD低于无肥处理。
2.2 土壤微生物群落代谢多样性变化
利用Richness、Shannon和McIntosh指数,分别反映大麦成熟期土壤微生物群落物种的丰富度和均匀度。表1中显示,在大麦成熟期,60%有机肥处理Richness指数显著高于化肥处理,其大小顺序表现为:60%有机肥>30%有机肥>秸秆还田>无肥>化肥;60%有机肥和30%有机肥处理Shannon指数均显著高于化肥处理,其大小顺序为:60%有机肥>30%有机肥>秸秆还田>无肥>化肥。Shannon指数的测定结果表明,有机肥与化肥配施以及秸秆还田配施化肥处理的群落丰富度均高于化肥和无肥处理,单施化肥处理最低。McIntosh指数的测定结果表明60%有机肥和30%有机肥处理的物种均匀度最高,其次为秸秆还田和无肥处理,化肥处理最低。
2.3 根际土壤微生物群落代谢功能主成分分析
利用培养108 h后测定的AWCD数据,经过标准化处理后,根据相关文献的方法进行主成分分析[15-18]。大麦成熟期,根据提取的主成分个数一般要求累计方差贡献率达到85%的原则[19],共提取了9个主成分,累计贡献率达84.16%。其中第1主成分(PC1)的方差贡献率为32.62%,第2主成分(PC2)为16.35%,第3~9主成分贡献率均较小,分别为8.26%、6.35%、5.24%、4.21%、4.13%、3.84%和3.16%,因此本研究只对前2个主成分进行分析(图2)。结果表明,不同施肥处理在PC轴上出现明显的分异,在PC1轴上各处理分布分散,秸秆还田处理主要分布在负方向,而化肥、60%有机肥和30%有机肥处理主要分布在PC1轴正方向;PC2轴上秸秆还田处理分布在负方向,60%有机肥和30%有机肥处理分布在正方向,而化肥处理在PC2正、负轴上均有分布。
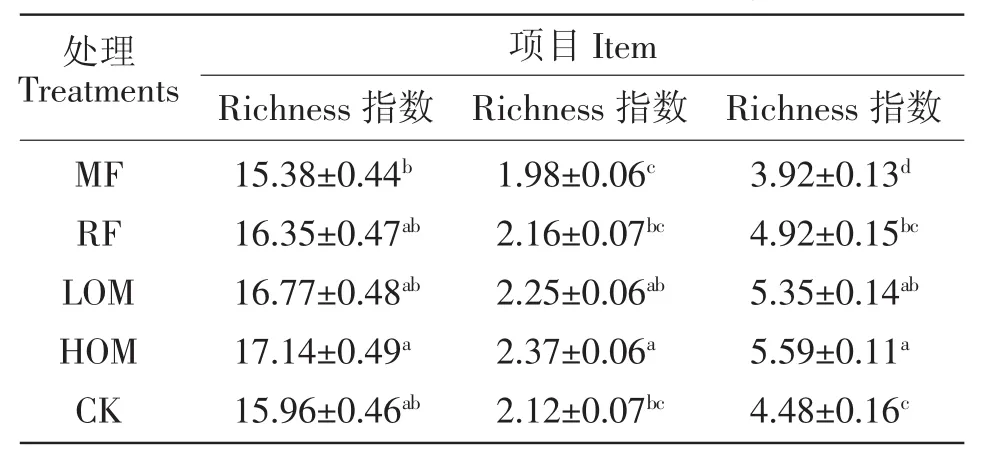
表1 大麦成熟期不同施肥处理根际土壤微生物群落的多样性指数值Table 1 Genetic diversity indices of rhizospheric soil microbial communities with different fertilizer treatments at barley maturity stage
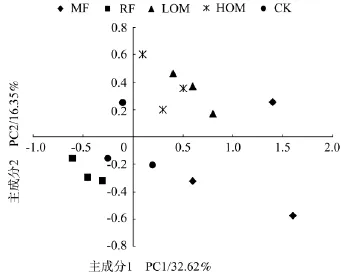
图2 大麦成熟期不同施肥处理根际土壤微生物碳源利用类型的主成分分析Figure 2 Principal components for carbon utilization of rhizospheric soil microbial communities in different fertilizer treatments at barley maturity stage
由于表2中可知,对PC1和PC2具有较高相关性的16个碳源分析结果表明氨基酸和糖类物质是影响各处理间差异的主要碳源。氨基酸类碳源在PC1所占的比例较大,而糖类碳源在PC2所占的比例较大;各施肥处理间出现差异的碳源主要是氨基酸类和糖类碳源。
本研究对不同施肥处理的前5种碳源进行分析,结果表明不同施肥处理对根际土壤微生物碳源利用的情况存在明显差异(表3)。各施肥处理根际土壤微生物利用的碳源主要是糖类、氨基酸类以及少量其他物质。
3 讨论与结论
施肥是影响土壤微生物多样性、土壤质量和可持续发展的重要农业措施之一[7-8]。同时,微生物对碳源利用程度的高低可作为土壤微生物活性有效指标[3]。在本研究中,大麦根际土壤微生物经过36 h延滞期适应Biolog微平板提供的环境,然后对数生长至108 h,之后生长减缓步入稳定期(图1),因此本研究是利用108 h培养后的AWCD值进行分析。前人研究表明,施用厩肥有利于维持根际土壤微生物的多样性及活性[20]。侯晓杰等研究认为单施化肥降低了土壤微生物对碳源利用率[7]。本研究结果表明,不同施肥处理对根际土壤微生物群落碳源利用能力具有明显的影响。与无肥对照相比,施用有机肥与化肥配合及化肥处理均增加了稻田根际土壤微生物对碳源的利用程度,而秸秆还田处理则降低了根际土壤微生物对碳源的利用程度。有机肥与化肥配施(60%和30%有机肥处理)以及施用化肥处理土壤AWCD均明显高于秸秆还田和无肥处理,表明有机肥与化肥配施以及化肥措施均有利于维持根际土壤微生物的碳源利用能力,提高了土壤碳的利用能力,这可能是长期选择有机无机肥配施的措施后具有较好的土壤培肥效果[11],能为土壤微生物提供较多的能源和养分,促进了土壤微生物的活性和多样性。施用化肥措施在一定程度上也提高了根际土壤微生物对碳源利用率,这可能是长期施用化肥条件下在经过大麦一个生长周期后,由于大麦生育期采用旱作管理方式改善了土壤通气性状等理化特性,有利于增强根际土壤微生物利用碳源的特殊优势种群活性,从而提高碳源的利用率降;同时,这也是本研究的土壤类型(河沙泥水稻土)、土壤理化因素、作物种类(大麦)与前人研究有所不同差异所导致的结果[7]。而秸秆还田处理土壤AWCD均低于无肥处理,其原因可能是秸秆还田后无机N、P相对缺乏且C/N比高,秸秆中养分释放缓慢,微生物分解慢,从而降低了土壤微生物活性和多样性[21];另外,秸秆还田处理可能改变了根际土壤微生物的优势种群,造成了所测试碳源利用率的降低。

表2 与PC1和PC2相关显著的主要培养基Table 2 Correlation coefficients between main substrates and PC1 or PC2
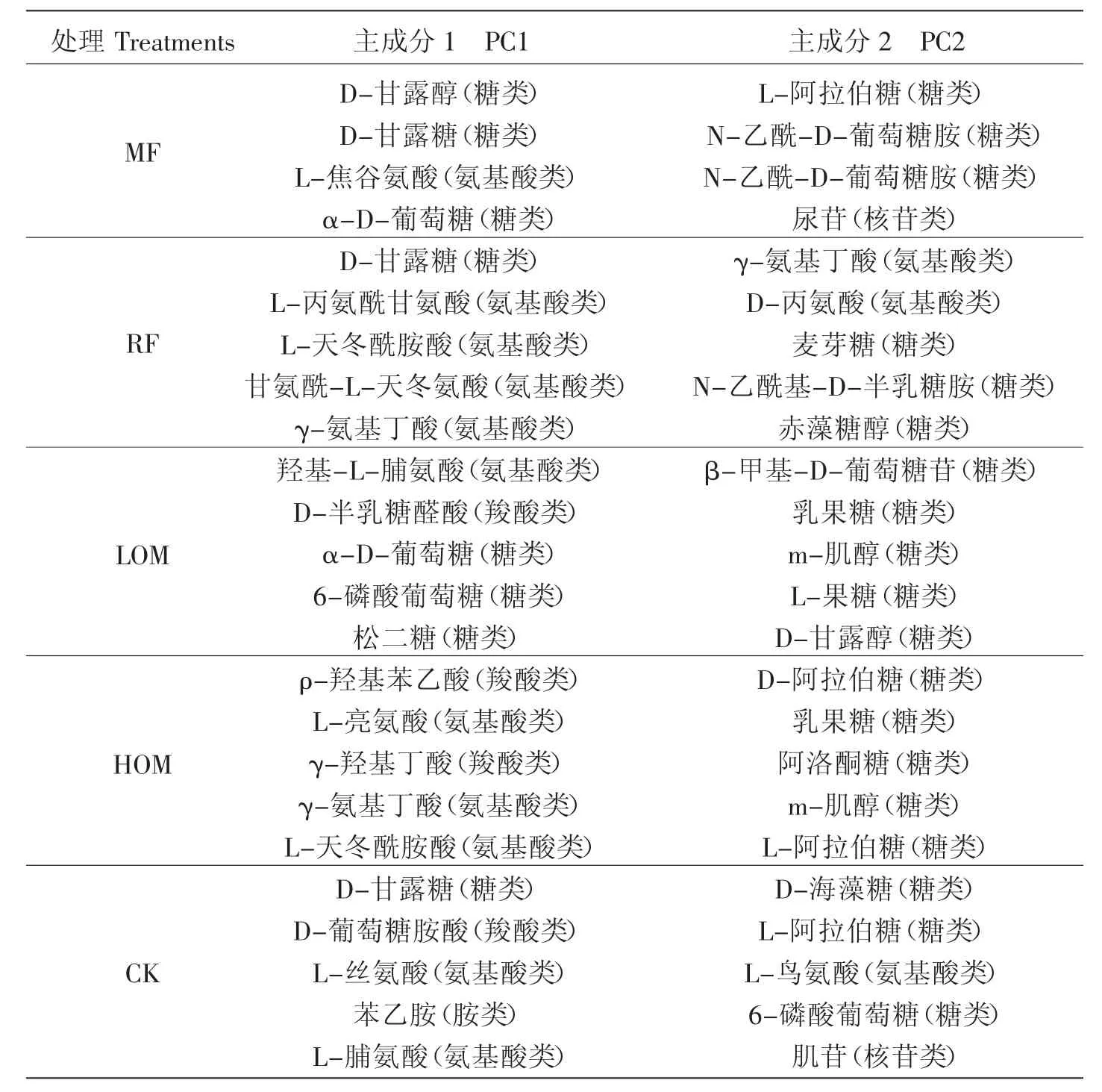
表3 各处理利用的主要碳源Table 3 Main carbon substrates utilized by rhizospheric soil microbial communities for different fertilizer treatments
大麦成熟期土壤微生物群落物种的丰富度和均匀度(Richness、Shannon和McIntosh指数)分析结果表明,不同施肥处理间根际土壤微生物物种的数量、各个物种均匀度均存在明显的差异,有机肥与化肥配施处理(60%和30%有机肥)均能提高根际土壤微生物群落物种数量、物种丰富度和群落均匀度,而单施化肥处理降低了根际土壤微生物群落物种数量、物种丰富度和群落均匀度;长期有机无机肥配施处理均有利于维持稻田根际土壤微生物群落多样性。其中,有机肥与化肥配合施用处理增加了根际土壤微生物群落物种数量、各物种的丰富度和均匀度,这可能是由于有机肥的C/N有利于根际土壤微生物的生长;且有机肥为微生物提供了较多的能源与养分,促进了根际土壤微生物大量繁殖[22],加快微生物的新陈代谢。与无肥和化肥处理相比,秸秆还田处理也促进了微生物物种数量、各物种的丰富度和均匀度,与罗希茜等[10]研究结果有差异,其原因可能是由于在长期秸秆还田条件下,大麦生育期采用旱作的管理方式改善了土壤通气性状等理化特性,且秸秆还田能为土壤微生物生物提供有效碳源,有利于促进微生物种群生长代谢,从而增加了根际土壤微生物群落物种数量。施用化肥处理降低了根际土壤微生物物种的数量、各个物种的丰富度和均匀度,这可能是由于长期单独施用化肥导致土壤所提供的生物有效碳源较少,减少了土壤微生物活性,从而降低了根际土壤微生物群落多样性。有机肥与化肥配施处理(60%和30%有机肥、秸秆还田)均有利于提高根际土壤微生物活性,增强碳源利用能力,其群落多样性也得到提高,充分利用了土壤中的有机质。秸秆还田处理虽然提高了根际微生物群落的物种丰富度,但降低了根际微生物利用碳源的能力,这可能与其土壤碳、氮利用下降原因有关。
J.L.Garland等研究结果表明,不同处理土壤样品在PC空间不同PC轴坐标的差异与对聚集在该PC轴上碳源利用能力关系密切[3]。也就是说,各样本在PC空间不同PC轴坐标的差异联系差与对聚集在该PC轴上碳源的利用能力。在本研究的主成分分析中,共提取了9个主成分,但只对前2个主成分进行了分析。分析结果表明,不同施肥处理根际土壤微生物利用的碳源主要是氨基酸类和糖类,且各施肥处理间稻田根际土壤微生物群落在碳源利用上存在明显的差异(图2),长期施肥增加了各处理间的变异程度。张继宏等研究认为,施用猪粪能显著提高土壤氨基酸和单糖的数量,土壤氨基酸和单糖提高的数量均与猪粪施用量的高低关系密切[23]。在本研究中氨基酸类和糖类物质是稻田根际土壤微生物利用的主要碳源(表2),但在各个施肥处理间均存在明显差异(表3),可作为区分各施肥处理对根际土壤微生物影响的依据[24-25]。本研究结果表明,与单施化肥处理相比,长期有机无机肥配施处理(60%、30%有机肥和秸秆还田)均显著提高了根际土壤氨基酸和单糖的数量,这可能是因为长期施用有机肥和秸秆还田使微生物可以利用的碳源趋于稳定,促进偏好氨基酸类和单糖糖类物质为碳源微生物群落的发育,从而增加了有机无机肥配施处理稻田土壤中利用氨基酸类和单糖糖类物质根际土壤微生物群落,这与张继宏等[23]研究结果相一致。
[1]INSAM H,HUTCHINSON T C,REBER H H.Effects of heavy metal stress on the metabolic quotient of the soil microflora[J].Soil Biology and Biochemistry,1996,28(4):691-694.
[2]ZAK J C,WILLIG M R,Moorhead D L,et al.Functional diversity of microbial communities:a quantitative approach[J].Soil Biology and Biochemistry,1994,26(9):1101-1108.
[3]GARLAND J L,MILLSA L.Classification and characterization of heterotrophic microbial communities on basis of patters of community-level sole-carbon source utilization[J].Applied Environment Microbiology,1991,57(8):2351-2359.
[4]ZHONG W H,GU T,WANG W,et al.The effects of mineral fertilizer and organic manure on soil microbial community and diversity[J].Plant and Soil,2010,326(1/2):511-522.
[5]谭周进,周卫军,张杨珠,等.不同施肥制度对稻田土壤微生物的影响研究[J].植物营养与肥料学报,2007,13(3):430-435.
[6]HU J L,LIN X G,WANG J H,et al.Microbial functional diversity,metabolic quotient,and invertase activity of a sandy loam soil as affected by long-term application of organic amendment and mineral fertilizer[J].Journal of Soils and Sediments,2011,11(2):271-280.
[7]侯晓杰,汪景宽,李世朋.不同施肥处理与地膜覆盖对土壤微生物群落功能多样性的影响[J].生态学报,2007,27(2):655-661.
[8]徐万里,唐光木,葛春辉,等.长期施肥对新疆灰漠土土壤微生物群落结构与功能多样性的影响[J].生态学报,2015,35(2):468-477.
[9]LOVELL R D,JARVIS S C,BARDGETT R D.Soil microbial biomass and activity in long term grass land:effects of management change[J].Soil Biology and Biochemistry,1995,27(7):969-975.
[10]罗希茜,郝晓晖,陈涛,等.长期不同施肥对稻田土壤微生物群落功能多样性的影响[J].生态学报,2009,29(2):740-748.
[11]唐海明,肖小平,李微艳,等.长期施肥对双季稻田根际土壤微生物群落功能多样性的影响[J].生态环境学报,2016,25(3):402-408.
[12]程池,杨梅,李金霞,等.Biolog微生物自动分析系统-细菌鉴定操作规程的研究[J].食品与发酵工业,2006,32(5):50-54.
[13]SCHUTTER M,DICK R.Shift in substrate utilization potential and structure of soil microbial communities in response to carbon substrate[sJ].Soil Biology and Biochemistry,2001,33(11):1481-1491.
[14]JEFFREY S B,DONALD D K.Microbial diversity in the rhizosphere of corn grown under conventional and low-input systems[J].Applied Soil Ecology,1996,5(1):21-27.
[15]KELA P W,JASON A G,MATTHIAS G,et al.Data transformations in the analysis of community-level substrate utilization data from microplates[J].Journal of Microbiological Methods,2007,69(3):461-469.
[16]GROVE J A,KAUTOLA H,JAVADPOUR S,et al.Assessment of changes in the microorganism community in a biofilter[J].Biochemical Engineering Journal,2004,18(2):111-114.
[17]MIN L,XIAO M X.Effect of heavy metals on substrate utilization pattern,biomass and activity of microbial communities in a reclaimed mining wasteland[J].Ecotoxicology and Environmental Safety,2007,66(2):217-223.
[18]WOLFGANG H,MICHAEL H,MARKUS K,et al.Application of multivariate analysis of variance and related techniques in soil studies with substrate utilization tests[J].Journal of Microbiological Methods,1997,30(1):81-89.
[19]HAO L R,FAN Y,HAO Z O,et al.SPSS Practical Statistics Analysis[M].Beijing:China Water Power Press,2003.
[20]朱海平,姚槐应,张勇勇,等.不同培肥管理措施对土壤微生物生态特征的影响[J].土壤通报,2003,34(2):140-142.
[21]李新爱,童成立,蒋平,等.长期不同施肥对稻田土壤有机质和全氮的影响[J].土壤,2006,38(3):298-303.
[22]TANG H M,XU Y L,SUN J M,et al.Soil enzyme activities and soil microbe population as influenced by long-term fertilizer management under an intensive cropping system[J].Journal of Pure&Applied Microbiology,2014,8(2):15-23.
[23]张继宏,颜丽,窦森.农业持续发展的土壤培肥研究[M].沈阳:东北大学出版社,1995:25-40.
[24]EKKEHARD G,HOLGER H,BERT E,et al.Statistical comparisons of community catabolic profiles[J].Journal of Microbiological Methods,1997,30(1):71-80.
[25]GABRIELA D,MONICA A,HUGO C,et al.Effect of tillage and N fertilization on microbial physiological profile of soils cultivated with whea[tJ].Soil and Tillage Research,2006,91(1/2):236-243.
Effects of Different Long-term Fertilization Treatments on Rhizospheric Soil Microbial Community Functional Diversity of Paddy Field in Barley-double Cropping Rice System
XU Yi-lan1,TANG Hai-ming2*,CHENG Ai-wu3,LI Yi-feng1,LI Yong3,HE Wei3,WANG Yue-ping3,HU Sai-jing3
(1.College of Biological and Electromechanical Polytechnic,Changsha 410127,China;2.Hu'nan Soil and Fertilizer Institute,Changsha 410125,China;3.Ningxiang Agricultural Bureau,Ningxiang 410600,Hunan,China)
【Objective】Microbial community functional diversity is a sensitive indicator of soil quality.There has a closely relationship between the fertilizer practices and the microbial community functional diversity of paddy fields.Therefore,our objective was to explore the effects of different fertilizer practices on rhizosphere soil microbial community functional diversity in a double-cropping rice system.【Method】There has a long-term experiment was established in 1986,and five different fertilizer treatments were applied:(1)no fertilizer input(CK);(2)mineral fertilizer alone(MF);(3)rice residue plus mineral fertilizer(RF);(4)30%organic matter and 70%mineral fertilizer(LOM);(5)60%organic matter and 40%mineral fertilizer(HOM).We analyzed the rhizosphere soil microbial community functional diversity of the fields at barley mature stages with the above five treatments using Biolog system.【Results】The results showed that the average well color development(AWCD)were increased with MF,LOM and HOM treatments,while the AWCD with RF treatment were lower than that of CK.In addition,the indices of Richness,Shannon and McIntosh under different fertilization treatments were ordered as follows:HOM>LOM>RF>CK>MF at mature stages of barley.PCA analysis indicated that there were different carbon-substrate-utilization patterns among different fertilizer treatments.Amino acids and carbohydrates were the main carbon resources utilized by rhizosphere soil microbes.Meanwhile,there were significant differences in carbon-substrateutilization patterns among different fertilizer treatments.【Conclusion】The combined application of chemical fertilizer with organic manure could significantly increase the rhizosphere soil microbial community functional diversity at mature stages of barley.
different fertilization;double-cropping rice system;barley rhizospheric soil;microbial community;functional diversity
S154.36 文献标志码:A 文章编号:1000-2650(2017)02-0144-07
10.16036/j.issn.1000-2650.2017.02.002
2017-02-04
国家自然科学基金“双季稻田根际土壤微生物群落结构及其多样性对长期施肥措施的响应机制”(31571591);“不同施肥模式对大麦-双季稻田甲烷氧化菌多样性及活性影响的研究”(31201178)。
徐一兰,副教授,主要从事作物栽培和生理生化研究,E-mail:xiaoliyanzhi@163.com。*责任作者:唐海明,副研究员,硕士生导师,主要从事耕作生态与农作制研究,E-mail:tanghaiming66@163.com。
(本文审稿:段红平;责任编辑:刘诗航;英文编辑:刘诗航)
