非诺贝特对血管钙化的影响及机制研究△
2018-01-06张旭升曾宪钦黄战军朱平先蔡博治
张旭升,曾宪钦,黄战军,朱平先,蔡博治,张 昕
(1.深圳市龙岗区人民医院,广东深圳518172;2.汕头大学医学院第一附属医院分子心脏病学实验室,广东汕头515045)
·实验研究·
非诺贝特对血管钙化的影响及机制研究△
张旭升1,曾宪钦1,黄战军1,朱平先1,蔡博治2,张 昕2
(1.深圳市龙岗区人民医院,广东深圳518172;2.汕头大学医学院第一附属医院分子心脏病学实验室,广东汕头515045)
目的在大鼠血管钙化模型上,探讨过氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptor α,PPARα)激动剂非诺贝特对血管钙化的影响及其可能的作用机制。方法实验动物按随机数字表法分正常组、钙化组及钙化+非诺贝特组,每组10只。钙化组采用维生素D3和尼古丁诱导大鼠血管钙化模型,钙化+非诺贝特组于造模后第2天开始,非诺贝特灌胃[30 mg/(kg·d)]。采用Von Kossa染色检测血管钙化程度,采用钙离子测试盒、碱性磷酸酶(alkaline phosphatase,ALP)试剂盒测定大鼠主动脉钙浓度和ALP活性,采用Beckman Coulter AU5800仪器检测血清三酰甘油(triacylglycerol,TG)浓度,采用放射免疫法检测大鼠血清单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)浓度,采用免疫组织化学法检测主动脉MCP-1受体表达。结果Von Kossa染色可见血管钙化模型大鼠主动脉有大量黑色颗粒沉淀,钙化组血管钙浓度、ALP活性高于正常组,差异有统计学意义(P<0.01);同时,与正常组比较,钙化组血清MCP-1浓度和主动脉组织MCP-1受体表达明显上调(P<0.01)。用非诺贝特干预后,血管钙化程度减轻(P<0.01),同时血清MCP-1及其受体的表达下调,与钙化组比较差异有统计学意义(P<0.01)。3组动物血清TG浓度比较,差异无统计学意义(P>0.05)。结论PPARα激动剂非诺贝特可抑制血管钙化,可能通过下调MCP-1表达和ALP活性抑制血管钙化的发生、发展过程。
过氧化物酶体增殖物激活受体α;非诺贝特;血管钙化;单核细胞趋化蛋白-1
血管钙化是动脉粥样硬化、糖尿病、原发性高血压(高血压)及慢性肾病等多种疾病的病理生理基础,是动脉粥样硬化的必然特征之一,并且是导致缺血性心血管事件发生及死亡的重要危险因子,它与生理性骨质形成类似,是主动的、可调节的及复杂的过程[1-2],但具体机制未完全阐明。过氧化物酶体增殖物激活受体α(peroxisome proliferator activated receptor α,PPARα)在心血管组织中广泛表达,并参与动脉粥样硬化[3]等多种心血管疾病的发病过程,但对血管钙化的作用尚不清楚。为此,本实验在大鼠血管钙化模型上,观察PPARα激动剂非诺贝特对血管钙化的影响,并初步探讨其在血管钙化中的可能机制。
1 材料和方法
1.1 实验动物及药品
8周龄雄性SD大鼠由北京维通利华实验动物技术有限公司提供;非诺贝特由法国利博福尼制药公司生产(规格每粒胶囊200 mg,注册证号:H20140369);维生素D3购自Sigma公司,尼古丁购自Merck公司;碱性磷酸酶(alkaline phosphatase,ALP)试剂盒、钙离子试剂盒购自南京建成;Beckman Coulter AU5800购自美国(汕头大学医学院第一附属医院检验科提供),单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)试剂盒购自北京华英,MCP-1受体一抗购自北京博奥森,二抗即用型二步法试剂盒购自北京中杉金桥,二氨基联苯胺(DAB)显色试剂盒购自武汉博士德;其余为进口或国产分析纯试剂。
1.2 血管钙化动物模型制备
雄性SD大鼠按随机数字表法分3组,每组10只。正常对照组大鼠予等量0.9%氯化钠溶液肌肉注射和单纯花生油灌胃;钙化组大鼠首日予维生素D3(300 000 U/Kg)肌肉注射,尼古丁灌胃(25 mg/kg),一天2次;钙化+非诺贝特组的模型制作同钙化组,第2天开始予非诺贝特胃灌[30 mg/(kg·d)]。3组动物常规饲养4周后取材,2%戊巴比妥钠腹腔注射麻醉,开胸穿刺心脏取血,置入含有促凝剂的试管中,静置约10 min,4℃离心分离血清,-80℃保存。摘取胸主动脉全长,用冰磷酸盐缓冲液(PBS)冲洗后,部分石蜡包埋用于染色,其余锡纸包裹置于-80℃保存。
1.3 主动脉组织Von Kossa染色
取大鼠胸主动脉段,采用4%多聚甲醛固定,然后用石蜡包埋并联系切片制作约4 μm厚切片。常规脱蜡、脱水,滴加1%硝酸银溶液后,在紫外线下照射30 min,浸入5%硫代硫酸钠溶液1 min,用0.25%碱性品红返染。经脱水、透明、封片,在光镜下观察钙盐沉积情况。
1.4 主动脉组织碱性磷酸酶活性及钙浓度测定
将大鼠主动脉组织匀浆后,取上清液用考马斯亮蓝法进行蛋白定量。然后分别按照ALP测定试剂盒(磷酸苯二钠法)及钙测试盒(甲基百里香酚蓝比色法)说明书测定上清液ALP活性及钙浓度。
1.5 血清单核细胞趋化蛋白- 1和三酰甘油浓度的测定
取血清200 μL,分别送北京华英生物研究所和汕头大学医学院第一附属医院检验科检测,采用放射免疫法测定血清MCP-1浓度,采用Beckman Coulter AU5800生化仪测定血清三酰甘油(triacylglycerol,TG)浓度,具体步骤按说明书操作。
1.6 免疫组化法测定主动脉组织单核细胞趋化蛋白- 1受体的表达
取大鼠胸主动脉约4 μm厚切片,常规脱腊至水,然后热抗原修复,用5%牛血清白蛋白(BSA)封闭非特异性抗原,滴加一抗过夜,再滴加二抗,二氨基联苯胺显色后用苏木素复染,盐酸酒精分化、脱水、透明,最后中性树胶封片,具体步骤按说明书进行。
1.7 统计学分析
采用Graph Pad Prism 4统计软件进行分析。计量资料以()表示,多组间比较采用单因素方差分析法,两组间比较采用q检查。以P<0.05为差异有统计学意义。
2 结果
2.1 3组血管钙化比较
采用维生素D3和尼古丁联合诱导后可建立稳定、典型的大鼠血管钙化模型。Von Kossa染色可观察到主动脉中膜弹性纤维间大量黑色颗粒沉积,表明大量钙盐沉积、典型血管钙化形成,用非诺贝特干预后,血管钙化程度有所减轻,见图1。

图1 大鼠主动脉病理图像(Von Kossa染色,黑色为钙盐沉积;×100;A为正常组,B为钙化组,C为钙化+非诺贝特组)
2.2 3组主动脉组织钙浓度、ALP活性和血清MCP- 1浓度比较
钙化组大鼠主动脉组织钙浓度和ALP活性明显高于正常组,同时,血清MCP-1浓度明显升高,差异有统计学意义(P<0.05);用非诺贝特干预后,钙浓度和ALP活性有所下降,血清MCP-1浓度亦同步减少;而3组血清TG浓度比较,差异无统计学意义(P<0.05),详见表1。
表13 组主动脉组织钙浓度、ALP活性和血清MCP-1、TG浓度比较 [n=10,±s]

表13 组主动脉组织钙浓度、ALP活性和血清MCP-1、TG浓度比较 [n=10,±s]
注:与正常组比较,**P<0.01;与钙化组比较,1)**P<0.01
组别正常组钙化组钙化+非诺贝特组钙(mmol/g蛋白)0.26±0.05 0.45±0.04**0.34±0.03**,1)**ALP(U/g蛋白)108.26±15.95 196.90±28.61**141.34±13.321)**MCP-1(ng/L)48.49±7.95 128.63±12.33**65.19±9.551)**TG(mmol/L)0.95±0.15 0.99±0.13 0.90±0.20
2.3 3组主动脉组织单核细胞趋化蛋白- 1受体表达比较
钙化组主动脉组织MCP-1受体表达较正常组明显上调,用非诺贝特干预后,主动脉组织MCP-1受体的表达明显下调,见图2。
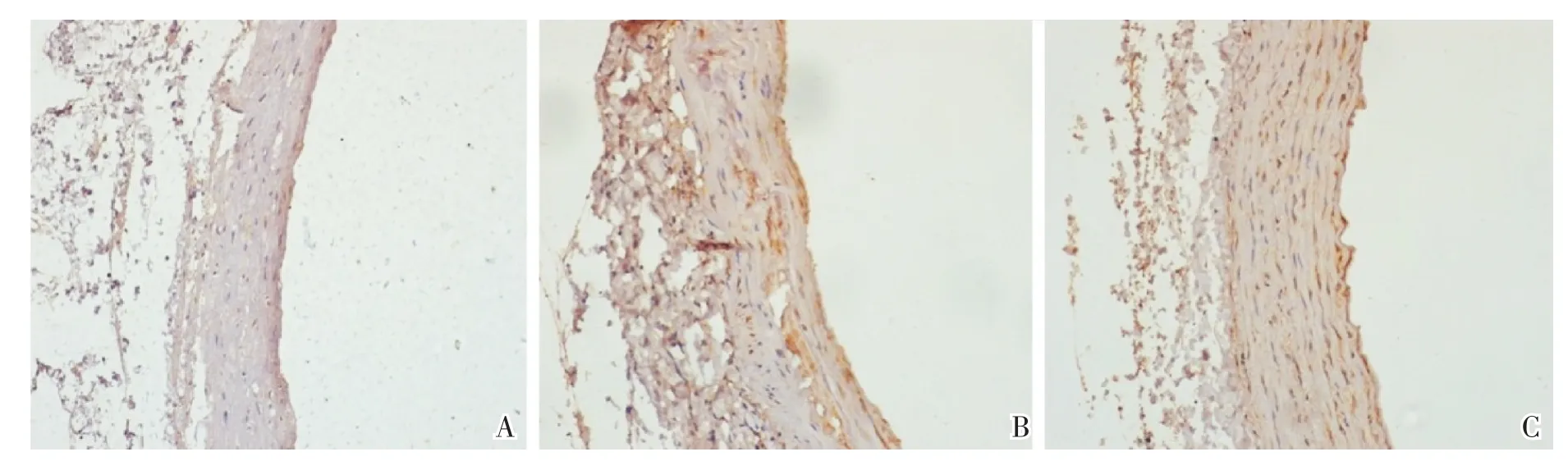
图2 大鼠血管病理图像(MCP-1受体免疫组化染色,棕黄色为阳性表达;×200;A为正常组,B为钙化组,C为钙化+非诺贝特组)
3 讨论
研究表明,血管钙化是主动的、可调节的过程,与骨组织的骨化过程相似,包括基质小泡的出现、ALP活性的增加,多种骨相关蛋白和促骨形成活性因子的分泌等,最重要的特征是血管平滑肌细胞由收缩型表型转变为成骨细胞表型。随着研究深入,发现多条信号通道涉及血管钙化包括转化生长因子β(TGF-β)/骨形态发生蛋白(BMP)通路和丝裂原活化蛋白激酶(MAPK)通路等[4-5],并且血管钙化的发生、发展受血管钙化促进因子与血管钙化抑制因子的相互作用调节。本课题组亦发现尾加压素Ⅱ、醛固酮和部分炎症因子等可促进血管钙化的发展[2,6-7],并且血管钙化促进因子之间不仅可通过协同作用加重血管钙化,还可通过下调血管钙化抑制因子如促黑激素(intermedin)[8]的表达,从而加速血管钙化的进展。因此,促血管钙化因子和抑制血管钙化因子之间的作用及机制研究对于防治血管钙化是非常关键的,而PPARα在心血管组织中广泛表达,早期研究发现PPARα激动剂存在抗动脉粥样硬化作用[9],并且该作用独立于其抗脂代谢效应之外,但是否有抑制血管钙化的作用尚不清楚。
本实验结果发现,大剂量维生素D3联用尼古丁可建立典型的大鼠血管钙化模型,表现为主动脉组织钙浓度和ALP活性明显增高,并且通过Von Kossa染色亦可见动脉中膜大量钙盐沉积。PPARα激动剂非诺贝特是一种临床上常用于治疗高TG血症的第三代苯氧芳酸类调脂药物,钙化组大鼠给予非诺贝特干预后,血管钙化的程度有所减轻,而3组动物血清TG浓度比较,差异无统计学意义(P>0.05),提示血管钙化模型中内源性TG与血管钙化的进程未见相关性,说明非诺贝特抑制血管钙化的作用机制不是因为其主要的药理作用——改善脂代谢,而是与下调ALP活性有关。同时,钙化组血清MCP-1浓度明显高于正常组,并且其在主动脉组织中相应的受体表达亦显著同步上调,与文献[7]报道一致。MCP-1是一种细胞趋化因子,与相应受体结合后,通过丝裂原活化蛋白激酶和磷脂酰肌醇3-激酶(PI3K)-蛋白激酶B(AKT)等信号转导通路作用,可诱导并激活单核细胞和巨噬细胞等炎症细胞,导致细胞迁移、聚集,并促进白细胞介素、肿瘤坏死因子等炎症反应介质的分泌,是构成血管炎症发生、发展的关键因子[10],而炎症反应贯穿于血管损伤、重构与钙化发病始终。PPARα是一种可被脂肪酸激活的具有转录因子功能的核受体蛋白,它在炎症过程中起着重要的作用,研究发现PPARα激动剂如WY-14643等可通过核因子κB(NF-κB)通路抑制炎症的进展[11],临床观察亦发现PPARα激动剂明显降低糖尿病伴冠状动脉粥样硬化性心脏病(冠心病)患者血浆炎症因子MCP-1和C反应蛋白浓度[12],本实验使用PPARα激动剂非诺贝特干预后,大鼠血清MCP-1浓度及主动脉组织相应受体的表达有所减少,提示PPARα通路可能通过抑制炎症因子的表达从而抑制血管钙化。
本实验发现PPARα激动剂非诺贝特可抑制血管钙化,且该作用不依赖其抗脂代谢,相关机制可能与下调ALP活性及MCP-1表达有关,涉及相关的细胞内信号转导通路尚需进一步研究证实,这将为血管钙化的机制研究及防治提供新的思路和作用靶点。
[1]SAGE A P,TINTUT Y,DEMER L L.Regulatory mechanisms in vascular calcification[J].Nature Rev Cardiol,2010,7(9):528-536.
[2]张勇刚,张旭升,魏睿宏,等.大鼠钙化血管尾加压素Ⅱ及其受体上调[J].中国动脉硬化杂志,2010,18(7):505-509.
[3]SANTOS M H,HIGUCHI MDE L,TUCCI P J,et al.Previous exercise training increases levels of PPAR-α in long-term postmyocardial infarction in rats,which is correlated with better inflammatory response[J].Clinics,2016,71(3):163-168.
[4]LIU D D,ZHANG J C,ZHANG Q,et al.TGF-β/BMP signaling pathway is involved in cerium-promoted osteogenic differentiation of mesenchymal stem cells[J].J Cell Biochem,2013,114(5):1105-1114.
[5]BUROTTO M,CHIOU V L,LEE J M,et al.The MAPK pathway across different malignancies:A new perspective[J].Cancer,2014,120(22):3446-3456.
[6]黄战军,张旭升,周小欧,等.大鼠血管钙化模型主动脉醛固酮及其受体的表达[J].中华高血管杂志,2012,20(11):1035-1038.
[7]张旭升,周小欧,黄战军,等.大鼠血管钙化模型炎症因子及其受体的表达[J].岭南心血管病杂志,2013,19(3):341-345.
[8]CAI Y,XU M J,TENG,et al.Intermedin inhibits vascular calcification by increasing the level of matrix gamma-carboxyglutamic acid protein[J].Cardiovasc Res,2010,85(4):864-873.
[9]AJITH T A,JAYAKUMAR T G.Peroxisome proliferator-activated receptors in cardiac energy metabolism and cardiovascular disease[J].Clin Exp Pharmacol Physiol,2016,43(7):649-658.
[10] LIN J,KAKKAR V,LU X.Impact of MCP-1 in atherosclerosis[J].Curr Pharm Des,2014,20(28):4580-4588.
[11] HUANG D,ZHAO Q,LIU H,et al.PPARα agonist WY-14643 inhibits LPS-induced inflammation in synovial fibroblasts via NF-κB pathway[J].J Mol Neurosci,2016,59(4):544-553.
[12] 韦金儒,唐泉.PPARα/γ激动剂对糖尿病伴冠心病患者血浆炎症因子的影响[J].岭南心血管病杂志,2012,18(3):239-245.
Effect and mechanism of fenofibrate on vascular calcification model rats
ZHANG Xu-sheng1,ZENG Xian-qin1,HUANG Zhan-jun1,ZHU Ping-xian1,CAI Bo-zhi2,ZHANG Xin2
(1.Longgang District People′s Hospital of Shenzhen,Shenzhen,Guangdong 518172,China;2.Molecular Cardiology Laboratory,The first Affiliated Hospital of Shantou University,Shantou,Guangdong 515045,China)
ObjectivesTo study the effect and possible mechanism of peroxisome proliferator activated receptor α(PPARα)agonist fenofibrate in rats with vascular calcification.MethodsMale SD rats were randomly divided into normal group,calcification group and calcification plus fenofibrate group(alln=10 per group).Vascular calcification was induced by vitamin D3 plus nicotine.The next day after calcification induction,rats in fenofibrate group were gavaged with fenofibrate[30 mg/(kg·d)]for four weeks.Vascular calcification was confirmed by Von Kossa staining.Calcium concentration and alkaline phosphatases(ALP)activity were detected by calcium assay kit and ALP detection kit respectively.Triglyceride(TG)concentration in serum was detected by Beckman Coulter AU5800.Monocyte chemoattractant protein-1(MCP-1)concentration in serum was determined by radioimmunoassay,and the expressions of corresponding receptors were determined by immunohistochemistry.ResultsVon Kossa staining showed that there were mass black granules deposited in aortic wall of the vascular calcified rats.Calcium concentration and ALP activity in calcified group significantly increased than those in control group(P<0.01 andP<0.01).Meanwhile,MCP-1 concentration in serum and expression of corresponding receptor in calcified group were significantly higher than those in control group(P<0.01).In addition,fenofibrate diet could reduce vascular calcium concentration,ALP activity and MCP-1 concentration.There were no significant differences in serum concentrations of TG among these groups(P>0.05).ConclusionsOurs results indicated that PPARα agonist(fenofibrate)significantly protects the aorta against calcification partly through reducing MCP-1 concentration and ALP activity.
peroxisome proliferator activated receptor α;fenofibrate;vascular calcification;monocyte chemoattractant protein-1
R332
A
1007-9688(2017)06-0764-04
10.3969/j.issn.1007-9688.2017.06.30
深圳市龙岗区科技基金资助项目(项目编号:201505143001025)。
张旭升(1980-),男,副主任医师,研究方向为心血管疾病发病机制。
黄战军,E-mail:CharlesHZJ@163.com
2017-01-03)
