miR-124 rs531564、miR-26A rs7372209和miR-126 rs4636297基因多态性与结直肠癌患者预后的相关性研究*
2018-01-05刘剑荣陈小林
刘剑荣,陈小林
(江西省萍乡市人民医院检验科 337055)
论著·临床研究
miR-124 rs531564、miR-26A rs7372209和miR-126 rs4636297基因多态性与结直肠癌患者预后的相关性研究*
刘剑荣,陈小林
(江西省萍乡市人民医院检验科 337055)
目的评估微RNA(miR)-124、miR-26A和miR-126基因单核苷酸多态性(SNP)对结直肠癌(CRC)患者预后的影响。方法以2011年7月至2013年12月该院收治的724例CRC住院患者为研究对象,利用PCR-连接酶检测反应(PCR-LDR)技术对患者外周血miR-124 rs531564、miR-26A rs7372209和miR-126 rs4636297进行SNPs位点基因型分析。患者的总生存时间(OS)和无复发生存率(PFS)采用 Kaplan-Meier法计算,单变量log-rank 法比较SNPs不同的基因型和单倍体型对OS和RFS的影响。结果携带miR-124 rs531564 CG基因型的CRC患者手术治疗后3年内OS较携带CC基因型的患者缩短,3年内因肿瘤死亡风险增加[HR2=1.450,95%CI(1.043~2.017),P=0.026];携带GG基因型的患者较携带CC型的患者3年内因肿瘤死亡风险亦增加[HR2=2.339,95%CI(1.171~4.674),P=0.024];在显性基因模型中,携带CG+GG基因型的患者较携带CC基因型的患者预后3年内OS明显下降[HR2=1.532,95%CI(1.119~2.096),P=0.008];隐性基因模型中,携带GG基因型与携带CC+CG基因型患者的OS无明显差异[HR2=1.975,95%CI(1.000~3.900),P=0.052];共显性模型中,以CC+CG基因型为参照,携带CG基因型的患者OS降低,患者3年内因肿瘤死亡风险增加[HR2=1.395,95%CI(1.007~1.931)]。未发现miR-26A rs7372209位点和miR-126 rs 4636297位点基因多态性与CRC术后3年内OS和RFS相关(P>0.05)。结论miR-124 rs531564位点基因多态性是CRC患者预后的独立影响因素。
miRNA-124;miRNA-26A;miRNA-126;多态性,单核苷酸;结直肠肿瘤;预后
虽然随着临床诊断和治疗水平的不断提高和更新,结直肠癌(colorectal cancer,CRC)的治疗疗效日益显著,但其发病率和病死率依然排在我国常见恶性肿瘤前列[1-2]。大量研究表明,CRC是环境因素与相关基因交互作用的结果。探索相关基因与CRC的关系,对揭示其分子发病机制、设计合理的治疗药物、筛选更为特异有效的临床诊断和预后判断指标,以及进一步提高CRC的治疗水平具有重要意义。随着微RNA(microRNA,miRNA)调控机制研究的深入,大量报道已证实miRNA的表达或生物学功能改变与CRC的发生、发展等病理生理过程密切相关,其中部分miRNA已被证实在CRC发生和发展过程中发挥癌基因或抑癌基因作用[3-4]。miRNA在CRC组织中的表达还呈现时序性、组织差异性、个体差异性和种族差异性等特点,但其在各种不同组织来源和不同进展期的肿瘤中又具有一定的共性,使其可作为肿瘤早期诊断、鉴别诊断、分型分级及个体化治疗的重要标志物[5-6]。CRC相关的miRNA及其靶基因中存在大量的遗传多态性位点,如单核苷酸多态性(single nucleotide polymorphisms,SNPs)位点能够影响miRNA和靶基因的转录和表达、二级空间结构及功能,是导致个体和种族间肿瘤发病风险和预后,以及药物治疗应答差异性的重要因素之一。因此,与CRC相关的miRNA和靶基因遗传多态性位点被认为是评估CRC发病风险、判断预后及预测药物应答的潜在分子遗传标志物。miRNA-124(miR-124)、miRNA-126(miR-126)和miRNA-26A(miR-26A)是近年来在CRC发生、发展过程中被发现发挥重要作用的分子。上述3个miRNA分子在CRC进展中都发挥抑癌基因作用,笔者推测其基因及靶基因遗传多态性位点与判断CRC预后及预测药物应答有关联。国内外尚未见miR-124、miR-126和miR-26A基因遗传多态性与CRC患者预后相关性的研究报道,本研究进一步分析以上3个miRNA基因位点多态性与CRC手术治疗预后的关系。
1 资料与方法
1.1一般资料 以2011年7月至2013年12月本院收治的CRC住院患者为研究对象。在所有被招募的CRC患者中,8例患者由于以下原因被排除:其中缺失明确的诊断3例,样品不足2例,失访1例,基因分型不明确2例。最后共纳入符合标准的CRC患者724例,均为经组织病理确诊的新发病例,并获得患者基因分型数据和完整的基本临床资料。患者年龄21~86岁,平均(53.5±9.9)岁;其中男415例,女309例。本研究进行的现场面对面调查均征得患者本人的知情同意。
1.2方法
1.2.1调查方法 采用回顾性调查结合前瞻性随访的研究方法,应用统一设计的调查问卷,通过查询患者住院病历和电话随访(直接联系患者或其家属)相结合的方式收集资料。电话随访截止日期为2013年12月30日。随访间隔:术后1年内为每3个月1次,1年后为每6个月1次。以3年内的总生存时间(overall survival,OS)和无复发生存率(recurrence-free survival,RFS)为最终评价指标,按月计算。OS为确诊之日起到死亡(死于原发肿瘤或并发症)或末次随访的时间;RFS为末次随访时间未出现死亡,确诊之日起到首次出现复发、转移或死亡的时间;复发转移均经影像学检查证实,出现复发灶、转移(近端和远端转移)为事件终点,至末次随访时间未出现复发或转移为截尾事件。
1.2.2基因组DNA提取 问卷调查结束后,经患者知情同意,取静脉血2 mL,乙二胺四乙酸二钾(EDTA-K2)抗凝,按照TIANamp血液基因组DNA提取试剂盒说明抽提外周血基因组,提取的DNA -80 ℃保存备用,采用PCR-连接酶检测反应(LDR)方法检测miR-124 rs531564、miR-26A rs7372209和miR-126 rs4636297多态性基因分型,引物见表1。
1.3统计学处理 采用SPSS17.0进行统计分析,计数资料以例数或百分率表示。生存率计算采用Kaplan-Meier法,根据不同的基因型和单倍体型计算OS和RFS,比较采用log-rank法。Cox比例风险模型用于多变量生存分析,并计算不同基因型和单倍体型的OS和RFS风险比(HR)及其95%置信区间(95%CI)。采用Logistic回归分析并调整年龄、性别、肿瘤分化程度、肿瘤部位、化疗结果。所有的统计检验均为双侧检验,以P<0.05为差异有统计学意义。
2 结 果
2.1患者基本临床特征 随访显示,724例患者中224例复发,210例死亡。患者基本临床资料见表2。
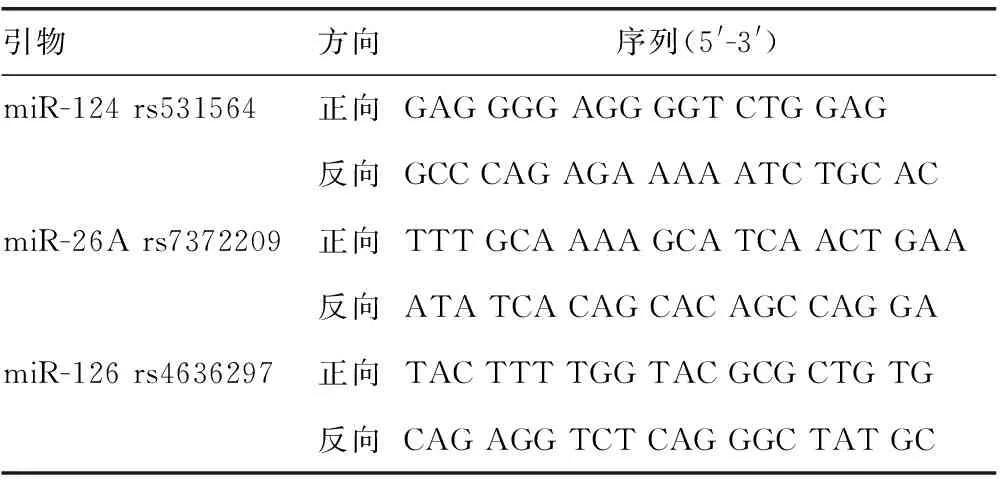
表1 引物序列
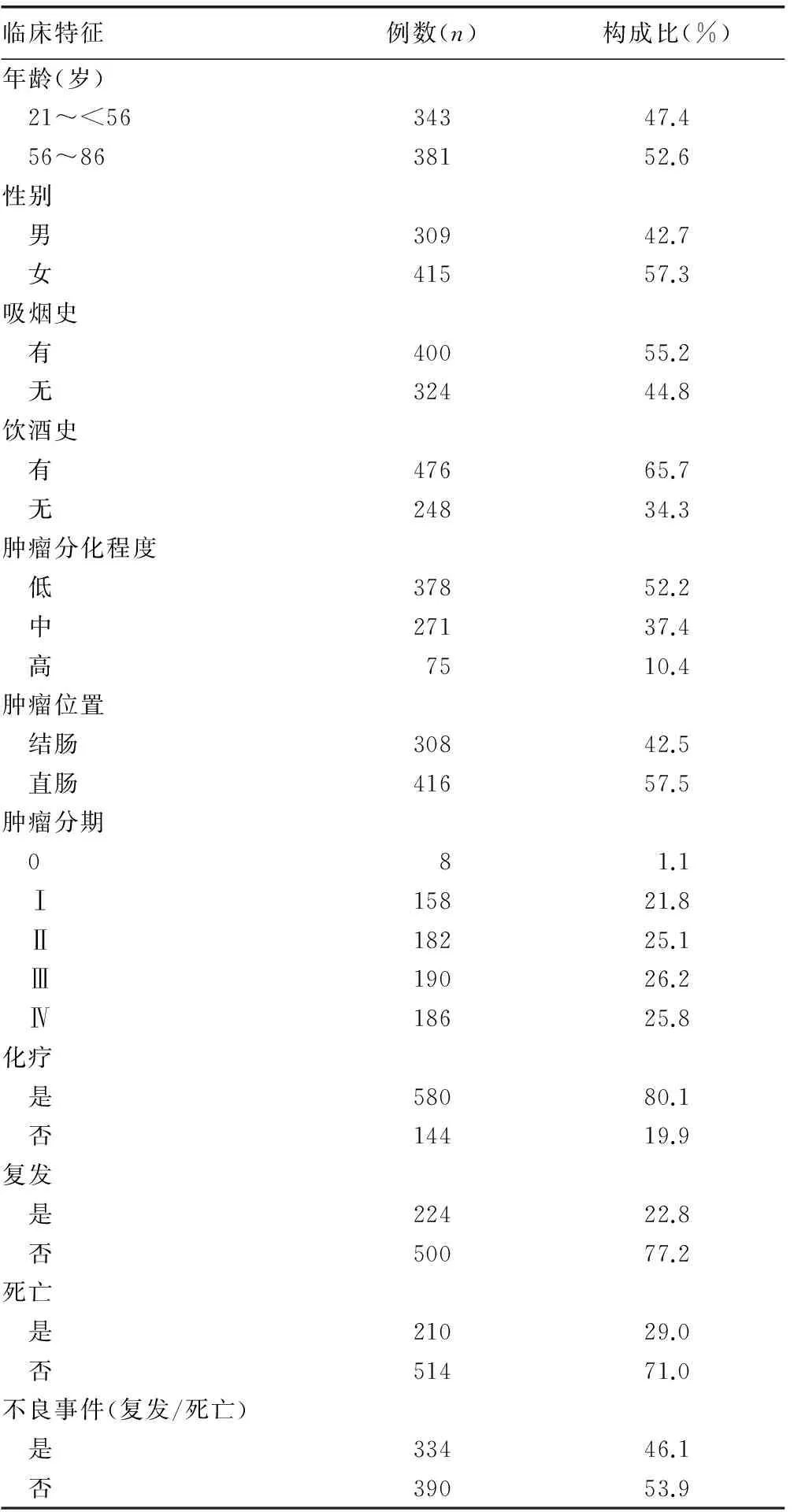
表2 患者基本临床资料(n=724)
2.2miRNA基因多态性与CRC患者术后3年内OS的相关性 在风险模型分析中,经过调整性别、年龄、吸烟史、饮酒史、肿瘤分化程度等因素后对miRNA位点进行3年内的OS分析,多因素Cox回归分析结果显示,携带miR-124 rs531564 CG基因型的CRC患者手术治疗后OS较携带CC基因型的患者下降,患者术后3年内由于肿瘤死亡的风险增加[HR2=1.450,95%CI(1.043~2.017),P=0.026];携带GG基因型的患者较携带CC基因型的患者死亡风险亦增加[HR2=2.339,95%CI(1.171~4.674),P=0.024],见表3。在显性基因模型中,携带miR-124 rs531564 CG+GG基因型的患者较携带CC基因型的患者OS明显下降,3年内由于肿瘤死亡的风险增加[HR2=1.532,95%CI(1.119~2.096),P=0.008];隐形基因模型中,携带GG基因型的患者与携带CC+CG基因型的患者术后3年内OS无明显差异[HR2=1.975,95%CI(1.000~3.900),P=0.052];共显性模型中,携带CG基因型的患者OS较携带CC+CG基因型的患者降低,患者3年内由于肿瘤死亡的风险增加[HR2=1.395,95%CI(1.007~1.931),P=0.045];未发现miR-26A rs7372209和miR-126 rs4636297基因多态性与CRC术后3年内OS的相关性,见表4。
2.3miRNA基因多态性与CRC患者术后3年内RFS的相关性 多因素COX回归分析结果显示,携带miR-124 rs531564 GG基因型的CRC患者手术治疗后RFS较携带CC基因型患者降低,患者3年内由于复发死亡的风险增加[HR2=2.920,95%CI(1.605~5.311),P<0.001];携带CG基因型的患者与携带CC基因型的患者由于复发死亡的风险无明显差异[HR2=1.343,95%CI((0.998~1.808),P=0.05),见表5。在显性基因模型中,携带miR-124 rs531564 CG+GG基因型的患者较携带CC基因型的患者RFS明显下降[HR2=1.470,95%CI(1.110~1.946),P=0.007];隐形基因模型中,携带GG基因型较携带CC+CG基因型患者由于复发死亡的风险增加[HR2=2.589,95%CI(1.438~4.660),P=0.001];共显性模型分析中,携带CG基因型的患者由于复发死亡的风险与携带CC+CG基因型的患者比较无明显差异[(HR2=1.279,95%CI(0.954~1.715),P=0.098];未发现miR-26A rs7372209和miR-126 rs4636297基因多态性与CRC患者RFS的相关性,见表6。
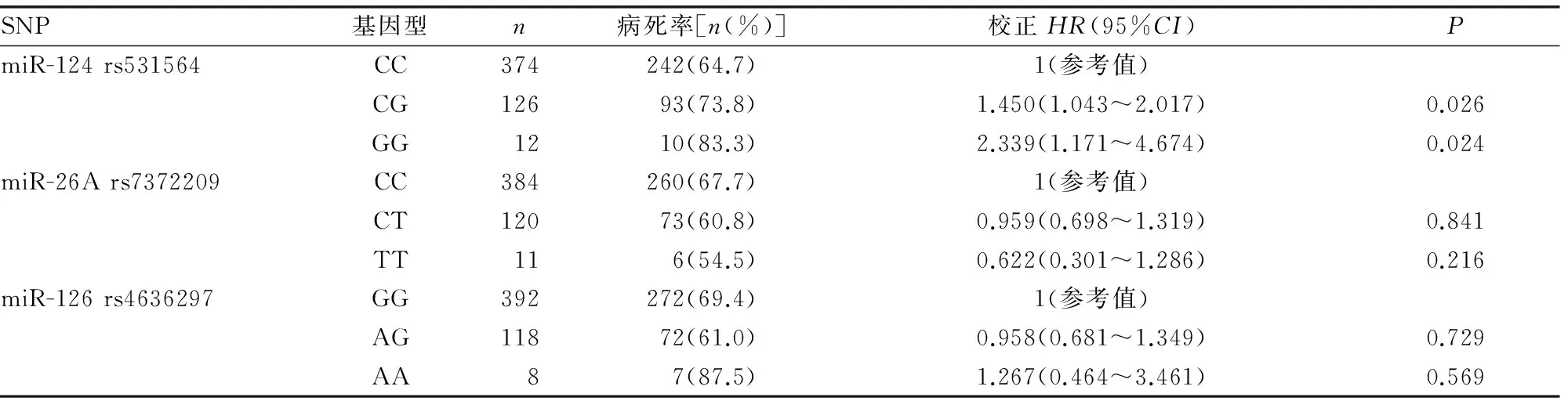
表3 3个miRNA不同基因型基因多态性与CRC患者术后OS的相关性
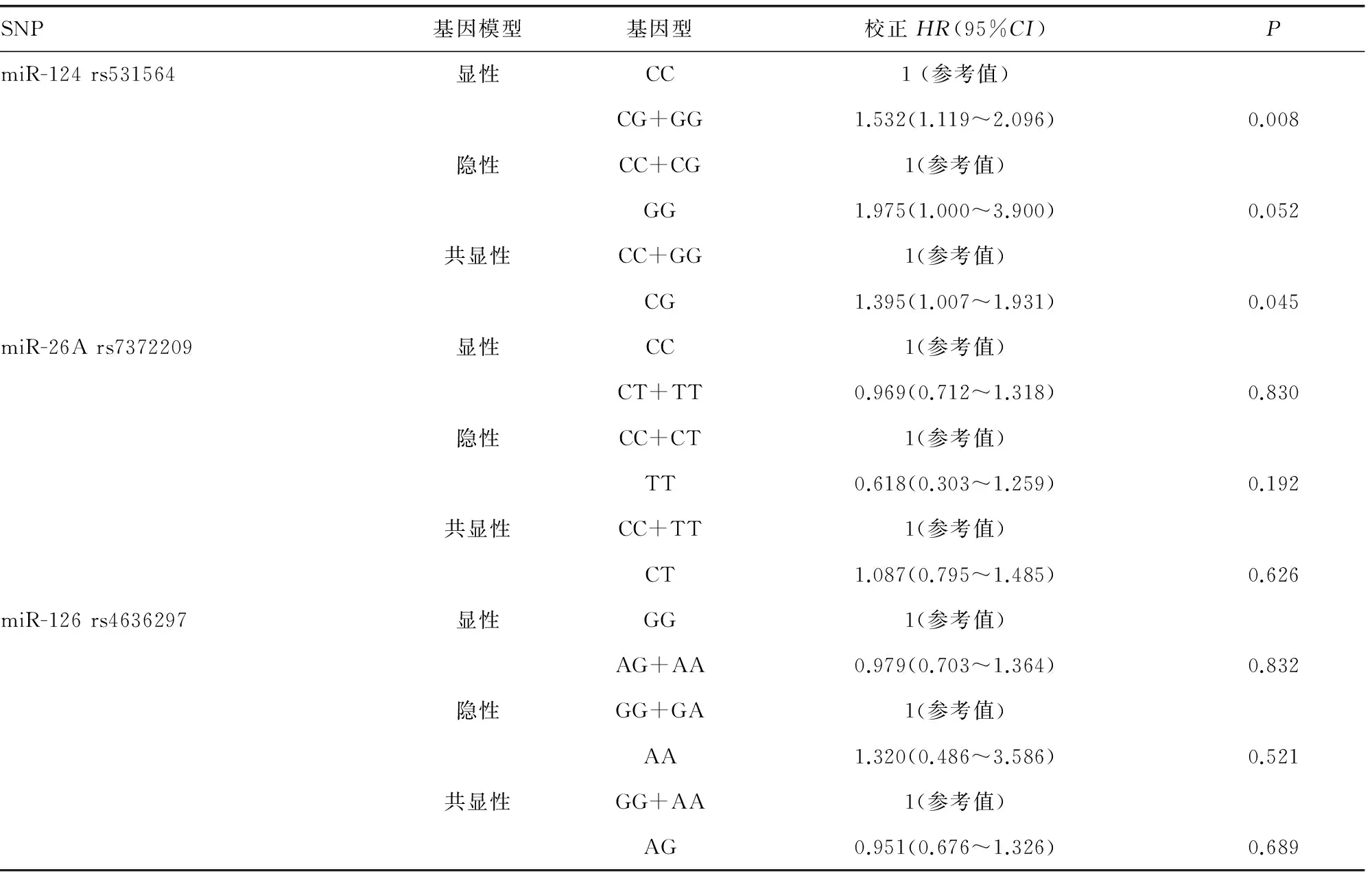
表4 3个miRNA各基因模型中不同基因型与CRC患者术后OS的相关性
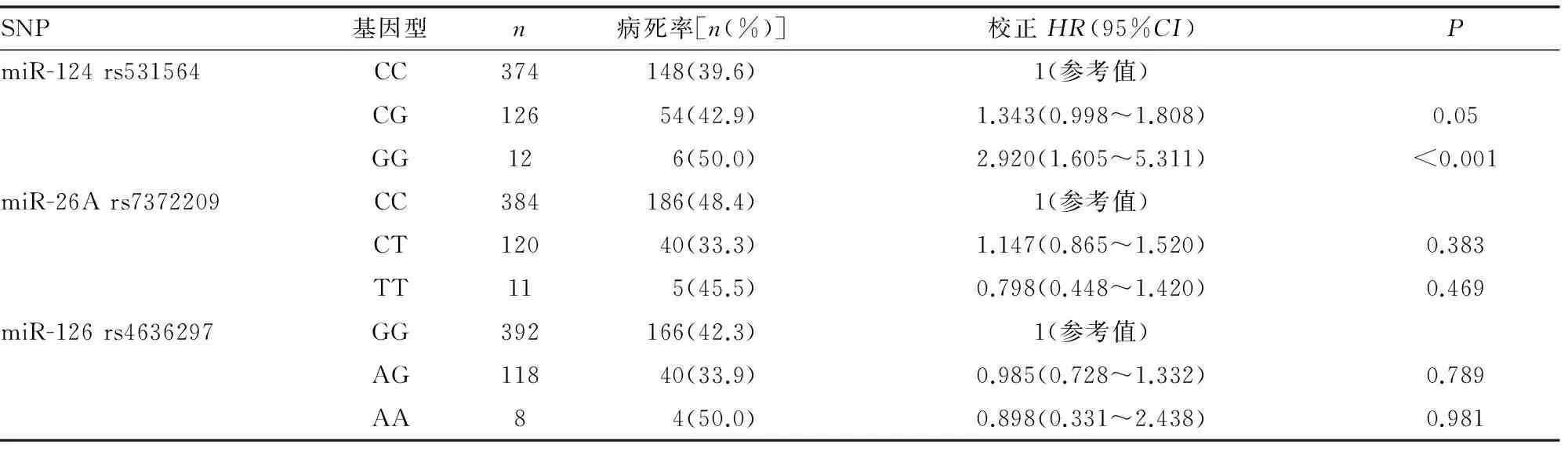
表5 3个miRNA不同基因型基因多态性与CRC患者术后RFS的相关性
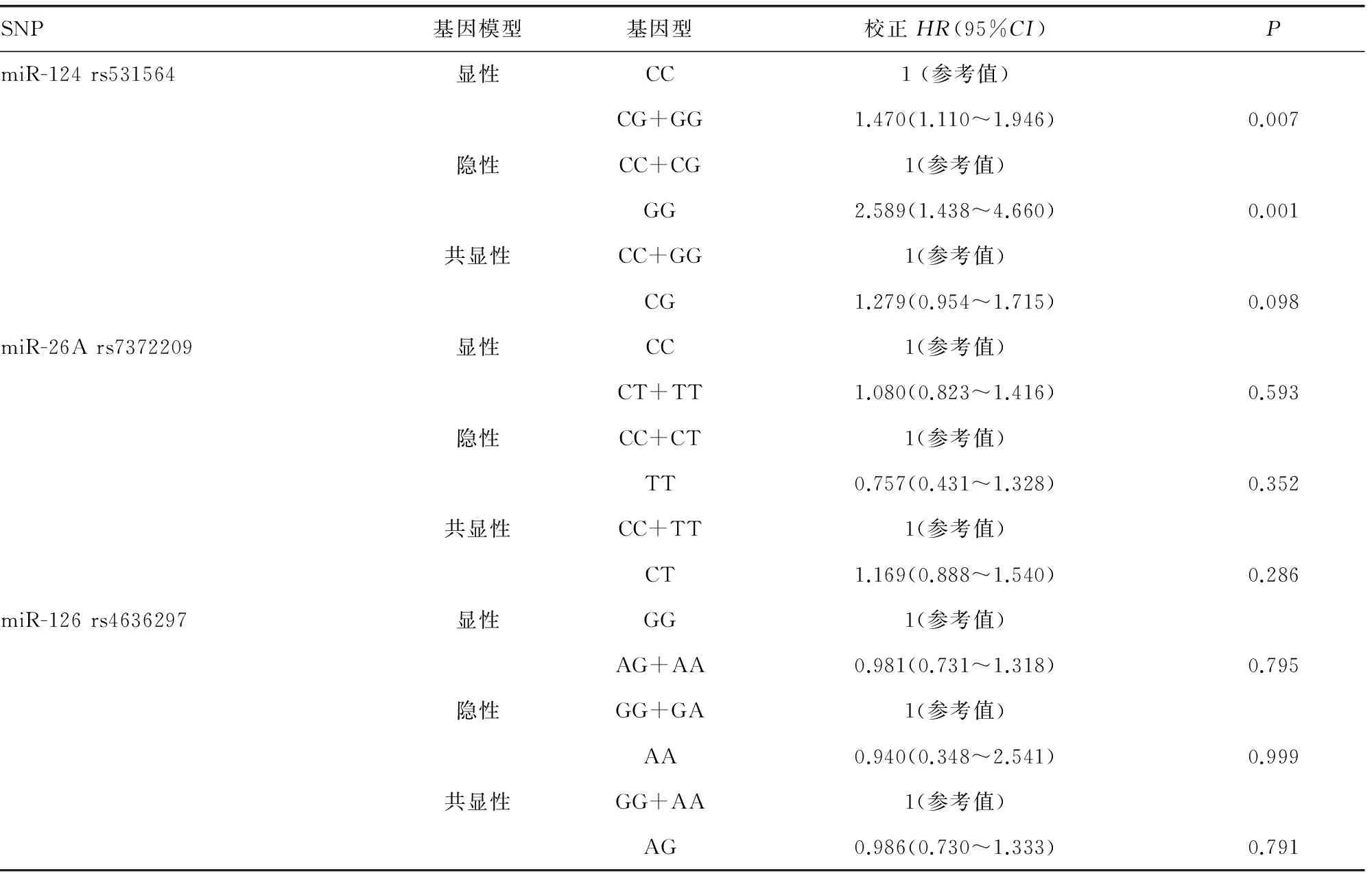
表6 3个miRNA各基因模型中不同基因型与CRC患者术后RFS的相关性
3 讨 论
近年来,miRNA基因多态性与恶性肿瘤之间的关联性开始受到关注,并发现某些miRNA基因SNPs与乳腺癌、肺癌、结肠癌等恶性肿瘤的发生风险相关[7-8]。虽然miRNA并不直接编码蛋白质,但是研究者普遍认为miRNA基因自身的多态性改变可能会通过影响miRNA的成熟及与下游靶基因的结合等过程,调控目的基因的转录、表达和生物学功能,最终影响个体对疾病的易感性及药物治疗的有效性等[9-10]。相关研究结果表明,miRNA基因SNPs与CRC的临床疗效和预后有一定的关联性。目前有关miRNA基因SNPs与CRC患者手术预后的报道很少,而miRNA表达水平与CRC发病风险和预后关系的研究较多。本研究结果显示,在校正年龄、性别、吸烟、饮酒等因素后,多因素Cox回归分析结果显示,携带miR-124 rs531564 CG基因型的CRC患者手术治疗后OS较CC基因型患者缩短,患者死亡风险增加;同时携带GG基因型患者较携带CC基因型患者的死亡风险亦增加。对RFS的分析结果显示,携带miR-124 rs531564 GG基因型的CRC患者手术治疗后RFS较携带CC基因型的患者降低,患者由于复发死亡的风险增加;携带CG基因型的患者与携带CC基因型的患者由于复发死亡的风险无明显差异。本研究结果还显示,未发现miR-26A rs7372209和miR-126 rs4636297位点多态性与CRC患者术后OS及RFS的相关性(P>0.05)。
miR-124、miR-126和miR-26A是近年来在CRC发生、发展过程中新发现的发挥重要作用的分子。已有研究报道,miR-124是一个潜在的肿瘤抑制因子,并且可能成为CRC、前列腺癌和鼻咽癌等肿瘤预后的独立标记物[11-12]。miR-124基因位于染色体的8p23,并有一个确定能影响miR-124表达的多态性位点(rs531564)。Pri-miR-124 rs531564基因多态性与相关癌症发病风险的相关性已经有报道[13]。PKM1/2分子协助HNF4a转录因子结合miR-214基因的启动子区上调miR-124的转录水平,高表达的miR-214可进一步激活线粒体凋亡信号通路促进CRC细胞的凋亡[14]。miR-124还可以通过与靶基因STAT3基因3′-UTR结合,促进CRC细胞的凋亡并抑制肿瘤的生长,进而发挥抑癌基因作用,同时miR-124还可调控PRRX1基因的表达提高CRC细胞系对放疗的敏感性[15]。另一项研究表明,在CRC组织和细胞系中pri-miRNA-124的表达明显下调,并且确定pri-miRNA-124是通过调控(iASPP)P53抑癌体系,进而对SW480和HT29细胞的增殖产生抑制作用[16]。这些结果阐明pri-miRNA-124/iASPP系统能调节CRC细胞的增殖,并认为miR-124可作为潜在的治疗CRC的靶点。目前研究已表明,pri-miR-124 rs531564位点的基因多态性与CRC的发病风险增加相关[17-18]。
综上所述,本研究通过对miR-124 rs531564、miR-26A rs7372209和miR-126 rs4636297多态位点与CRC患者术后的生存进行分析,发现miR-124 rs531564基因多态性是CRC患者预后的独立因素,而miR-124 rs531564、miR-26A rs7372209两个位点多态性均未发现与CRC的预后相关。本研究仍存在局限性与不足,由于CRC的发生是多基因及多环境因素联合作用的复杂过程,因此,试验结果仍需在不同地区人群和更大样本中进行验证,并对其预后发生机制进行深入研究。
[1]Chen W,Zheng R,Zhang S,et al.The incidences and mortalities of major cancers in China,2009[J].Chin J Cancer,2013,32(3):106-112.
[2]Stewart B.Wild C.World cancer report 2014[R].Geneva:International Agency for Research on Canc,WHO Press,2015.
[3]Yang R,Chen B,Pfütze K,et al.Genome-wide analysis associates familial colorectal cancer with increases in copy number variations and a rare structural variation at 12p12.3[J].Carcinogenesis,2014,35(2):315-323.
[4]Jia WH,Zhang B,Matsuo K,et al.Genome-wide association analyses in East Asians identify new susceptibility loci for colorectal cancer[J].Nat Genet,2013,45(2):191-196.
[5]Hinoue T,Weisenberger DJ,Lange CP,et al.Genome-scale analysis of aberrant DNA methylation in colorectal cancer[J].Genome Res,2012,22(2):271-282.
[6]Vogelstein B,Papadopoulos N,Velculescu VE,et al.Cancer genome landscapes[J].Science,2013,339(6127):1546-1558.
[7]Zhang Y,Zheng L,Huang J,et al.MiR-124 radiosensitizes human colorectal cancer cells by targeting PRRX1[J].PLoS One,2014,9(4):e93917.
[8]Khella HWZ,Scorilas A,Mozes R,et al.Low expression of miR-126 is a prognostic marker for metastatic clear cell renal cell carcinoma[J].Am J Pathol,2015,185(3):693-703.
[9]Boni V,Zarate R,Villa JC,et al.Role of primary miRNA polymorphi variants in metastatic colon cancer patients treated with 5-fluorouracil and irinotecan[J].Pharmacogenomics J,2011,11(6):429-436.
[10]Ghanbari R,Mosakhani N,Asadi J,et al.Downregulation of plasma MiR-142-3p and MiR- 26a-5p in patients with colorectal carcinoma[J].Iran J Cancer Prev,2015,8(3):e2329.
[11]Salzman DW,Weidhaas JB.SNPing cancer in the bud:microRNA and microRNA-target site polymorphisms as diagnostic and prognostic biomarkers in cancer[J].Pharmacol Ther,2013,137(1):55-63.
[12]Luan Y,Zuo L,Zhang S,et al.MicroRNA-126 acts as a tumor suppressor in glioma cells by targeting insulin receptor substrate 1 (IRS-1)[J].Int J Clin Exp Pathol,2015,8(9):10345-10354.
[14]Sun Y,Zhao X,Luo M,et al.The pro-apoptotic role of the regulatory feedback loop between miR-124 and PKM1/HNF4α in colorectal cancer cells[J].Int J Mol Sci,2014,15(3):4318-4332.
[15]Li N,Tang A,Huang S,et al.MiR-126 suppresses colon cancer cell proliferation and invasion via inhibiting RhoA/ROCK signaling pathway[J].PLoS One,2013,8(11):e81203.
[16]Gao X,Zhang S,Zhu Z.Lysyl oxidase rs1800449 polymorphism and cancer risk among Asians:evidence from a meta-analysis and a case-control study of colorectal cancer[J].Mol Genet Genomics,2015,290(1):23-28.
[17]Wang P,Chen L,Zhang J,et al.Methylation-mediated silencing of the miR-124 genes facilitates pancreatic cancer progression and metastasis by targeting Rac1[J].Oncogene,2014,33(4):514-524.
[18]Liu K,Zhao H,Yao H,et al.MicroRNA-124 regulates the proliferation of colorectal cancer cells by targeting iASPP[J].BioMed Res Int,2013(2013):867537.
CorrelationanalysisofmiR-124rs531564,miR-26Ars7372209andmiR-126rs4636297polymorphismstotheprognosisofcolorectalcancer*
LiuJianrong,ChenXiaolin
(DepartmentofClinicalLaboratory,thePeople′sHospitalofPingxiangCity,Pingxiang,Jiangxi337055,China)
ObjectiveTo assess the influence of miRNA(miR)-124,miR-26A and miR-126 single nucleotide polymorphism (SNPs) on the prognosis in patients with colorectal cancer (CRC).MethodsA total of 724 cases of patients with CRC treated in this hospital from July 2011 to December 2013 served as the research subjects.The peripheral blood samples were collected,and genotype analysis of miR-124 rs531564,miR-26A rs7372209 and miR-126 rs4636297 SNPs locus were performed by using the PCR-LDR.The patient′s overall survival (OS) and progression-free survival (PFS) were calculated by using Kaplan-Meier method,and the univariate log-rank method was used to analyse the influence of different genotypes and haplotypes of SNPs on OS and PFS.ResultsThe OS after operation in CRC patient′s carrying miR-124 rs531564 CG genotype was decreased compared with that in patients carrying CC genotype,and the patient′s death risk was increased[HR2=1.450,95%CI(1.043-2.017),P=0.026]; the patient′ s death risk in patients carrying GG genotype was also increased compared with that in patients carrying CC genotype[HR2=2.339,95%CI(1.171-4.674)]; in the dominant gene model,the OS in patients carrying CG+GG genotype was significantly decreased compared with patients carrying CC genotype[HR2=1.532,95%CI(1.119-2.096),P=0.008];in the recessive gene model,no statistically significant difference was found in OS between patients carrying GG genotype and those carrying CC+CG genotype[HR2=1.975,95%CI(1.000-3.900),P=0.0052]; in the co-dominant model,compared with patients carrying CC+CG genotype,the OS in patients carrying CG genotype was decreased and their death risk was increased[HR2=1.395,95%CI(1.007-1.931)].There was no correlation of miR-26A rs7372209 locus and miR-126 rs4636297 locus gene SNPS to OS and PFS in CRC patients (P>0.05).ConclusionmiR-124 rs531564 gene polymorphism might be an independent influence factor of the prognosis in CRC patients.
] miRNA-124;miRNA-26A;miRNA-126;polymorphism,single nucleotide;colorectal neoplasms;prognosis
10.3969/j.issn.1671-8348.2017.36.013
江西省卫生和计划生育委员会基础医学研究项目(20157141)。
刘剑荣(1965-),副主任技师,本科,主要从事临床生化及分子生物学检验研究。
R446.1
A
1671-8348(2017)36-5076-05
2017-08-18
2017-09-26)
