肥胖对胰岛β细胞凋亡的影响*
2018-01-05白秋方杨少娟彭旖旎
胡 军, 白秋方, 杨少娟, 朱 琳, 彭旖旎, 周 军
1华中科技大学同济医学院附属梨园医院内分泌科,武汉 430077 2武汉市第一医院心血管内科,武汉 430033
肥胖对胰岛β细胞凋亡的影响*
胡 军1, 白秋方1, 杨少娟1, 朱 琳1, 彭旖旎1, 周 军2△
1华中科技大学同济医学院附属梨园医院内分泌科,武汉 4300772武汉市第一医院心血管内科,武汉 430033
目的探讨肥胖对胰岛β细胞凋亡的影响及其可能的机制。方法取雄性SD大鼠,采用高脂饮食喂养的方法建立大鼠肥胖模型。取肥胖模型组(obese model group,OM组)和正常对照组(normal control group,NC组)大鼠各10只检测。测定空腹血糖(FBG)、总胆固醇(TC)、三酰甘油(TG)、游离脂肪酸(FFA)及血清胰岛素(FIns)的水平,计算胰岛素抵抗指数(HOMA-IR)。苏木精-伊红染色观察胰腺组织病理变化;脱氧核糖核苷酸末端转移酶介导的缺口末端标记法(TUNEL)检测β细胞凋亡水平;Western blot检测细胞色素C(Cyt C)在线粒体、细胞质中的分布情况及活化的胱天蛋白酶-3(Caspase-3)的表达水平。结果与NC组比较,OM组大鼠FBG、TC、TG、FFA、FIns、HOMA-IR、凋亡指数、胞质Cyt C水平及活化的Caspase-3表达水平均明显升高;线粒体Cyt C水平明显降低(均P<0.05);胰腺组织出现结构破坏、脂质变性等改变。结论肥胖通过线粒体途径增加胰岛β细胞的凋亡水平。
肥胖; 凋亡; 胰岛素抵抗; 细胞色素C; 胱天蛋白酶-3
肥胖症是一种以体内脂肪堆积过多为主要特点的慢性代谢性疾病。脂肪组织是一种兼具能量贮存和内分泌双重功能的器官,其分泌的多种脂肪因子如游离脂肪酸、瘦素、脂联素、肿瘤坏死因子α等对胰岛β细胞功能具有重要调节作用[1]。β细胞凋亡是肥胖发展为2型糖尿病的重要环节,而线粒体凋亡途径是细胞凋亡的重要途径,因此猜测,肥胖可能通过影响线粒体凋亡途径来调节胰岛β细胞的凋亡。为验证上述猜测,我们采用高脂饲料饲喂大鼠建立肥胖模型的方法,探讨肥胖对胰岛β细胞凋亡的影响及线粒体凋亡途径在其中扮演的角色。
1 材料与方法
1.1 主要实验材料
6周龄SPF级健康雄性SD大鼠30只,150~180 g,购自华中科技大学实验动物中心,实验单位使用许可证编号SYXK(鄂)2010-0057,合格证号No.42009800001565。TUNEL细胞凋亡检测试剂盒(货号11684817910)购自Roche Applied Science公司;组织线粒体分离试剂盒(货号C3606)购自碧云天公司;大鼠胰岛素酶联免疫吸附测定试剂盒(货号E-EL-R2466c)购自伊莱瑞特生物科技有限公司;总胆固醇(TC)测定试剂盒(货号A111-1)、三酰甘油(TG)测定试剂盒(货号A110-1)、游离脂肪酸(FFA)测定试剂盒(货号A042)、葡萄糖测试盒(货号F006)均购自南京建成生物工程研究所;鼠抗细胞色素C(Cyt C,货号12963)与兔抗Caspase-3抗体(货号9664)均购自CST公司;苏木精(货号H9627)购自Sigma公司;伊红Y(货号71014544)购自国药集团。
1.2 实验方法
1.2.1 动物分组 大鼠适应性喂养1周后,随机分为2组,正常对照组10只,给予普通饲料,高脂组20只,给予高脂饲料。第14周,选取高脂组体重较对照组平均体重增加大于20%的大鼠作为肥胖模型组,空腹16 h后,乌拉坦麻醉,心脏取血,分离血清检测空腹血糖(FBG)、TC、TG、FFA及空腹胰岛素(FIns),打开腹腔,分离胰腺,切取部分胰尾组织放入4%多聚甲醛溶液中以待包埋,另取适量胰尾组织放入冻存管并置于-80℃冰箱,剩余胰尾组织置于冰上的离心管中备用。
1.2.2 大鼠血生化检测 采用氧化酶法检测FBG、TC、TG;比色法检测FFA;酶联免疫吸附法(ELISA)检测FIns。采用稳态模型计算胰岛素抵抗指数(HOMA-IR),即HOMA-IR=FBG(mmol/L)×FIns(mU/L)/22.5。胰岛素单位换算:1 μg/L×172.2=1 pmol/L,1 pmol/L=1 mU/L×6.965。
1.2.3 胰腺组织苏木精-伊红染色 胰腺组织经过脱水、透明、浸蜡、包埋、切片和烤片、脱蜡后,依次浸入苏木精染液染色5 min、1%的盐酸乙醇分化5 s、1%水溶性伊红染液染色2 min后,经无水乙醇脱水、二甲苯透明、风干后中性树胶封片、最后镜检。
1.2.4 TUNEL技术测定β细胞凋亡水平 组织经过脱水、透明、浸蜡、切片、烤片后脱蜡滴加蛋白酶K工作液,PBS洗涤3次。滴加TUNEL反应混合液于样本上,避光孵育60 min,洗涤后加converter-POD于标本上,避光孵育30 min,洗涤后滴加DAB显色液,室温显色5 min后终止显色,再依次经过Harris苏木精复染和脱水透明,晾干的切片在显微镜下观察并采集图像。凋亡胰岛细胞细胞核染色质浓缩深染,呈棕黄色。每组分别取5只大鼠进行检测,每个切片计数3个胰岛中凋亡细胞数目,并计算凋亡指数。凋亡指数=TUNEL染色阳性细胞数/胰岛细胞总数×100%。
1.2.5 Western blot测定胰腺组织Cyt C及活化的Caspase-3的表达水平 按线粒体分离试剂盒说明书操作分离线粒体蛋白和胞质蛋白成分,同时提取胰腺组织总蛋白,测定蛋白浓度后,沸水使蛋白变性,上样,电泳分离,转膜,用含5%脱脂奶粉的TBST浸泡PVDF膜,依次加一抗、二抗、显色曝光,晾干胶片,扫描胶片,用BandScan分析胶片灰度值。计算Cyt C/β-actin、活化Caspase-3/β-actin等值,比值越大,说明蛋白的表达越多。
1.3 统计学方法
2 结果
2.1 大鼠血生化检测指标结果比较
与NC组比较,OM组大鼠空腹血糖、总胆固醇、三酰甘油、游离脂肪酸、胰岛素、胰岛素抵抗水平均明显升高(均P<0.05),见表1。

表1 两组大鼠FBG、TC、TG、FFA、FIns及HOMA-IR水平的比较Table 1 Comparison of the levels of FBG,TC,TG,FFA,FIns and HOMA-IR in the two groups(±s,n=10)
与NC组比较,*P<0.05
2.2 大鼠胰腺组织病理变化的比较
OM组大鼠胰岛细胞肿胀,体积增大,腺泡结构破坏明显,并伴有明显的脂肪块状沉积;NC组胰腺组织结构完好,脂肪块状沉积不明显。见图1。
2.3 大鼠胰岛细胞凋亡指数的比较
NC组和OM组大鼠胰岛细胞凋亡指数分别为(5.08±2.38)%、(21.16±3.33)%,OM组胰岛细胞凋亡指数明显增加(P<0.05)。见图2。
2.4 大鼠胰腺组织Cyt C及活化的Caspase-3的表达水平比较
与NC组比较,OM组大鼠胞质Cyt C水平及活化的Caspase-3的表达水平显著升高,线粒体Cyt C水平则明显降低(均P<0.05),见图3、图4。

A:NC组;B:OM组;箭头所示为脂肪块状沉积图1 大鼠胰腺组织病理学观察(苏木精-伊红染色,×200)Fig.1 Pathological examination of the pancreatic tissues(HE staining,×200)
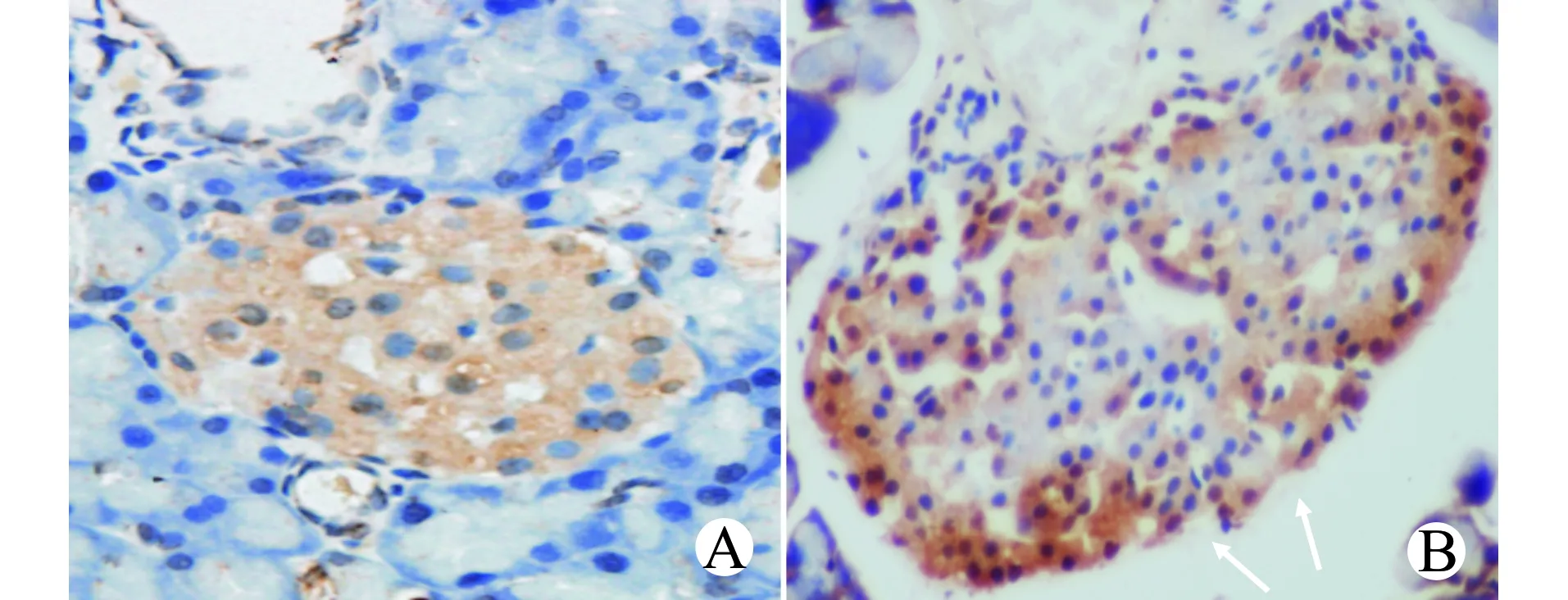
A:NC组;B:OM组;箭头所示为凋亡的胰岛细胞图2 两组大鼠胰岛细胞凋亡水平检测(TUNEL,×400)Fig.2 Detection of apoptotic levels of islet cells in the two groups(TUNEL,×400)

图3 Western blot检测胰腺组织Cyt C的分布及活化的Caspase-3蛋白表达Fig.3 Distribution of Cyt C and protein expression of cleaved Caspase-3 in pancreatic tissues

与NC组比较,*P<0.05图4 大鼠胰腺组织Cyt C的分布及活化的Caspase-3蛋白的表达水平Fig.4 Analysis of distribution of Cyt C and protein expression level of cleaved Caspase-3 in pancreatic tissues
3 讨论
近些年随着人们生活水平的提高及膳食结构的改变,全球范围内超重和肥胖症的患病率普遍升高。肥胖作为2型糖尿病独立的高危因素,已受到广泛关注。β细胞功能受损和胰岛素抵抗是目前比较公认的2型糖尿病发病机制,其中β细胞功能受损是2型糖尿病发病的决定因素。多项研究表明β细胞功能受损与β细胞凋亡增加密切相关。细胞凋亡是由基因控制的细胞程序性死亡,线粒体途径被公认为是细胞凋亡的主要信号转导途径。研究表明,肥胖可通过脂肪组织分泌的脂肪因子对胰岛β细胞数量及胰岛素分泌功能产生重要影响。因此,探讨肥胖与β细胞凋亡的关系对2型糖尿病发病机制的研究具有重要意义。
血糖和FFA是生物体内参与能量代谢的主要营养物质,在维持β细胞数量和功能稳定方面发挥着重要作用。研究发现慢性高血糖及血脂异常所致的糖毒性与脂毒性干扰葡萄糖及脂质代谢,并导致β细胞损伤[2]。体内增多的FFA导致TG生成速率增加,过多的TG沉积在胰腺组织,导致胰腺组织结构破坏、β细胞功能受损、数量减少及凋亡增加。Shimabukuro等[3]通过曲格列酮(TG抑制剂)孵化胰岛细胞改善胰岛素分泌证明TG对β细胞具有抑制效应。Tuo等[4]发现β细胞长期暴露于亚麻酸会导致其功能失调甚至凋亡,线粒体信号通路可能参与其中,同时发现增加糖的水平可加重β细胞损伤。近年来有研究发现神经酰胺(FFA代谢中间产物)被激活后可使线粒体释放活性氧及Cyt C,使β细胞凋亡[5]。Piro等[6]发现慢性暴露于高糖将增加大鼠胰岛细胞的凋亡,并提出氧化应激可能参与其中,同时发现该组Bax水平升高,Bcl-2水平降低及Caspase-3水平轻度升高。该研究表明线粒体凋亡途径在高糖引起的胰岛β细胞凋亡中同样发挥着重要的作用。本研究发现OM组大鼠FBG、FFA、TG、TC及β细胞凋亡指数明显高于NC组,表明高血糖、高血脂协同作用加重胰岛β细胞凋亡。
Cyt C和Caspase-3是参与线粒体凋亡途径的关键信号转导分子。Cyt C位于线粒体膜间腔,是氧化呼吸链上在复合体Ⅲ和复合体Ⅳ之间传递电子的水溶性球状蛋白。Caspase-3位于胞质,是Caspase家族中凋亡的执行者,具有灭活凋亡抑制性蛋白、水解细胞蛋白结构及参与Caspase级联反应导致细胞损伤的作用。多种刺激均可引起线粒体内膜的变化,导致线粒体通透性转换孔开放,线粒体跨膜电位消失,促凋亡蛋白Cyt C及凋亡诱导因子(apoptosis-inducing factor,AIF)从线粒体膜间隙释放,激活Caspase-3依赖的线粒体凋亡途径,最终导致细胞凋亡[7-8]。Mehmeti等[9]研究中采用Western blot分析Cyt C在线粒体及胞质重新分布的情况,为我们分析线粒体凋亡途径提供方法参照。本研究发现OM组胞质中Cyt C水平及活化的Caspase-3表达明显增加,线粒体中Cyt C水平明显减少,说明线粒体凋亡途径在β细胞凋亡中发挥着重要的作用。
FFA影响β细胞胰岛素分泌,干扰糖代谢,抑制胰岛素信号转导。研究发现FFA通过上调β细胞解偶联蛋白2(uncouping protein-2,UCP-2)的表达抑制葡萄糖刺激的胰岛素分泌(glucose-stimulated insulin secretion,GSIS)[1]。近些年有研究表明FFA通过激活丝氨酸/苏氨酸激酶减少胰岛素受体底物1或2(insulin receptor substrates 1 or 2,IRS-1或IRS-2)及IRS的酪氨酸磷酸化而阻断胰岛素信号通路[10-11]。β细胞凋亡使其胰岛素分泌功能下降,尚有代偿能力的β细胞分泌胰岛素增加,使胰岛素整体水平偏高;胰岛素抵抗时,外周组织对胰岛素作用的敏感性降低,表现为高胰岛素血症;当β细胞胰岛素分泌功能失代偿时,出现血糖水平的异常增高[12]。本研究发现OM组大鼠β细胞分泌胰岛素水平及胰岛素抵抗指数均明显升高,提示肥胖模型鼠存在胰岛素抵抗。
苏木精-伊红染色显示OM组大鼠胰岛细胞肿胀,体积增大,腺泡结构破坏明显,并伴有明显的脂肪块状沉积;NC组胰腺组织结构完好,脂肪变性不明显。
综上所述,我们推测肥胖通过线粒体途径增加胰岛β细胞的凋亡水平。本研究为通过减轻体重降低胰岛β细胞凋亡水平及预防2型糖尿病的发生提供一定的理论依据。
[1] 赵玉峰,陈晨.脂肪细胞对胰岛β细胞功能的内分泌调节作用(英文)[J].生理学报,2007,59(3):247-252.
[2] Oh Y S.Mechanistic insights into pancreatic beta-cell massregulation by glucose and free fatty acids[J].Anat Cell Biol,2015,48(1):16-24.
[3] Shimabukuro M,Zhou Y T,Lee Y,et al.Troglitazone lowers islet fat and restores beta cell function of Zucker diabetic fatty rats[J].J Biol Chem,1998,273(6):3547-3550.
[4] Tuo Y,Wang D,Li S,et al.Long-term exposure of INS-1 rat insulinoma cells to linoleic acid and glucoseinvitroaffects cell viability and function through mitochondrial-mediated pathways[J].Endocrine,2011,39(2):128-138.
[5] Galadari S,Rahman A,Pallichankandy S,et al.Role of ceramide in diabetes mellitus:evidenceand mechanisms[J].Lipids Health Dis,2013,12:98.
[6] Piro S,Anello M,Di Pietro C,et al.Chronic exposure to free fatty acids or high glucose induces apoptosis in rat pancreatic islets:possible role of oxidative stress[J].Metabolism,2002,51(10):1340-1347.
[7] van Gurp M,Festjens N,van Loo G,et al.Mitochondrialinter membrane proteins in cell death[J].Biochem Biophys Res Commun,2003,304(3):487-497.
[8] Franklin E E,Robertson J D.Requirement of Apaf-1 for mitochondrial events and the cleavageor activation of all procaspases during genotoxic stress-induced apoptosis[J].Biochem J,2007,405(1):115-122.
[9] Mehmeti I,Lenzen S,Lortz S.Modulation of Bcl-2-related protein expression in pancreatic beta cells by pro-inflammatory cytokines and its dependence on the antioxidative defense status[J].Mol Cell Endocrinol,2011,332(1/2):88-96.
[10] 李翰卿,宋微微,汪俊军.游离脂肪酸与胰岛素抵抗关系的研究进展[J].医学研究生学报,2012,25(9):981-984.
[11] 高啸,彭旖旎,朱琳,等.硫化氢对2型糖尿病大鼠肝脏胰岛素抵抗的影响[J].华中科技大学学报:医学版,2016,45(5):490-495.
[12] 陈丽,陈瑞,梁凤霞,等.NF-κB信号通路与胰岛素抵抗[J].华中科技大学学报:医学版,2015,44(5):608-611.
EffectsofObesityonIsletβ-CellApoptosis
Hu Jun,Bai Qiufang,Yang Shaojuanetal
DepartmentofEndocrinology,LiyuanHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430077,China
ObjectiveTo investigate the effects of obesity on islet β-cell apoptosis and the possible mechanisms.MethodsObese models were established in male SD rats by high fat diet.The rats in the obese model group(n=10)and the normal control group(n=10)were selected for detecting fasting blood glucose(FBG),total cholesterol(TC),triglyceride(TG),free fatty acids(FFA),fasting insulin(FIns)and calculating insulin resistance index(HOMA-IR).The pathological changes of the pancreatic tissues were observed by hematoxylin-eosin(HE)staining and the apoptotic islet β cells were measured by TdT-mediated dUTP-biotin nick end labeling(TUNEL)method.Cytochrome C(Cyt C)in mitochondria,cytoplasm and cleaved cysteine aspartate-specific protease-3(Caspase-3)in islet β cells were determined by Western blotting.ResultsThe levels of FBG,TC,TG,FFA,FIns,HOMA-IR,apoptotic index and Cyt C in cytoplasm and cleaved Caspase-3 were significantly increased and the level of Cyt C in mitochondria was profoundly decreased in the obese model group as compared with the normal control group(allP<0.05).In the rats of the obese model group,the structure of pancreatic tissues was damaged,and there was obvious steatosis.ConclusionObesity can increase the apoptotic level of islet β cells by activation of mitochondrial apoptotic pathway.
obesity; apoptosis; insulin resistance; Cytochrome C; Caspase-3
*湖北省自然科学基金资助项目(No.2014CFB446)
胡 军,女,1964年生,主任医师,E-mail:hujun1108@163.com
△通讯作者,Corresponding author,E-mail:18971296188@189.com
R587
10.3870/j.issn.1672-0741.2017.06.007
(2017-06-13 收稿)
