南瓜类胡萝卜素含量的超高效液相色谱分析
2018-01-04陈敏氡刘建汀叶新如朱海生温庆放
王 彬,林 亮,陈敏氡,刘建汀,叶新如,朱海生,温庆放
(1福建省农业科学院作物研究所,福州350013;2福建省农业科学院蔬菜研究中心,福州350013;3连江县农业局,福建连江950500)
南瓜类胡萝卜素含量的超高效液相色谱分析
王 彬1,2,林 亮3,陈敏氡1,2,刘建汀1,2,叶新如1,2,朱海生1,2,温庆放1,2
(1福建省农业科学院作物研究所,福州350013;2福建省农业科学院蔬菜研究中心,福州350013;3连江县农业局,福建连江950500)
类胡萝卜素是一类重要的天然色素。为了分析南瓜类胡萝卜素的成分及含量,以南瓜果肉为材料,通过对不同提取剂(甲醇、乙醇、石油醚、丙酮、丙酮-石油醚(1:1)、丙酮-石油醚(1:2)、丙酮-石油醚(1:4))和提取方法(皂化和非皂化)的筛选,优化南瓜果肉类胡萝卜素的提取条件,并应用超高效液相色谱(UPLC)技术分析了23个南瓜品种的类胡萝卜素成分及含量。结果表明,以乙醇作为提取剂并通过皂化处理更适合南瓜果肉类胡萝卜素的提取。南瓜果肉中含有β-胡萝卜素、α-胡萝卜素和叶黄素3种类胡萝卜素,其成分组成及含量在南瓜种内及种间均存在差异,大部分印度南瓜和中国南瓜品种的类胡萝卜素总量明显高于美洲南瓜品种。实验所优化的提取及测定方法适合南瓜果肉类胡萝卜素的定性定量分析。
南瓜;类胡萝卜素;超高效液相色谱法(UPLC);成分;含量
0 引言
类胡萝卜素是一类亲脂性天然色素的总称,其主要的生物学功能是参与光合作用、抗氧化作用和植物激素的合成[1-2],在治疗年龄相关性黄斑变性[3]、糖尿病[4],预防癌症[5]、阿尔茨海默氏病[6]等方面具有突出的保健功能。然而,人体自身无法合成类胡萝卜素,也很难通过化学方法合成,主要是从蔬菜和水果中摄取[7]。随着人们对食品安全、健康膳食的愈发重视,有关类胡萝卜素种类和产量的需求也与日俱增。因此,从天然植物中找寻富含类胡萝卜素的优势资源很有意义。
南瓜是诸多果蔬中类胡萝卜素含量最为丰富的蔬菜之一[8],同时也是国际公认的保健食品[9]。与其他的高类胡萝卜素蔬菜相比,南瓜的优势在于栽培南瓜所耗费的成本更低[10]。且中国是世界上两大南瓜主产国之一,具有较强的国际竞争力。因此,把南瓜作为质优、价廉的类胡萝卜素来源,围绕着南瓜开展的类胡萝卜素研究具有重要的意义。
类胡萝卜素家族成员众多,且不同的植物所含类胡萝卜素的种类和含量也不尽相同[11]。为了确保类胡萝卜素提取完全,在提取过程中需根据植物的种类选择高效的提取方式。目前,高效液相色谱法(HPLC)是检测南瓜类胡萝卜素的主要手段[12-13]。随着色谱技术的发展,超高效液相色谱(UPLC)的诞生,弥补了HPLC分析时间长,分离效果不佳等缺陷,兼有更高的选择性、分离度、灵敏度以及更快速[14-15]。李文爽等[16]利用UPLC测定小麦籽粒中的类胡萝卜素含量仅需25 min,相较于HPLC检测时间节省50%以上。陈敏氡等[17]通过UPLC方法在5 min左右即可完成草莓果实类胡萝卜素含量的检测,分析时间比HPLC缩短70%左右。有关南瓜类胡萝卜素的UPLC分析国内尚未见报道。本研究通过优化南瓜类胡萝卜素的提取条件,建立快速、可靠的UPLC测定方法,并对23份南瓜资源的类胡萝卜素成分及含量进行测定,以期了解类胡萝卜素在南瓜中的累积特点,为中国南瓜资源合理的开发与利用提供科学依据。
1 材料与方法
1.1 材料
试验于2016年3月在福清市东张镇蔬菜基地进行。选择23种南瓜品种,包括印度南瓜(又称板栗南瓜)品种10个,中国南瓜品种7个,美洲南瓜(俗称西葫芦)品种6个。采摘开花后30~40天左右中国、印度南瓜的正常成熟瓜,开花后14~20天美洲南瓜的正常成熟瓜。每个品种收集各5个果,置于-20℃冰箱中保存待测。
1.2 试剂
叶黄素、β-隐黄质、α-胡萝卜素、β-胡萝卜素的标准品(Sigma,USA);乙腈、甲醇为色谱纯(Fisher,USA);丙酮、石油醚、甲醇、95%乙醇、无水硫酸钠、氢氧化钾等为分析纯(上海国药,中国)。
1.3 仪器
超高效液相色谱仪(Waters,USA),RV10型旋转蒸发器(IKA,German),Ultrospec1100 pro紫外分光光度计(Amersham,USA)等。
1.4 方法
1.4.1 南瓜类胡萝卜素的提取 用液氮快速将成熟的去皮南瓜果肉研磨至粉末状,准确称取2 g,加入20 mL的浸提剂置于50℃的培养箱中避光浸提15~20 min,过滤收集浸提液,重复操作至残渣变白后将其定容至50 mL,备用。
提取剂的优化:采用7种不同的浸提溶剂(甲醇、乙醇、石油醚、丙酮、丙酮-石油醚(1:1)、丙酮-石油醚(1:2)、丙酮-石油醚(1:4)),依照以上步骤进行样品的浸提。
提取方法的优化:参照草莓类胡萝卜素UPLC检测方法[17],采用非皂化和皂化2种提方法对浸提后的样品进行类胡萝卜素组分的萃取。
样品上机前需用流动相进行稀释,并经0.22 μm微孔过滤膜过滤,实验重复3次。
1.4.2 色谱条件 选用美国Waters公司2.1mm×100mm,1.7 μmACQUITY UPLC BEH C18色谱柱;流动相为乙腈:甲 醇 =9:1(v/v);检 测 器 波 长 450 nm;流 速0.5 mL/min;进样体积10 uL;柱温30℃,样品温度30℃。
1.4.3 回收率试验 称取等量的经液氮研磨处理的去皮短蔓红(吉林)南瓜品种果肉粉末5份,每份称取2 g,分别加入20 μg的叶黄素、β-隐黄质、α-胡萝卜素、β-胡萝卜素标准品,余下1份作为空白对照,不加入标准品。按照上述的提取步骤与色谱条件进行类胡萝卜素含量测定,计算样品的回收率。同等条件下重复测定3次。
1.4.4 类胡萝卜素含量的测定 利用上述的提取步骤与色谱条件对23份南瓜品种进行类胡萝卜素含量测定,试验重复3次。
1.5 数据统计与分析
用SPSS 18.0软件进行数据基本的统计量分析和差异显著性比较。
2 结果与分析
2.1 南瓜类胡萝卜素提取条件优化
2.1.1 不同有机溶剂对南瓜类胡萝卜素提取效果的影响 试验选择了7种极性不同的有机提取剂,考察不同提取剂对南瓜类胡萝卜素提取效果的影响,从而确定适合的提取剂。结果如图1所示,同一条件下,石油醚的提取效果最差,使用乙醇提取获得的类胡萝卜素的总量最高。因此,选择乙醇作为南瓜去皮果肉中类胡萝卜素的提取剂。

图1 不同提取溶剂对南瓜果肉中类胡萝卜素总量提取效果的影响
2.1.2 不同处理方法提取效果的比较 从图2可知,皂化后测得的类胡萝卜素总含量明显高于未经皂化的,说明皂化处理可能促使南瓜果肉中的酯化态类胡萝卜素向游离态转化。故通过皂化来提取南瓜中的类胡萝卜素。
2.2 UPLC检测方法的建立
2.2.1 检测波长的选择 对叶黄素、β-隐黄质、α-胡萝卜素、β-胡萝卜素4种标准品进行紫外吸收光谱扫描。结果表明,叶黄素的吸收波长为450 nm,β-隐黄质为440 nm,α-胡萝卜素为449 nm,β-胡萝卜素为448 nm,考虑到南瓜中主要含叶黄素、α-胡萝卜素和β-胡萝卜素,故选择最大吸收波长450 nm作为类胡萝卜素测定的检测波长。
2.2.2 色谱条件的确定 试验参照草莓果实类胡萝卜素的UPLC分析方法[17],选择乙腈:甲醇=9:1(v/v)作为流动相流动相,以流速为0.5 mL/min进行等度洗脱,并对其他色谱参数加以改进,包括进样体积为10 μL,柱温为30℃,样品温度为30℃,结果如图3所示,在此色谱条件下4种标准品可以较好分离,峰形对称(图3)。

图2 不同处理方法对南瓜果肉中类胡萝卜素总量的影响
2.3 回收率试验
从表1可知,叶黄素、β-隐黄质、α-胡萝卜素、β-胡萝卜素的回收率依次分别为93.02%、91.95%、95.73%、95.95%,4种标准品的平均回收率达到94.16%,说明试验所建立的UPLC分析方法结果可靠。
2.4 南瓜品种果实类胡萝卜素含量分析
从图4可知,南瓜样品中可能主要存在3种类胡萝卜素成分,它们的保留时间分别为0.848 min,5.965 min和6.378 min。通过与类胡萝卜素标准品色谱(图3)的对比可知,这3种成分分别为叶黄素、α-胡萝卜素以及β-胡萝卜素,而β-隐黄质并未被检测到。

图3 类胡萝卜素标准品UPLC色谱分析
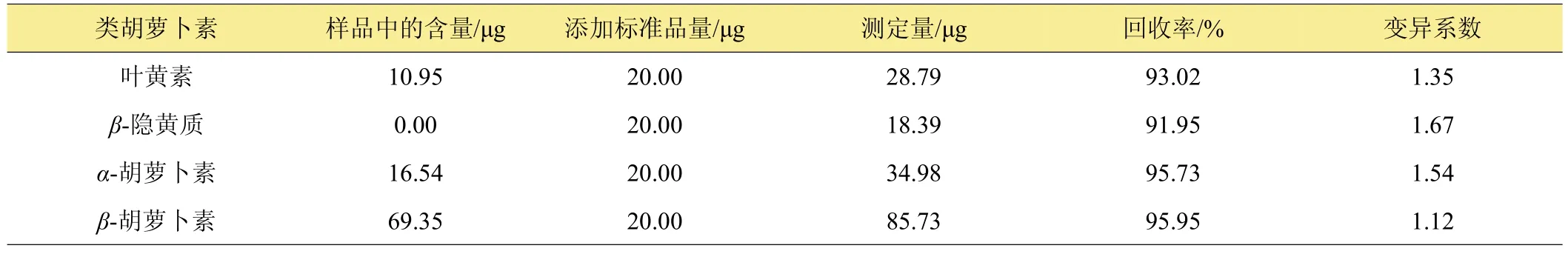
表1 南瓜果肉中类胡萝卜素的回收率

图4 南瓜果肉类胡萝卜素提取物色谱分析
本试验选择23份南瓜品种进行类胡萝卜素含量的测定,结果如表2所示,成分上,在23份南瓜品种中,印度南瓜品种中有7份含有β-胡萝卜素、α-胡萝卜素和叶黄素,余下3份没有检测到α-胡萝卜素;中国南瓜品种均含有β-胡萝卜素、α-胡萝卜素和叶黄素;美洲南瓜品种均能检测到β-胡萝卜素和叶黄素,其中两份还能检测到α-胡萝卜素。可见南瓜中含有β-胡萝卜素、α-胡萝卜素和叶黄素3种类胡萝卜素,并且南瓜种间及种内的类胡萝卜素成分均存在差异。含量上,印度南瓜品种中,类胡萝卜素含量依次为β-胡萝卜素>α-胡萝卜素>叶黄素;中国南瓜品种中,类胡萝卜素含量依次为α-胡萝卜素>β-胡萝卜素>叶黄素;美洲南瓜品种中类胡萝卜素含量依次为β-胡萝卜素>叶黄素>α-胡萝卜素,并且大部分印度南瓜和中国南瓜品种的类胡萝卜素总量明显高于美洲南瓜品种。在中国南瓜的密本品种中,不同地区的类胡萝卜素含量差异较大,其中金塔密本南瓜含量最高,约为晋中密本南瓜的5倍以上。由此推测南瓜中的类胡萝卜素含量也存在种间和种内的差异并且地域性明显。

续表4
3 讨论与结论
本试验选择了7种有机溶剂对南瓜果肉进行浸提,结果表明使用乙醇提取获得的类胡萝卜素总量最高,这与颜少宾等[19]、莫玉楠等[20]的报道不一致。推测可能的原因是不同植物来源的试材中类胡萝卜素的种类及存在形式上的差异导致了有机溶剂提取类胡萝卜素的效率不同[18]。故在今后的研究中可尝试下不同比例的乙醇-丙酮溶剂对南瓜果肉中类胡萝卜素提取效果的影响。不同的提取方式也会对类胡萝卜素的定量分析结果造成很大影响,研究表明相同的试材采用不同的方法提取类胡萝卜素,其结果差异很大[21]。在提取类胡萝卜素时,是否要对样品进行皂化处理是一个必须要考虑的问题。皂化的作用是水解类胡萝卜素酯,得到游离态类胡萝卜素单体,同时除去叶绿素干扰,达到简化分离准确定量的目的,然而皂化的同时会导致类胡萝卜素总量或单个类胡萝卜素的降解损失[22]。因此,本实验比较了皂化与未皂化2种处理方式对南瓜类胡萝卜素提取效果的影响,结果表明经皂化后提取出的类胡萝卜素总量要高于未经皂化直接提取,可见皂化处理更适合于南瓜类胡萝卜素的提取。利用UPLC分析方法对23份不同南瓜品种果肉中的类胡萝卜素成分和含量进行了检测,结果发现大部分印度南瓜和中国南瓜品种的类胡萝卜素总量明显高于美洲南瓜品种,并且中国南瓜中的密本品种还存在地域性差异,推测可能与环境、栽培条件等诸多因素有关。
综上,以乙醇作为提取剂并通过皂化处理更适合南瓜果肉类胡萝卜素的提取,南瓜果肉中含有β-胡萝卜素、α-胡萝卜素和叶黄素3种类胡萝卜素,其成分组成及含量在南瓜种内及种间均存在差异,大部分印度南瓜和中国南瓜品种的类胡萝卜素总量明显高于美洲南瓜品种。实验所优化的提取及测定方法适合南瓜果肉类胡萝卜素的定性定量分析,研究结果为中国南瓜资源的开发与利用提供了科学依据。
[1]Raikos V.Food matrix:Natural barrier or vehicle for effective delivery of carotenoids from processed foods?[J].Insights Nutr Metab.2017,1(1):1-6.
[2]Fernándezgarcía E,Carvajallérida I,Jaréngalán M,et al.Carotenoids bioavailability from foods:From plant pigments to efficient biological activities[J].Food Research International,2012,46(2):438-450.
[3]Meyers K J,Mares J A,Igo R P,et al.Genetic evidence for role of carotenoids in age-related macular degeneration in the carotenoids in age-related eye disease study(CAREDS)[J].Investigative Ophthalmology&Visual Science,2014,55(1):587-599.
[4]Ali Roohbakhsh, Gholamreza Karimi, Mehrdad Iranshahi.Carotenoids in the treatmentofdiabetes mellitus and its complications: A mechanistic review[J]. Biomedicine &Pharmacotherapy,2017,91:31-42.
[5]Sharoni Y,Linnewiel-Hermoni K,Khanin M,et al.Carotenoids and apocarotenoids in cellular signaling related to cancer:A review[J].Molecular Nutrition&Food Research,2012,56(2):259-269.
[6]Ademowo O S,Dias H K I,Milic I,et al.Phospholipid oxidation and carotenoid supplementation in Alzheimer’s disease patients[J].Free Radical Biology and Medicine,2017,108:77-85.
[7]陶俊,张上隆,徐昌杰.类胡萝卜素合成的相关基因及基因工程[J].生物工程学报,2002,18(3):276-281.
[8]张同,赵婷,惠伯棣.类胡萝卜素在食物中的分布[J].食品科学,2010,31(17):487-492.
[9]邹宇晓,肖更生.南瓜的功能性成分及保健食品开发与研究[J].中国果菜,2004,(4):47-48.
[10]李海真,贾长才,张帆.高胡萝卜素含量的南瓜育种[A].南瓜营养、保健功能与产业发展研讨会论文集[C].2004:56-60.
[11]徐佳佳,崔亚娟,姜菲菲,等.几种常见的类胡萝卜素提取技术[J].食品研究与开发,2014,32(19):141-144.
[12]付莉,王歆姬.南瓜皮类胡萝卜素的提取工艺研究[J].中国农学通报,2012,28(36):295-299.
[13]宋曙辉,薛颖.高效液相色谱法测定蔬菜中的类胡萝卜素[J].华北农学报,2001,16(3):92-97.
[14]曲斌,耿士伟,冯群科,等.超高效液相色谱测定鸡饲料中的5种类胡萝卜素添加剂[J].江苏农业科学,2014,42(9):273-275.
[15]Suzuki K,Kamimura A,Stanford B.Hooker.Rapid and highly sensitive analysis of chlorophylls and carotenoids from marine phytoplankton using ultra-high performance liquid chromatography(UHPLC)with the first derivative spectrum chromatogram(FDSC)technique[J].Marine Chemistry,2015,176(20):96-109.
[16]李文爽,夏先春,何中虎.普通小麦类胡萝卜素组分的超高效液相色谱分离方法[J].作物学报,2016,42(5):706-713.
[17]陈敏氡,朱海生,温庆放,等.UPLC测定草莓果实中类胡萝卜素含量[J].果树学报,2013,30(4):706-711.
[18]惠伯棣.类胡萝卜素化学及生物化学[M].北京:中国轻工业出版社,2005:68-71.
[19]颜少宾,张妤艳,马瑞娟,等.桃果实类胡萝卜素测定方法的研究[J].果树学报,2012,29(6):117-1133.
[20]莫玉楠,张鲁刚,王国芳.橙色大白菜类胡萝卜素提取与测定方法研究[J].西北农林科技大学学报:自然科学版,2014,42(3):206-214.
[21]Rodriguezamaya D B.Some considerations in generating carotenoid data for food composition tables[J].Journal of Food Composition&Analysis,2000,13(4):641-647.
[22]胡建中,王可兴.高效液相色谱法测定柑橘汁中类胡萝卜素[J].食品科学,2006,27(12):634-636.
Analysis of Carotenoids Contents in Pumpkin by Ultra Performance Liquid Chromatography
Wang Bin1,2,Lin Liang3,Chen Mindong1,2,Liu Jianting1,2,Ye Xinru1,2,Zhu Haisheng1,2,Wen Qingfang1,2
(1Vegetable Research Center,Fujian Academy of Agricultural Sciences,Fuzhou 350013,Fujian,China;2Crops Research Institute,Fujian Academy of Agricultural Sciences,Fuzhou 350013,Fujian,China;3Lianjiang County Bureau of Agriculture,Lianjiang 950500,Fujian,China)
Carotenoids are a kind of important natural pigments.In order to analyze the compositions and contents of carotenoids in pumpkin,pumpkin flesh was used as the material,different solvents(methanol,ethanol,petroleum ether,acetone,acetone:petroleum ether(1:1),acetone:petroleum ether(1:2)and acetone:petroleum ether(1:4))and extraction methods(saponification and unsaponification)were screened to optimize the carotenoids extraction conditions in pumpkin flesh.Ultra Performance Liquid Chromatography(UPLC)technology was used to determine the carotenoid compositions and contents of 23 pumpkin cultivars.The results showed that the suitable extraction for carotenoids in pumpkin was ethanol solvent with saponification.Pumpkin flesh contained three carotenoid compositions,β-carotene,α-carotene and lutein,and the compositions and contents were both different in interspecies and intraspecies.Most of Cucurbita maxima and Cucurbita moschata cultivars had higher total carotenoid contents than Cucurbit pepo cultivars.The optimized extraction and determination methods in this study are suitable to the quality and quantity analysis of pumpkin flesh in China.
Pumpkin;Carotenoids;Ultra Performance Liquid Chromatography(UPLC);Composition;Content
S642.1
A论文编号:cjas17110028
福建省科技计划项目—省属公益类科研院所基本科研专项(2015R1026-3)。
王彬,男,1989年出生,研究实习员,硕士,主要从事南瓜栽培和育种研究。通信地址:350003福建省福州市五四路247号福建省农业科学院高新大楼17楼1711室,E-mail:137535738@qq.com。
朱海生,男,1978年出生,安徽枞阳人,副研究员,博士,主要从事蔬菜遗传与育种研究。通信地址:350003福建省福州市五四路247号福建省农业科学院高新大楼17楼1711室,E-mail:zhs0246@163.com。温庆放,男,1965年出生,福建永泰人,研究员,本科,主要从事蔬菜栽培和育种研究。通信地址:350003福建省福州市五四路247号福建省农业科学院高新大楼17楼1711室,E-mail:fjvrc@163.com。
2017-07-17,
2017-08-14。
