姜黄素治疗幼年小鼠脑外伤的实验研究
2018-01-04李杰李珍程田
李 杰 李 珍 程 田
1) 开封市儿童医院儿童重症监护室,河南 开封 475000 2)开封市儿童医院急诊科,河南 开封 475000 3)郑州大学第一附属医院,河南 郑州 450000
·论著科研之窗·
姜黄素治疗幼年小鼠脑外伤的实验研究
李 杰1)李 珍2)程 田3)△
1) 开封市儿童医院儿童重症监护室,河南 开封 475000 2)开封市儿童医院急诊科,河南 开封 475000 3)郑州大学第一附属医院,河南 郑州 450000
目的探讨幼年小鼠脑外伤后应用姜黄素(CCM)治疗是否具有神经保护和促进神经再生的作用。方法将92只C57BL/6小鼠随机分为3组,建立自由落体脑外伤动物模型,并分为假手术(Sham)组,脑外伤+生理盐水(TBI+Vehicle)组,脑外伤+姜黄素(TBI+CCM)组。尼氏染色观察大脑损伤体积,mNSS评分评价小鼠的运动功能,干湿称重法检测小鼠损伤侧大脑水含量,Edu染色观察SGZ区神经再生,Western blot 检测β-catenin和GSK3β蛋白表达。结果幼年小鼠脑外伤后,CCM治疗可减少大脑损伤体积,改善运动功能, 明显增加Edu阳性细胞数,减少GSK3β的表达,同时增加β-catenin的表达(P<0.05)。结论幼年小鼠脑外伤后应用CCM治疗能间接激活Notch通路,同时具有神经保护和促进神经再生的作用,为今后治疗儿童脑外伤提供新的思路。
幼年小鼠;脑外伤;姜黄素;神经保护;神经再生
脑外伤(Traumatic brain injury,TBI)是由外力导致的大脑损伤。儿童脑外伤的发生率为2%~3%[1],脑外伤后遗留的运动、认知和精神障碍仍会给家庭和社会带来沉重的经济负担和精神负担,目前尚未发现行之有效的治疗方法[2]。姜黄素(curcumin,CCM)是姜科姜黄属植物根茎的主要成分,医学研究表明,姜黄素具有降血脂、抗肿瘤、抗炎、利胆、抗氧化等作用。随后发现其在神经系统疾病中也有较好的效果,如阿尔茨海默病、帕金森病和神经系统肿瘤等[3],但关于姜黄素治疗儿童脑外伤的研究未见报道。本实验中,我们拟用新生21 d小鼠脑外伤模型模拟儿童脑外伤,mNSS评分评价小鼠运动功能[4],同时应用EdU(5-ethynyl-2'-deoxyuridine)[5]染色观察海马体齿状回颗粒下层(subgranular zone of the lateral ventricles,SGZ)神经再生情况,探讨幼年小鼠脑外伤后运动,Notch通路表达及SGZ区神经再生情况,并观察CCM在神经再生和神经保护中的作用。
1 材料与方法
设计:随机对照动物实验。时间及地点:实验于2015-01—2016-01郑州大学实验中心完成。
1.1实验动物和分组C57BL/6小鼠92只(3周)随机分为3组:假手术(Sham)组,脑外伤+生理盐水(TBI+Vehicle)组,脑外伤+(TBI+CCM)组。其中Sham组30只,TBI+Veh组31只,TBI+CCM组31只。
1.2动物模型的建立模型建立前,应用10%水合氯醛3 mL/kg进行麻醉,待麻醉成功后,备皮,酒精消毒,并将小鼠固定于脑立体定位仪上,采用改良式自由落体脑外伤动物模型[6]击打小鼠。Sham组只开骨窗,不予打击,缝合。打击后3 h,TBI+CCM组小鼠给予腹腔注射CCM(2 mol/kg),1次/d。TBI+Veh组给予同体积生理盐水。进行EdU染色的小鼠,在脑外伤24 h后腹腔注射EdU(50 mmg/kg),1次/d,第3次注射后4 h处死小鼠。
1.3运动功能评分脑外伤后应用mNSS(modifi-ed neurologic severity score)评分,评价小鼠运动功能[4]。mNSS评分标准是从小鼠运动、感觉、平衡能力及反射情况等方便进行评估。分别在1 d、3 d、7 d、14 d、21 d和28 d给予mNSS评分检测,采用双盲法评判并记录分值。
1.4脑水含量的测量脑外伤后3 d,小鼠麻醉后处死,快速取出损伤的左侧半脑,称取湿质量。随后将脑组织放入烤箱,100 ℃,48 h后称得干质量。根据公式得到大脑水含量,以判定大脑水肿程度。大脑脑水含量(%)=(湿质量-干质量)/湿质量×100%。
1.5尼氏染色和大脑损伤体积计算按照尼氏染色步骤进行尼氏染色,在显微镜下获得染色图像,用Image J 软件分析每个脑片大脑的缺损面积。缺损体积(mm3)=平均缺损面积× 0.025 ×10 × N。
1.6 EdU染色按EdU染色试剂盒(Thermofish-er)操作步骤进行染色,然后用4,6-diamidino-2-phenylindole (DAPI)染色显示细胞核。在荧光显微镜下观察实验结果。
1.7 Western Blot检测TBI后第3天,麻醉小鼠,灌注取损伤侧脑组织,使用蛋白提取试剂盒提取损伤组织蛋白,NanoQ仪器测量蛋白浓度,加入溴化乙锭,金属浴煮好备用。按照Western blot试剂盒说明书步骤进行实验[7],使用Image J软件分析实验结果。
2 结果
2.1 CCM治疗幼年小鼠脑外伤,可减少损伤体积,改善运动功能,未明显减少脑水含量TBI术后28 d,脑组织切片尼氏染色,计算大鼠大脑损伤体积(图1A,10×)。结果显示TBI+Veh组损伤体积为(10.91±0.87)mm3,高于TBI+CCM组的(7.94±1.05)mm3,2组差异有统计学意义(P<0.05,n=6/组)。脑外伤后14 ~28 d,经CCM治疗后,小鼠的mNSS评分显著降低(P<0.05,n=6/组,图1B)。脑外伤3 d后,大脑水含量可以显著增加。由TBI+Sham组的(76.06 ± 0.93)%增加到TBI+Veh组的(80.63±0.91)%(P<0.05)。经CCM治疗,大脑水含量减至(79.52±1.06)%,和TBI+Veh组相比,未见明显统计学差异(P>0.05,n=6/组,图1C)。

图1 TBI后CCM减少大脑损伤体积,改善运动功能,未明显减少脑水含量
2.2 CCM治疗幼年小鼠脑外伤,可减少GSK3β的表达,并增加β-catenin的表达脑外伤后,应用CCM治疗3 d后,Western blot 结果显示,TBI+CCM组中β-catenin表达高于Vehicle治疗组,而GSK3β在CCM治疗组中的表达量明显少于Vehicle治疗组(P<0.05,n=6/组,见图2)。证实脑外伤后CCM治疗可减少GSK3β表达,同时间接激活Wnt通路,增加β-catenin的表达。
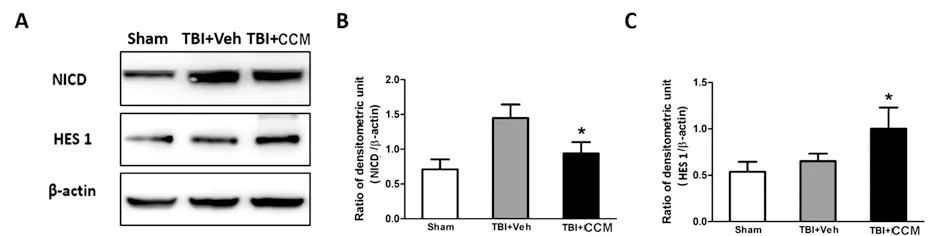
图2 CCM治疗脑外伤,减少GSK3β表达,增加β-catenin表达,减少损伤周围细胞坏死
2.3 CCM治疗幼年小鼠脑外伤,增加海马区神经再生用EdU染色标记海马区增殖的神经干细胞,结果发现,脑外伤后3 d,TBI+CCM组小鼠海马SGZ区的EdU阳性细胞数,明显高于Vehicle治疗组(P<0.05,n=6/组,见图3)。

图3 CCM治疗脑外伤,增加SGZ区神经干细胞增殖
3 讨论
儿童脑外伤是一种常见的儿童疾病,至今仍无一种有效的方法进行治疗。近期发现,CCM具有神经保护作用,但至今尚无应用CCM治疗儿童脑外伤的相关报道。我们应用幼年小鼠脑外伤模型模拟儿童脑外伤,并观察脑外伤28 d后,小鼠成年后的运动功能改变,检测CCM的疗效,结果发现:(1)应用CCM治疗幼年小鼠脑外伤,可减少小鼠大脑损伤体积,改善小鼠运动功能;(2)CCM治疗可间接激活Notch通路,促进神经再生。研究表明Notch通路是神经再生中的重要通路,调节SGZ区和SVZ去神经干细胞的增殖和分化[8]。在此实验中,姜黄素治疗脑外伤可增加SGZ区神经干细胞的增殖,促进神经再生。同时,CMM有抗炎、抗氧化和清除自由基等广泛药理活性,有研究表明其对帕金森、癫痫等多种中枢神经系统疾病具有一定的神经保护作用[9]。通过此研究,我们发现姜黄素在治疗幼年小鼠脑外伤中的神经保护和促进神经再生的重要作用,为今后TBI后促进神经再生,改善认知能力的临床治疗效果奠定基础。而关于SGZ区神经干细胞的分化及成熟情况,我们将在以后做进一步的研究。
[1] Maegele M,Engel D,Bouillon B,et al.Incidence and outcome of traumatic brain injury in an urban area in Western Europe over 10 years[J].Eur Surg Res,2007,39(6):372-379.doi:10.1159/000107097.PubMed PMID:17690556.
[2] Fenn AM,Gensel JC,Huang Y,et al.Immune activation promotes depression 1 month after diffuse brain injury:a role for primed microglia[J].Biol Psychiatry,2014,76(7):575-584.doi:10.1016/j.biopsych.2013.10.014.PubMed PMID:24289885;PubMed Central PMCID:PMC4000292.
[3] Semple BD,Noble-Haeusslein LJ,Gooyit M,et al.Early Gelatinase Activity Is Not a Determinant of Long-Term Recovery after Traumatic Brain Injury in the Immature Mouse[J].PloS One,2015,10(11):e0143386.doi:10.1371/journal.pone.0143386.PubMed PMID:26588471;PubMed Central PMCID:PMCPMC4654502.
[4] Koprowski S,Sokolowski K,Kunnimalaiyaan S,et al.Curcumin-mediated regulation of Notch1/hairy and enhancer of split-1/survivin:molecular targeting in cholangiocarcinoma[J].J Surg Res,2015,198(2):434-440.doi:10.1016/j.jss.2015.03.029.PubMed PMID:25890434.
[5] Cheng T,Yang B,Li D,et al.Wharton's Jelly Transplantation Improves Neurologic Function in a Rat Model of Traumatic Brain Injury[J].Cell Mol Neurobiol,2015,35(5):641-649.doi:10.1007/s10571-015-0159-9.PubMed PMID:25638565;PubMed Central PMCID:PMC4481175.
[6] Pillat MM,Cheffer A,de Andrade CM,et al.Bradykinin-induced inhibition of proliferation rate during neurosphere differentiation:consequence or cause of neuronal enrichment? Cytometry Part A:the journal of the International[J].Cytometry A,2015,87(10):929-935.doi:10.1002/cyto.a.22705.PubMed PMID:26189685.
[7] Wu MV,Hen R.The young and the restless:regulation of adult neurogenesis by Wnt signaling[J].Cell Stem Cell,2013,12(2):139-140.doi:10.1016/j.stem.2013.01.013.PubMed PMID:23395437;PubMed Central PMCID:PMC3635106.
[8] Subramaniam D,Ponnurangam S,Ramamoorthy P,et al.Curcumin Induces Cell Death in Esophageal Cancer Cells through Modulating Notch Signaling[J].PloS One,2012,7(2):e30590.doi:10.1371/journal.Pone.0030590.Epub2012Feb17.
[9] Surgucheva I,He S,Rich MC,et al.Role of synucleins in traumatic brain injury-an experimental in vitro and in vivo study in mice[J].Mol Cell Neurosci,2014,63:114-123.doi:10.1016/j.mcn.2014.10.005.PubMed PMID:25447944.
[10] Bordiuk OL,Smith K,Morin PJ,et al.Cell proliferation and neurogenesis in adult mouse brain[J].PloS One,2014,9(11):e111453.doi:10.1371/journal.pone.0111453.PubMed PMID:25375658;PubMed Central PMCID:PMC4222938.
[11] Cheng T,Wang W,Li Q,et al.Cerebroprotection of flavanol (-)-epicatechin after traumatic brain injury via Nrf2-dependent and-independent pathways[J].Free Radic Biol Med,2016,92:15-28.doi:10.1016/j.freeradbiomed.2015.12.027.PubMed PMID:26724590;PubMed Central PMCID:PMC4769660.
[12] Muccigrosso MM,Ford J,Benner B,et al.Cognitive deficits develop 1month after diffuse brain injury and are exaggerated by microglia-associated reactivity to peripheral immune challenge[J].Brain Behav,immun,2016,54:95-109.doi:10.1016/j.bbi.2016.01.009.PubMed PMID:26774527;PubMed Central PMCID:PMC4828283.
[13] Zhuang J,Wei Q,Lin Z,et al.Effects of ADAM10 deletion on Notch-1 signaling pathway and neuronal maintenance in adult mouse brain[J].Gene,2015,555(2):150-158.doi:10.1016/j.gene.2014.10.056.PubMed PMID:25445276.
[14] Ables JL,DeCarolis NA,Johnson MA,et al.Notch1 Is Required for Maintenance of the Reservoir of Adult Hippocampal Stem Cells[J].J Neurosci,2010,30(31):10 484-10 492.doi:10.1523/Jneurosci.4721-09.2010.PubMed PMID:WOS:000280789600022.
[15] Hackler L,Jr,Ozsvari B,Gyuris M,et al.The Curcu-min Analog C-150,Influencing NF-kappaB,UPR and Akt/Notch Pathways Has Potent Anticancer Activity In Vitro and In Vivo[J].PloS One,2016,11(3):e0149832.Epub 2016/03/05.doi:10.1371/journal.pone.0149832.PubMed PMID:26943907;PubMed Central PMCID:PMCPmc4778904.
[16] Singh AK,Sharma N,Ghosh M,et al.Emerging importance of dietary phytochemicals in fight against cancer:Role in targeting cancer stem cells[J].Crit Rev Food Sci,2017,57(16):3 449-3 463.doi:10.1080/10408398.2015.1129310.PubMed PMID:WOS:000402081300008.
TheroleofCCMontraumaticbraininjuryinyoungmice
LIJie*,LIZhen,CHENGTian
*DepartmentofPICU,Children'sHospitalofKaifengcity,Kaifeng475000,China
ObjectiveTo detect whether CCM could protect the brain after TBI.Methods92 C57BL/6 mice were divided into 3 groups randomly:Sham group,TBI+Vehicle (NaCl) group and TBI+CCM group.Construct the weight drop model which could mimic TBI.The lesion volume,motor and cognition function,the expression of β-catenin and GSK3β protein,the cell death near injury area and the neurogenesis in SGZ area were detected in each group.ResultsCCM treatment could decrease the volume of brain injury, improve motor function, significantly increase the number of Edu positive cells, reduce the expression of GSK3β, while increasing the expression of β-catenin (P<0.05).ConclusionIn the young mice TBI model,CCM decreased the lesion volume,promoted the motor and the cognition function,activated Notch pathway indirectivity,reduced the cell death near injury area,increased the neurogenesis in SGZ area and promoted a new method to treat TBI in young mice.
Young mice;Traumatic brain injury;CCM;Neuroprotection;Nerve regeneration
10.3969/j.issn.1673-5110.2017.22.001
郑州大学第一附属医院院内青年基金,项目编号:YNQN2017042
△通信作者:程田(1982—),博士,主治医师。研究方向:脑、脊髓神经损伤及修复。Email:chengtianzy@163.com
R-332
A
1673-5110(2017)22-0001-04
(收稿2017-05-11)
王喜梅
