颅内未破裂动脉瘤介入术后微小脑梗死灶形成的危险因素分析
2018-01-04夏鹏飞王伟邹亮李双
夏鹏飞 王伟 邹亮 李双
颅内未破裂动脉瘤介入术后微小脑梗死灶形成的危险因素分析
夏鹏飞 王伟 邹亮 李双
目的探讨颅内未破裂动脉瘤(unruptured intracranial aneurysms,UIA)介入术后微小脑梗死形成的危险因素。方法将238例经血管内介入弹簧圈栓塞的颅内UIA患者介入术后行核磁共振平扫检查,并根据检查表现分为无微小脑梗死灶组150例和有微小脑梗死灶组88例,对其临床资料进行回顾性分析;采用χ2检验、t检验及logistic回归分析UIA介入术后微小脑梗死灶形成的危险因素。结果UIA介入术后微小脑梗死灶的患者有37%,其中3%的微小脑梗死患者有相应的临床症状。Logistic回归分析显示2组患者年龄(P<0.001)、高血压病史(P=0.023)、糖尿病史(P=0.048)、脑卒中病史(P<0.001)及手术时间(P=0.007)是UIA介入术后微小脑梗死灶发生的危险因素。结论年龄、高血压病、糖尿病、脑卒中病史及手术时间是UIA介入术后微小脑梗死灶形成的危险因素。
颅内未破裂动脉瘤 介入治疗 微小脑梗死灶 危险因素
随着血管内介入栓塞技术的进步,UIA的血管内介入治疗已得到广泛的应用。但随着该项技术的开展,其围手术期的并发症报道也逐渐增多[1]。国外研究报道,有10%~76.5%的未破裂动脉瘤介入栓塞治疗后会出现微小脑梗死灶[2]。虽然大部分患者没有明显的临床症状,但提示术中脑组织受到损伤,其潜在的危险不容忽视。本研究采用单因素结合多因素的分析方法回顾性分析238例行血管内介入手术治疗的UIA患者,对可能造成微小脑梗死灶的危险因素进行分析和探索,为预防和治疗未破裂动脉瘤介入术后引发的微小脑梗死提供理论依据。
1 资料与方法
1.1 一般资料
回顾性连续纳入2010年5月~2016年1月在内蒙古民族大学附属医院及内蒙古民族大学第二临床医学院神经外科住院并经血管内介入弹簧圈栓塞颅内UIA患者247例,其中3例患者拒绝术后行核磁共振平扫检查、4例患者在检查中不配合以及2例有心脏起搏器存在核磁共振检查禁忌症未被纳入研究。按照UIA血管内介入治疗后经核磁共振平扫检查是否存在新发微小脑梗死灶将患者分为无微小脑梗死组(150例)与有微小脑梗死灶组(88例)。微小脑梗死灶包括年龄、性别、身体质量指数(body mass index,BMI)、高血压病、糖尿病、血脂异常、饮酒史、吸烟史、脑卒中病史、冠心病史、血小板P2Y12受体反应单位(P2Y12reaction units,PRU)、凝血时间、多发动脉瘤、动脉瘤位置、动脉瘤最大直径、动脉斑块粥样硬化、介入弹簧圈数、多微导管技术、治疗方案(单纯弹簧圈栓塞、支架辅助技术栓塞、球囊辅助技术栓塞)、术中动脉瘤破裂、术中血栓事件、手术时间等。
1.2 治疗
所有患者均在术前3 d及术后应用抗血小板聚集药物(阿司匹林100 mg,1次/d+氯吡格雷75 mg,1次/d),术中常规肝素化,并于全麻下行数字减影血管造影了解动脉瘤的位置、大小、个数等,并根据数字减影血管造影表现具体制定血管内治疗方案,行血管内介入栓塞治疗,分为单纯弹簧圈栓塞、支架辅助技术栓塞以及球囊辅助技术栓塞。本研究采用阿司匹林肠溶片(拜阿司匹林,拜尔公司);硫酸氢氯吡格雷片(波立维,赛诺菲安万特公司)。
1.3 诊断
UIA的诊断:所有UIA患者均经CT血管造影、核磁共振血管造影或数字减影血管造影检查确诊。微小脑梗死灶的诊断:UIA患者经血管内治疗后6~24 h内行核磁共振平扫检查,且确诊为术后新发脑梗死,新发脑梗死灶在核磁共振弥散成像(diffusion weighted imaging,DWI)上表现为点状高信号,在表观扩散系数(apparent diffusion coeffecient,ADC)上表现为弥散受限。微小脑梗死灶包含Adama分型法中的小梗死(直径l.5~3cm)和腔隙性梗死(直径≤l.5cm)。本研究核磁共振检查采用美国GE HDx 3.0T全身双梯度超导磁共振扫描仪,并由1位专业的影像科医师评估。
1.4 统计学处理
采用SPSS19.0软件,计量资料进行t检验,计数资料进行卡方检验,对有显著差异变量进行二元Logistic回归分析,以P<0.05为差异具有统计学意义。
2 结 果
2.1 UIA介入术后发生微小脑梗死灶临床症状 238例介入术后患者均成功栓塞动脉瘤,其中88例有脑梗死灶的患者中85例无明显的神经功能障碍,3例有神经功能障碍的患者中1例为纯运动性轻偏瘫,1例构音障碍-手笨拙综合症,1例为纯感觉障碍。
2.2 UIA介入术后发生微小脑梗死灶的单因素分析 单因素分析显示,2组患者性别、BMI、血脂异常、饮酒史、吸烟史、冠心病史、PRU、凝血时间、动脉瘤位置、动脉瘤最大直径、介入弹簧圈数、多微导管技术、治疗方案、术中动脉瘤破裂、术中血栓事件各项指标无明显差异。2组患者年龄(P<0.001)、高血压病史(P=0.04)、糖尿病史(P=0.004)、脑卒中病史(P<0.001)、多发动脉瘤(P=0.012)、动脉斑块粥样硬化(P=0.009)及手术时间(P=0.007)有明显差异(表1)。
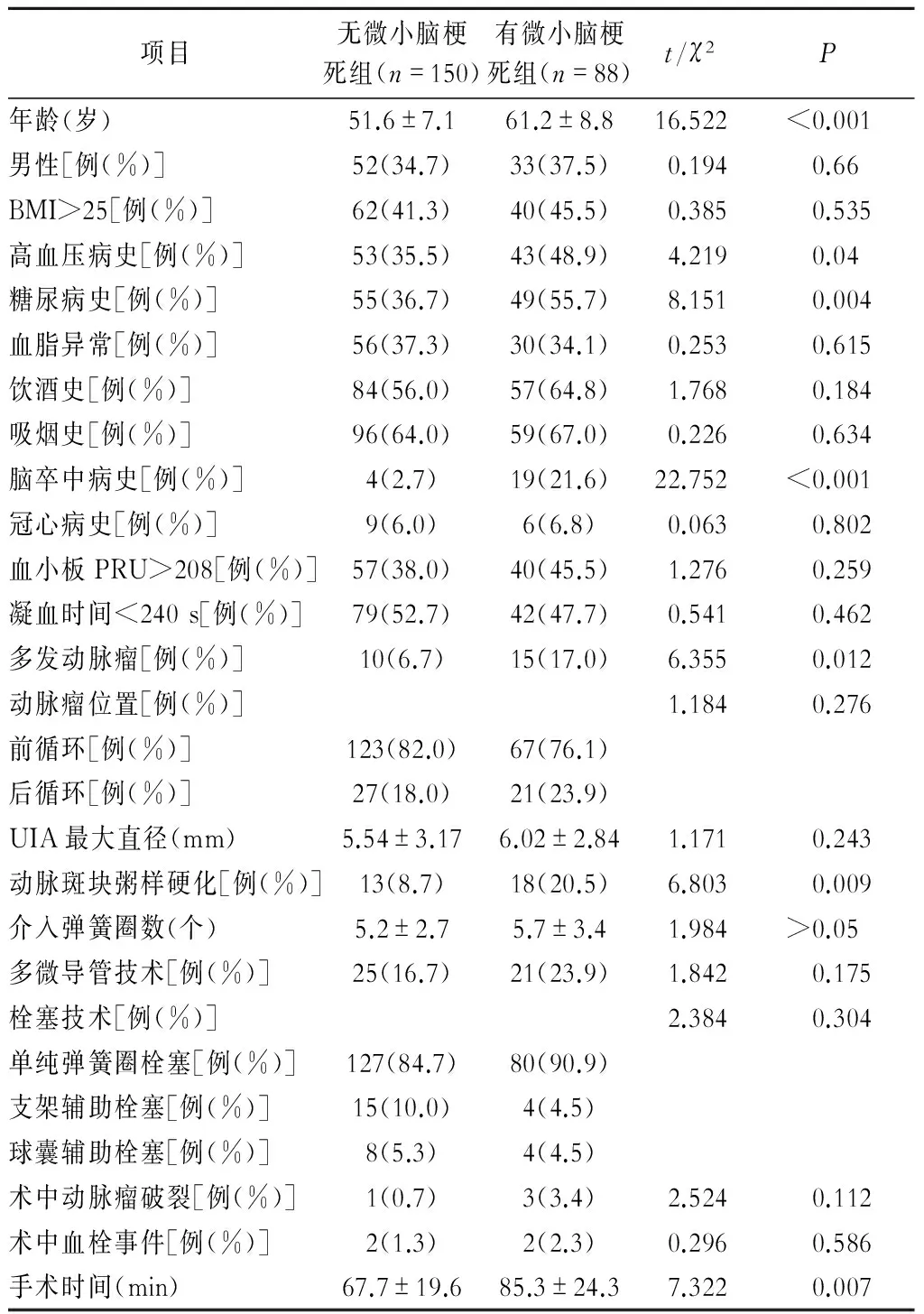
表1 UIA介入术后发生微小脑梗死灶的单因素分析
2.3 UIA介入术后发生微小脑梗死灶的危险因素的多因素分析 影响UIA介入术后形成微小脑梗死灶的单因素分析中对7个有意义的变量(年龄、高血压病、糖尿病、脑卒中病史、多发动脉瘤、动脉斑块粥样硬化及手术时间)进行Logistic回归分析显示,2组患者多发动脉瘤及动脉斑块粥样硬化无明显差异,患者年龄(P<0.001)、高血压病史(P=0.023)、糖尿病史(P=0.048)、脑卒中病史(P<0.001)及手术时间(P=0.007)是UIA介入微小脑梗死灶发生的危险因素(表2)。

表2 UIA介入术后发生微小脑梗死灶的多因素分析
3 讨 论
随着人们对UIA认识的提高及各种诊断、治疗方法的发展,UIA的检出率及治疗率明显呈上升趋势[3],随之而来的手术并发症也越来越引起人们的关注,介入术后的微小脑梗死灶的检出率也随之增高。本研究结果显示UIA介入术后微小脑梗死灶的患者有37%,其中有97%的患者无明显神经功能障碍,3%的微小脑梗死患者有相应的临床症状,这与Kang等的研究[4]相同。DeCarli[5]认为微栓子引起的无症状脑缺血可能会导致认知功能下降,甚至痴呆。因此,无论是否有明显的临床症状,DWI上高信号是症状性脑缺血的一个代表性标志,都提示术中的脑组织受到损伤,其潜在的危险不容忽视。
国外学者认为UIA介入术后DWI上的高信号病灶与微小的血栓、不稳定的动脉粥样硬化斑块及手术操作过程中引起的损伤有关[6],但是关于微小脑梗死形成的危险因素的观点并不一致,但都认为年龄是重要的危险因素[4,7]。本研究单因素分析显示年龄、高血压病史、糖尿病史、脑卒中病史、多发动脉瘤、动脉斑块粥样硬化及手术时间可能是引发微小脑梗死灶的危险因素,但在多因素分析中排除了多发动脉瘤及动脉斑块粥样硬化,考虑多发动脉瘤可能增加了手术的复杂性,一次性栓塞多个动脉瘤增加了手术的难度且不可避免的增加了手术时间,增大了术中操作的风险性,而动脉斑块粥样硬化可能影响了动脉瘤或增加了手术相关辅助过程的复杂性。Hahnemann等[2]通过对75例介入栓塞治疗后的DWI高信号UIA患者的研究发现高龄及手术时间过长都是微小脑梗死的危险因素。Park等[8]通过对271例介入患者的研究发现高龄、糖尿病史、脑卒中病史也是微小脑梗死的危险因素,这与本研究结果相符。本研究发现高血压病史也是介入术后微小脑梗死的危险因素,这并未在相关资料中有所体现,其原因可能为高血压使血管内皮损伤,刺激血管平滑肌细胞增殖,破坏了机体原本的凝血与纤溶系统的动态平衡,激发血栓形成,导致血管的闭塞与狭窄,且血压升高可引起器官组织血液灌注量下降,直接损伤血管组织并加重靶器官损害,易造成脑部微小血管病变,从而形成微小脑梗死灶。
Matsushige等[9]通过对术前应用的抗血小板聚集药物的研究发现,抗血小板聚集药物的应用可以减少微小脑梗死的发生。本研究患者术前应用双抗药物且术中严格肝素化使术后微小脑梗死灶的的发生率由普遍的50%左右[2,7,9,10]降到了37%。可见双抗药物及肝素的应用是非常重要的因素,这与Lim等研究[11]相同,但是本研究术前就常规应用,所以并未作为危险因素加以讨论。
本研究结果表明年龄、高血压病史、糖尿病史、脑卒中病史、多发动脉瘤、动脉斑块粥样硬化及手术时间是UIA患者介入术后微小脑梗死灶发生的危险因素。了解UIA介入术后微小脑梗死的危险因素,可以提高微小脑梗死高危患者的诊断率,从而尽早地发现并给予适当的治疗,以积极地预防脑组织损伤。但本研究入组样本量小且随访时间短,故影响了结论的可靠性,尚需要大样本、多中心的临床试验提供更多佐证。
[1] 陈三送,方兴根,李真保,等.Enterprise支架辅助颅内动脉瘤并发症原因分析及处理[J].中国脑血管病杂志,2015,12(8):421-425.
[2] Hahnemann ML,Ringelstein A,Sandalcioglu IE,et al.Silent embolism after stent-assisted coiling of cerebral aneurysms: diffusion-weighted MRI study of 75 cases[J].J Neurointerv Surg,2014,6(6):461-465.
[3] Hloba MV.Prognostication of ischemic complications of cerebral vasospasm in surgical treatment of intracranial aneurysm in acute period of its rupture[J].Klin Khir,2014,9(9):44-47.
[4] Kang DH,Kim BM,Kim DJ,et al.MR-DWI-positive lesions and symptomatic ischemic complications after coiling of unruptured intracranial aneurysms[J].Stroke,2013,44(3):789-791.
[5] Decarli C.Clinically asymptomatic vascular brain injury: a potent cause of cognitive impairment among older individuals[J].J Alzheimers Dis,2013,33(Suppl 1):S417-S426.
[6] Lee DH,Hwang SM,Lim OK,et al.In vitro observation of air bubbles during delivery of various detachable aneurysm embolization coils[J].Korean Journal of Radiology,2012,13(4):412-416.
[7] Sim SY,Shin YS.Silent microembolism on diffusion-weighted MRI after coil embolization of cerebral aneurysms[J].Neurointervention,2012,7(2):77-84.
[8] Park JC,Lee DH,Kim JK,et al.Microembolism after endovascular coiling of unruptured cerebral aneurysms: incidence and risk factors[J].J Neurosurg,2016,124(3):777-783.
[9] Matsushige T,Kiura Y,Sakamoto S,et al.Multiple antiplatelet therapy contributes to the reversible high signal spots on diffusion-weighted imaging in elective coiling of unruptured cerebral aneurysm[J].Neuroradiology,2013,55(4):449-457.
[10] Kono K,Shintani A,Yoshimura R,et al.Triple antiplatelet therapy with addition of cilostazol to aspirin and clopidogrel for Y-stent-assisted coil embolization of cerebral aneurysms[J].Acta Neurochir (Wien),2013,155(8):1549-1557.
[11] Lim Fat MJ,Al-Hazzaa M,Bussi re M,et al.Heparin dosing is associated with diffusion weighted imaging lesion load following aneurysm coiling[J].J Neurointerv Surg,2013,5(4):366-370.
Riskfactorsofmicroembolismafterendovascularcoilingforunrupturedintracranialaneurysms
XiaPengfei,WangWei,ZouLiang,etal.
DepartmentofNeurology,TheSecondClinicalMedicalschoolofInnerMongoliaUniversityfortheNationalities,Yakeshi022150
ObjectiveTo investigate the risk factors of microembolism after endovascular coiling for unruptured intracranial aneurysms (UIA).Methods238 patients suffered UIA for coil embolization inciuding microembolism negative group (n=150) and microembolism positive group (n=88), were examined by the MRI. Their clinical data were selected and analyzed respectively. Chisquare test, T test and Logistic regression analysis were used to analyze the risk factors of microembolism after endovascular coiling for UIA.ResultsThe total rate of microembolism after endovascular coiling was 37%, in the microembolism positive group the total rate of neurological complication was 3%. Age(P<0.001),hypertension(P=0.023),hyperglycemia(P=0.048),previous stroke history(P<0.001)and procedure duration(P=0.007) were associated significantly with microembolism positive and they were the risk factors of microembolism after endovascular coiling for UIA which were proved by the logistic regression model.ConclusionAge, hypertension, hyperglycemia, previous stroke history and procedure duration were the risk factors of microembolism after endovascular coiling of UIA.
UIA Interventional therapy Microembolism Risk factors
R743.3
A
1007-0478(2017)06-0508-04
10.3969/j.issn.1007-0478.2017.06.007
022150 内蒙古呼伦贝尔市内蒙古民族大学第二临床医学院神经外科[夏鹏飞 王伟(通信作者) 邹亮 李双]
(2017-03-08收稿)
