基于漂洗工艺探究白鲢鱼糜加工过程中蛋白质氧化规律
2018-01-03袁凯张龙谷东陈樊震宇王锡昌李钰金刘远平
袁凯,张龙,谷东陈,樊震宇,王锡昌*,李钰金,刘远平
1(上海海洋大学 食品学院,上海,201306) 2(荣成泰祥食品股份有限公司,山东 威海,264309)
基于漂洗工艺探究白鲢鱼糜加工过程中蛋白质氧化规律
袁凯1,张龙1,谷东陈1,樊震宇1,王锡昌1*,李钰金2,刘远平2
1(上海海洋大学 食品学院,上海,201306) 2(荣成泰祥食品股份有限公司,山东 威海,264309)
基于工业化鱼糜漂洗工艺,探讨白鲢鱼糜加工过程中蛋白质氧化规律,进而为肉制品加工提供科学理论依据。在不同温度(4、12、20 ℃),不同漂洗次数(1、2、3次)下,制备新鲜漂洗白鲢鱼糜,测定鱼糜羰基,总巯基含量,溶解度,Ca2+-ATPase酶活性,蛋白质降解聚集程度,蛋白质二级结构变化,综合评价蛋白质氧化变性程度。研究结果表明,鱼糜中的羰基含量随着漂洗温度升高增大,随漂洗次数积累降低;随漂洗温度升高和次数积累,蛋白无序结构的百分含量显著增加;总巯基含量和β-折叠结构的百分含量逐渐下降;漂洗处理引起肌球蛋白发生降解反应,温度升高,降解程度加剧;蛋白溶解性及Ca2+-ATPase酶活力减小;综上分析电泳结果及二级结构变化规律可作为氧化变性的良好评价指标,而选择低温(4 ℃)少漂洗(1或2次)处理能够保证鱼糜蛋白得率的同时能够效控制蛋白氧化程度。
白鲢鱼糜;漂洗;蛋白质氧化;评价指标
近年来随着海洋资源衰退,适用于鱼糜加工的海水鱼种捕获量下降,为寻求新的鱼糜加工原料并发挥我国丰富淡水鱼资源优势,研究淡水鱼糜加工并产业化已成为聚焦的热点。鲢鱼是我国产量丰富的低值淡水鱼种之一,仅2015年的年产量达到440万t[1]。选用鲢鱼(Hypophthalmichthysmolitrix)作为鱼糜加工原料能有效实现低值鱼高值化,具有巨大的经济潜力。近年来关于白鲢鱼(鲢鱼种)鱼糜的研究集中于蛋白的凝胶品质及冷冻变性方面,而关于蛋白氧化变性的研究较少,且多以体外模拟系统的研究为主,在具体加工过程中的蛋白质氧化变性规律研究鲜有报道。实际上,蛋白的氧化变性对加工肉制品特别是稳定性较差的水产肉品的品质具有重要影响作用,探究在具体加工过程中的蛋白质氧化变性规律研究有现实指导意义。本研究选用淡水鱼白鲢作为研究对象,基于工业化鱼糜漂洗工艺制备新鲜淡水鱼糜,探讨白鲢鱼糜加工过程中蛋白质氧化规律,进而控制鱼糜加工的品质。
1 材料与方法
1.1 材料与试剂
白鲢鱼(鲜活),购于上海市浦东新区古棕路农工商超市,每条鱼身长约50 cm,重约2 kg。购买后立即运至实验室冷库中进行宰杀,去头、皮、内脏、肌间刺后取背肉备用。
2,4-二硝基苯肼(DNPH)、2-硝基苯甲酸(DTNB)、聚丙烯酰胺(Acr)、Tris、TEMED、十二烷基硫酸钠(SDS)、ATP盐酸胍、米吐尔;美国Sigma试剂公司;钼酸铵、乙二胺四乙酸钠(EDTA)、无水甲醇、冰乙酸、三氯乙酸(TCA)、乙酸乙酯等,上海国药集团化学试剂有限公司;巯基乙醇、标准蛋白marker(SDS)、上海源叶生物科技有限公司。
1.2 仪器与设备
节能型恒温水浴槽DC-1015,宁波新芝生物科技有限公司;伯乐电泳仪POWERPAC,日本ATTO株式会社;实验室离心机PSB100,苏州巴托离心机制造有限公司;冷冻离心机Avanti J-26XP,美国贝克曼仪器有限公司;多点磁力加热搅拌器RT10,数显匀浆机T25,德国IKA实验设备仪器有限公司,酶标分析仪SAF-680T,上海巴玖实业有限公司;紫外可见分光光度计UV2300,上海天美科学仪器有限公司;金属浴加热器MINIT-100,杭州奥盛仪器有限公司等;红外光谱仪及单点ATR附件:Nicolet iS5,美国赛默飞世尔公司。
1.3 实验方法
1.3.1 白鲢漂洗鱼糜制备
称取新鲜白鲢鱼肉200 g,点动绞肉30 s。将搅碎的鱼肉装袋、混匀、冰浴。称取碎鱼肉20 g入置有磁力转子的小烧杯,加入4倍体积且预先调温为4 ℃的超纯水80 mL。将其放置在设定温度为4 ℃的加热式磁力搅拌器上,磁力设置为Mot 5档。恒温搅拌10 min,并静置1 min。采用双层纱布过滤漂洗肉(使用离心管收集漂洗液,冰浴保存),经脱水离心机(仿三足式离心机)对纱布包裹的漂洗肉进行脱水,得到一次漂洗鱼糜。将纱布过滤的漂洗肉继续使用该温度下超纯水漂洗10 min,经过滤,离心等步骤依次制备2、3次漂洗鱼糜。选用不同漂洗温度(4、12、20 ℃)与次数(1、2、3次)制备漂洗白鲢鱼糜共9组,记作4-1、4-2、4-3、12-1、12-2、12-3、20-1、20-2、20-3。
1.3.2 鱼糜蛋白溶液制作
称取2 g鱼糜,加入15 mL Tri-HCl(20 mmol/L,pH 7.5)缓冲液,10 000 r/min转速下间歇式均质1 min,采用单层纱布过滤匀浆液去除大颗粒,双缩脲法测定匀浆液的蛋白浓度并稀释,制得蛋白质浓度均为5 mg/mL的样品。
1.3.3 鱼糜蛋白羰基含量测定
经过漂洗处理,鱼肉中脂质及水溶性蛋白被去除,所得鱼糜的主要组分为肌原纤维蛋白。因此参照OLIVER等[2]测定肌原纤维蛋白中羰基的方法测定鱼糜中的羰基含量。
取2.5 mL质量浓度约为5 mg/mL 蛋白溶液入预冷离心管中,分别加入2 mL浓度为10 mmol/L 的2,4-二硝基苯肼(DNPH,2 mol/L HCl配置),对照组加入2 mol/L HCl。在20℃下,避光反应1 h,每隔10 min振荡1次。随后加入质量分数为20%的三氯乙酸5 mL终止反应,在9 000 r/min 转速下冷冻离心10 min,弃上清液,加入等体积比的乙酸乙酯-乙醇混合2 mL,洗涤沉淀3次,加入 10 mL盐酸胍溶液(6 mol/L、20 mmol/L Tris-HCl缓冲液配置、pH 6.5),40℃下保温20 min,待沉淀溶解,在9 000 r/min转速下冷冻离心3 min,收集上清液。羰基吸光值得测定在370 nm处,摩尔吸光系数为 21 000/[L/(mol·cm)],羰基含量表示为 nmol/mg 蛋白质。
1.3.4 鱼糜蛋白巯基含量测定
参考HAWKINS等[3]描述测定蛋白巯基的方法,分别取浓度为5 mg/mL蛋白溶液1 mL,加入9 mL Tris-HCl(20 mmol/L,pH 7.5)缓冲液内含(8 mol/L尿素,10 mmol/L EDTA,2% SDS)混合充分,取5 mL混合液,加入0.5 mL DNTB(0.2 mmol/L,Tris-HCl缓冲液配置,pH 7.0),空白组加入20 mmol/L Tris-HCl缓冲液。在30 ℃下反应25 min,巯基吸光值在412 nm处,摩尔吸光系数13 600/[L/(mol·cm)],巯基含量表示为nmol/mg 蛋白质。
1.3.5 漂洗液蛋白及鱼糜蛋白凝胶电泳(SDS-PAGE)分析
参考辛草等[4]的电泳方法并改进,将取100 μL漂洗液中,加入300 μL电泳上样液(50 mmol/L Tris-HCl,pH7.5,含有2% SDS、8 mol/L尿素、2%β-巯基乙醇)使其溶解,100 ℃下金属浴加热5 min。质量分数为5%的凝缩胶和质量分数为7.5%的分离胶,上样量10 μL,起始电压85 V,待条带进入分离胶内,设定电压135 V,测定蛋白组分分子质量。取下胶片采用R-250考马斯蓝染色法检验30 min,冰乙酸甲醇进行脱色24 h,得到还原性电泳图谱。
1.3.6 鱼糜蛋白二级结构红外光谱分析
参考HU等[5]的测定蛋白二级结构的方法。称取2 g鱼糜样品,置入小烧杯中,用透气膜封口,进行24 h冷冻干燥。将干样蛋白取出,在玛瑙研钵中捣碎后装袋备用。红外单点ATR的参数设置为扫描范围为550~4 000 cm-1;分辨率为4 cm-1;32次平行。鱼糜样本通过溴化钾压片制样,并经傅里叶红外光谱仪获取原始谱图,再经基线校准和谱图校准得到傅里叶红外光谱。谱图拟合分析是指通过PeakFit v4.12软件对FT-IR谱图中酰胺I带进行归一化和二阶导数处理后,得到四种蛋白质二级结构的比例。二阶导数处理拟合峰的中心处,底层带的峰型呈现高斯分布。谱图拟合系数需要高于0.999。
1.3.7 鱼糜蛋白溶解度测定
参考林伟伟等[6]的方法。将制备的2 g鱼糜与含有0.5 mol/L NaCl的Tris-HCl(20 mmol/L,pH 7.5)缓冲液15 mL混合,10 000 r/min均质,采用单层纱布过滤除去大颗粒及气泡,制备9个样品匀浆液。在4 ℃下充分搅拌均匀30 min后在4 ℃下6 000 r/min离心10 min,分别收集上清液。匀浆液和上清液中蛋白含量利用双缩脲法测定,溶解度表示为上清液中蛋白质含量与总蛋白含量的百分比。
1.3.8 鱼糜蛋白Ca2+-ATPase活性的测定
参考张龙等[7]的方法。将鱼糜匀浆液与ATP反应液混合,反映体系中含1 mg/mL蛋白,1 mmol/L的ATP,5 mmol/L的CaCl2,0.5 mol/L的KCl,25 mmol/L的Tris-HCl(pH 7.0)。在20 ℃条件下反应25 min,取1 mL反应液中,并加入0.5 mL 15%高氯酸溶液终止反应。采用钼酸铵法 (0.5 mL的上清液中依次加入0.25 mL ELON,1.75 mL钼酸反应45 min后在OD值640 nm下测定吸光值)测定释放的无机磷(Pi)含量。蛋白的Ca2+-ATPase活性单位是μmol Pi/mg·min,表示1 mg蛋白在1 min里分解ATP生成无机磷酸的μmol数。
1.4 数据的表示方法
本实验重复3次,采用SPSS 20.0软件进行数据显著性分析,采用Origin 8.0软件绘图。
2 结果与分析
2.1 鱼糜蛋白羰基含量变化
白鲢鱼肉在漂洗过程中,肌肉组织被均匀分散在溶液中,增大了氧气、金属离子、脂质氧化衍生物与蛋白质分子表面的接触机会,为蛋白质氧化提供了条件。蛋白质羰基化是蛋白质复杂的氧化变性形式的一种,目前作为评价蛋白氧化最广泛的指标[7]。脂肪族氨基酸侧链残基被直接氧化,多肽骨架β-片段化,蛋白质与还原糖反应,与非蛋白羰基结合是产生羰基的四个主要途径[8]。
如图1所示,经过漂洗处理,鱼糜羰基含量为0.25~3.40 nmol/mg蛋白,测量数值与李学鹏等[9]测得经低浓度羟自由基氧化体系(H2O2浓度为1 mmol/L)作用不同时间后新鲜六线鱼肌原纤维蛋白中的羰基含量结果相似。结果表明经不同漂洗处理后白鲢鱼肉蛋白质羰基化程度显著性差异。总体上,相同漂洗次数下,随漂洗温度升高,羰基含量显著增大。相同漂洗温度下,随漂洗次数增多,羰基累计含量下降(p<0.05)。例如相比于4-1,12-1和20-1的羰基含量依次增加了94.8%和15.1%。而相同温度下,相比于12-1,12-2和12-3的羰基含量依次减少了38.92%和11.54%,其他组间结果变化相似,这与SYLVIE等[10]研究发现漂洗后竹荚鱼碎肉经冷藏,随漂洗次数增多,羰基含量减少的结果相似。这种变化趋势与漂洗的工艺特征有关,漂洗过程去除脂质、金属离子、水溶性蛋白(含氧合肌红蛋白)、促氧化酶类(超氧歧化酶、过氧化氢酶等)、还原糖等诱导物及反应物,一定程度上能够抑制蛋白羰基化。同时可能去除某些羰基化氧化产物,如含有羰基的水溶性蛋白,多肽片段和一些羰基化的脂质被洗除,均可能造成可检测羰基含量减少[11]。

图1 不同漂洗温度和时间对白鲢鱼糜蛋白羰基含量的影响Fig.1 Effects of different washing temperature and time on the carbonyl content of protein in silver carp surimi注:图1中小写字母表示同温度下,不同漂洗时间(次数)间差异的显著性(p<0.05),大写字母表示相同时间(次数)下,不同漂洗温度间差异的显著性(p<0.05);n=3(图2、图6、图7同)。
在漂洗过程中,白鲢肉糜发生明显的羰基化氧化变性,羰基化程度随漂洗温度升高显著增强。漂洗次数积累能够抑制羰基化产物在鱼糜中的积累,是否能够抑制羰基化发生受到漂洗系统中组分移除的影响,不能得到直接结论。
2.2 鱼糜蛋白巯基含量变化
巯基含量变化是蛋白质变性的重要指标,其反应本质为氧化还原反应。蛋氨酸(甲硫氨酸),半胱氨酸中的巯基(—SH)经氧化转化为二硫键(—S—S—),而巯基(—SH)易于与2—硝基甲苯反应生产黄色物质,因此常采用2—硝基甲苯(DTNB法,Ellman法)检测这一蛋白变性指标[3]。
如图2所示,同温度下,随漂洗次数增多,巯基含量显著下降(p<0.05)。同温度下,相比与1次漂洗,2次和3次漂洗组的巯基含量均下降,但2、3次漂洗组间巯基含量下降梯度并不大,这可能是由于3次漂洗过于充分,漂洗处理破坏了已形成的二硫键(—S—S—),导致二硫键(—S—S—)积累速率减慢,这与王金余等[12]研究发现3次漂洗降低白鲢鱼糜肌球蛋白交联反应的结果相似。经相同漂洗次数(一次漂洗除外),温度升高,巯基含量下降。经不同漂洗处理后蛋白巯基含量发生差异性变化,随温度升高及漂洗次数累计,巯基含量递减,相比巯基总量,减少程度不大,表明造成巯基含量减少的蛋白质氧化反应并不剧烈。
2.3 漂洗液蛋白(肌浆蛋白)及鱼糜蛋白凝胶电泳(SDS-PAGE)分析
通过羰基和巯基含量的结果可知,漂洗中的蛋白氧化变性程度并不剧烈的情况下,蛋白质氧化多造成蛋白多肽骨架断裂,或形成少量蛋白聚集体。并且根据李艳青[13]等研究蛋白氧化对鲤鱼蛋白结构的影响发现,氧化形成的少量的蛋白聚合体分子质量超过200 kDa,难以通过浓缩胶体,进入分离胶中。因此实验中采用SDS-PAGE还原性电泳检测蛋白氧化变性后的降解变化。

图2 不同漂洗温度和时间对白鲢鱼糜蛋白巯基含量的影响Fig.2 Effects of different washing temperature and time on the sulfhydryl content of protein in silver carp surimi
如图3所示,相比4 ℃组,12-3、20-2、20-3组结果中发现肌球蛋白重链条带,这表明肌球蛋白损失在漂洗液中,从而降低鱼糜得率。在12 ℃和20 ℃两个温度下,12-2、12-3、20-2、20-3组在110~100 kDa分子质量附近,均出现新增条带,4-1、4-2、4-3、12-1、20-1组中均未出现,这可能是因为随温度升高,漂洗次数增多,肌球蛋白发生降解的结果。肌动蛋白条带间均无明显差异,说明不同漂洗条件对肌动蛋白溶出的影响差异较小。
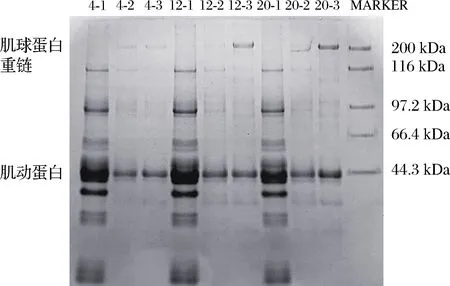
图3 不同漂洗温度和时间下白鲢鱼糜漂洗液蛋白SDS-PAGE电泳图谱(还原性)Fig.3 SDS-PAGE patterns of silver carp protein in washing solution under different temperature and time
如图4所示,不同漂洗条件导致鱼糜蛋白电泳条带差异明显。相比于4 ℃组,12 ℃和20 ℃组在110~100 kDa分子质量内,出现较多杂条带,并且随漂洗次数累计,杂条带颜色渐深。这可能是肌球蛋白发生降解的结果与漂洗液蛋白电泳结果相吻合。相比于4 ℃组,12 ℃和20 ℃组在97.2~66.4 kDa出现新增杂条带,并且同温度下,随漂洗次数积累,条带渐浅。这表明蛋白降解程度加剧。且20℃组在该分子量区间条带颜色明显深于12 ℃组,表明在随温度升高,蛋白降解反应程度更大,所有组别的肌动蛋白条带变化不明显。这与CLAUSEN等[14]研究气调保藏对牛肉肌原纤维蛋白氧化变性影响中所的出的电泳结果类似。

图4 不同漂洗温度和时间下白鲢鱼糜蛋白SDS-PAGE电泳图谱(还原性)Fig.4 SDS-PAGE patterns of protein in silver carp surimi under different washing temperature and time
2.4 鱼糜蛋白质二级结构傅里叶红外光谱分析
蛋白质变性往往改变其结构,其中蛋白质二级结构变化常作为蛋白质变性的敏感指标。蛋白二级结构主要包括有α-螺旋,β-折叠,β-转角这3种规则的结构,此外还有任意形态的无规则卷曲。
将白鲢漂洗鱼糜干粉溴化钾压片上样,获得原始谱图,求得二阶导数,对谱图中酰胺Ⅰ带(1 600~1 700 cm-1)进一步分解为多个子峰,并指出其峰位置,通过曲线拟合的方法,可以定量的分析蛋白质中各二级结构的含量。拟合数据如表1所示,经过漂洗处理的白鲢蛋白质二级结构百分含量发生变化,其中β-折叠和无规则卷曲百分含量的变化呈现良好的规律性。总体上,随温度上升和漂洗次数积累,β-折叠的百分含量下降,无规则卷曲的百分含量增多。
同温度下,随漂洗次数积累,β-折叠的百分含量逐渐减少,无规则卷曲结构的百分含量逐渐上升,在4 ℃组中,相比于4-1,4-2和4-3组β-折叠的百分含量依次下降2.20%和5.77%,而无规则卷曲结构的百分含量依次增多15.45%和3.54%,其他各温度下结果类似。经过相同漂洗次数,随温度上升,这2种结构变化的差异性显著。相比于4-1,12-1和20-1的β-折叠的百分含量分别下降了6.68%和22.05%,而无规则卷曲结构的百分含量增加了14.41%、68.47%。此外α-螺旋和β-转角的百分含量基本无变化,这与卢岩等[15]研究适度氧化改善大豆分离蛋白功能结构影响中利用圆二色谱(CD)定量蛋白二级结构变化的结果类似。

图5 不同漂洗温度和时间下白鲢鱼糜蛋白在酰胺I带(1 600~1 700 cm-1)蛋白二级结构红外光谱拟合图Fig.5 Infrared spectrum fitting in amideI (1 600-1 700 cm-1) of secondary structure of silver carp surimi protein under different washing temperature and time
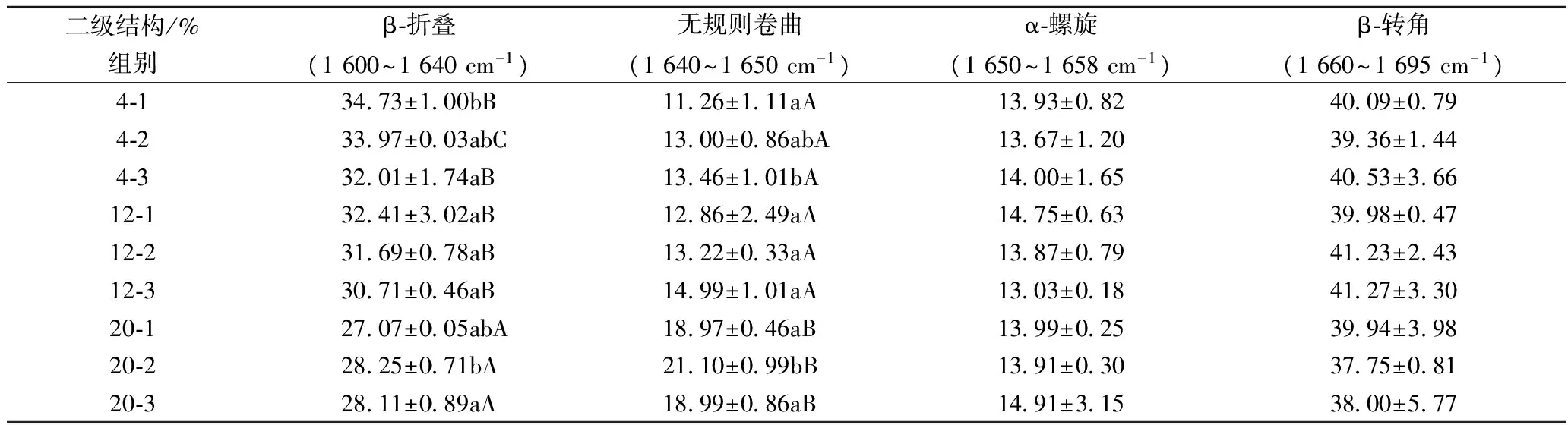
表1 不同漂洗温度和时间下白鲢鱼糜蛋白二级结构百分含量Table 1 Percentage content of silver carp surimi protein secondary structure under different washing temperature and time
注:表1中小写字母表示同温度下,不同漂洗时间(次数)间差异的显著性(p<0.05),大写字母表示相同时间(次数)下,不同漂洗温度间差异的显著性(p<0.05);表1中后2列数据不做显著性分析;n=3。
一些研究认为热处理温度在55 ℃以下,蛋白质其二级结构基本不变[16],这与本实验结果不同。导致这种差异的原因这可能是对原料的处理方式显著不同。鱼糜漂洗前,绞碎的鱼肉组织均匀分散在液体中,随搅拌操作持续,蛋白分子与O2及Fe3+充分接触,所导致的氧化变性可能是造成蛋白二级结构变化主要原因之一。
2.5 鱼糜蛋白溶解度的测定
蛋白溶解性是蛋白质重要的功能特性之一,可用来评价氧化变性对蛋白质功能品质造成的破坏程度。
如图6所示,同温度下,随漂洗时间延长,4 ℃和12 ℃组中,蛋白溶解性均为先升高随后降低,而20 ℃组中,蛋白溶解度随漂洗次数增多,连续下降。考虑到漂洗处理改变蛋白组分和氧化变性,推断氧化变性程度较弱时,多次漂洗处理提高了盐溶蛋白在鱼糜总蛋白所占比例,蛋白溶解能力增大,造成测定值增大。2次漂洗以后,漂洗对蛋白组分影响减弱,随蛋白氧化变性的程度加深,溶解度减少。而经历相同漂洗次数,随漂洗温度上升,蛋白溶解性呈递减趋势。总体而言,漂洗处理后带来的蛋白氧化变性对鱼糜蛋白溶解度产生一定的影响,影响蛋白质理化性质,但其蛋白溶解度不低于75%,蛋白质功能品质造成的破坏程度较低。

图6 不同漂洗温度和时间对白鲢鱼糜蛋白溶解性的影响Fig.6 Effects of different washing temperature and time on the solubility of protein in silver carp surimi
2.6 鱼糜蛋白质Ca2+-ATPase酶活力
蛋白质Ca2+-ATPase酶活力也是表征蛋白质功能性质的重要指标如图7所示。经过漂洗处理,蛋白Ca2+-ATPase酶活力发生改变,随漂洗温度升高和漂洗次数积累,酶活力下降,其变化范围在0.52~0.35 μmol Pi/(mg·min),波动范围较小,下降程度适中。这与郝淑贤等[17]研究加工条件对淡水鱼肌原纤维Ca2+-ATPase稳定性的影响的结果相似。经过本实验中漂洗处理,随温度和漂洗次数累计,酶活力总体下降,低温漂洗能够很好的维持白鲢蛋白质Ca2+-ATPase活性,蛋白变性程度较少。

图7 不同漂洗温度和时间对白鲢鱼糜蛋白Ca2+-ATPase酶活力的影响Fig.7 Effects of different washing temperature and time on the Ca2+-ATPase activity of protein in silver carp surimi
3 结论
本文对不同漂洗条件下制备所得白鲢鱼糜的氧化指标进行测定,分析在漂洗工段中白鲢鱼肉蛋白氧化变性规律。研究发现,在鱼糜漂洗过程中,随漂洗温度上升和漂洗次数积累,检测指标反映各种类蛋白氧化反应均有发生。其中蛋白羰基化,蛋白质分子降解及二级结构含量变化的结果间的差异性较强。针对漂洗工艺,电泳图谱及蛋白二级结构变化可做为显著的检测指标。漂洗过程中蛋白氧化影响其功能品质,但对其损伤作用在加工的可接受范围内。综合考虑,低温(4 ℃)及少次数(1或2次)漂洗满足工艺加工要求的同时能够有效减少总蛋白损失,控制蛋白氧化程度,维持蛋白质良好功能特性,有利于淡水鱼糜加工生产。此外关于鱼糜加工过程中蛋白氧化对制品的食用营养,安全健康性还需进一步研究发现,望本文结果对实际生产过程中的蛋白质氧化研究提供一定的理论支持。
[1] 农业部渔业局编制.中国渔业统计年鉴(2016).2016[M].北京:中国农业出版社,2016.
[2] OLIVER C N,AHN B W,MOERMAN E J,et al.Age-related changes in oxidized proteins.[J].Journal of Biological Chemistry,1987,262(12):5 488-5 491.
[3] HAWKINS C L,MORGAN P E,DAVIES M J.Quantification of protein modification by oxidants[J].Free Radical Biology & Medicine,2009,46(8):965-988.
[4] 辛草,刘俊荣,蔡秋凤,等.三种经济扇贝的基本工艺性质及蛋白质分析[J].水产科学,2012,31(9):535-539.
[5] HU W,GUO X X,WANG X C,et al.Rapid discrimination of different grades ofwhitecroakersurimi by tri-step infrared spectroscopy combined with soft independent modeling of class analogy (SIMCA)[J].Food Analytical Methods,2016,9(4):831-839.
[6] 林伟伟,励建荣,潘伟春,等.秘鲁鱿鱼肌原纤维蛋白凝胶的构效关系研究[J].中国食品学报,2017,17(1):39-46
[7] 张龙.菲律宾蛤仔(Ruditapesphilippinarum)的蛋白分布特性[D].大连:大连海洋大学,2016.
[8] THOMPSON L V,DURAND D,FUGERE N A,et al.Myosin and actin expression and oxidation in aging muscle[J].Journal of Applied Physiology,2006,101(6):1 581-1 587.
[9] 李学鹏,周凯,王金厢,等.羟自由基对六线鱼肌原纤维蛋白的氧化规律[J].中国食品学报,2014,14(6):19-27.
[10] SYLVIE E,CAROLINEP B,CHARLOTTE J.Oxidation of lipid and protein in horse Mackerel (Trachurustrachurus) mince and washed minces during processing and storage[J].Food Chemistry,2009,114(1):57-65.
[11] GATELLIER P,KONDJOYAN A,PORTANGUEN S,et al.Effect of cooking on protein oxidation in n-3 polyunsaturated fatty acids enriched beef.Implication on nutritional quality[J].Meat Science,2010,85(4):645-650.
[12] 王金余,刘承初,赵善贞,等.白鲢鱼糜肌球蛋白交联反应和凝胶化最适条件的研究[J].食品科学,2008,29(11):223-227.
[13] 李艳青.蛋白质氧化对鲤鱼蛋白结构和功能性的影响及其控制技术[D].哈尔滨:东北农业大学,2013.
[14] CLAUSEN I,JAKOBSEN M,ERTBJERG P,et al.Modified atmosphere packaging affects lipid oxidation,myofibrillar fragmentation index and eating quality of beef[J].Packaging Technology & Science,2009,22(2):85-96.
[15] 卢岩.适度氧化改善大豆分离蛋白功能特性及其与肌原纤维蛋白互作的研究[D].哈尔滨:东北农业大学,2015.
[16] 卢雁,张玮玮,王公轲.FTIR用于变性蛋白质二级结构的研究进展[J].光谱学与光谱分析,2008,28(1):4-4.
[17] 郝淑贤,吴燕燕,李来好,等.加工条件对淡水鱼肌原纤维Ca2+-ATPase稳定性的影响[J].食品科学,2005,26(10):79-82.
ProteinoxidationinmincedSilvercarp(Hypophthalmichthysmolitrix)duringwashingprocess
YUAN Kai1,ZHANG Long1,GU Dong-chen1,FAN Zhen-yu1,WANG Xi-chang1*,LI Yu-jin2,LIU Yuan-ping2
1(College of Food Science and Technology Shanghai Ocean University,Shanghai 201306,China) 2(Rongcheng Taixiang Food Products Co.,Ltd,Weihai 264309,China)
Based on industrial surimi washing processing,this paper discusses protein oxidation in the process and provides scientific basis for surimi processing research.Fresh silver carp surimi was prepared at different temperatures (4,12,20 ℃) and different washing times (1,2,3).Then the content of carbonyl group and total thiol content,Ca2+-ATPase enzyme activity,the degree of protein degradation and aggregation,change of secondary protein structure were detected.The results show that the content of carbonyl increased significantly with the increase of temperature but decreased with washing times.The disordered structure increased with the increase of temperature and times,while the content of total sulfhydryl and β-fold structure decreased gradually.Myosin degradation was caused by washing and with temperature increasing,the degradation increased; protein solubility and Ca2+-ATPase activity decreased.Among these indexes,SDS-PAGE pattern and the changes of the secondary protein structure are the good indexes to evaluate oxidation denaturation.Washing 1-2 time at 4 ℃ could effectively control protein oxidation degree while ensuring yield of protein.
silver carp surimi; washing; protein oxidation; detected indexes
10.13995/j.cnki.11-1802/ts.014490
硕士研究生(王锡昌教授为通讯作者,E-mail:xcwang@shou.edu.com)。
2014年泰山学者蓝色产业领军人才团队支撑项目“低值蛋白高值化重组利用关键技术集成与产业化”
2017-04-09,改回日期:2017-05-12
