琥珀酸放线杆菌的固定化及利用纤维床反应器生产丁二酸的研究
2018-01-03陈鹏程郑璞
陈鹏程,郑璞
(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
琥珀酸放线杆菌的固定化及利用纤维床反应器生产丁二酸的研究
陈鹏程,郑璞*
(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
以甘蔗渣残渣、聚丙烯微米纤维膜和棉纤维分别作为载体固定琥珀酸放线杆菌进行丁二酸的发酵生产,通过优化载体使用量获得较高的丁二酸产量并进行反复分批发酵,以研究载体重复使用性能。研究发现,聚丙烯微米纤维膜产丁二酸相对最优,且相对使用量最少,而棉纤维材料重复使用稳定性最优。以棉纤维材料构建转动式纤维床反应器,研究不同pH调节剂对反应器运行效率的影响,发现以MgCO3作为pH调节剂时,丁二酸质量浓度分别比以NH3·H2O-Na2CO3和KOH-K2CO3作为调节剂时提高32%与20%。在反应器中采用反复补料分批发酵的操作方式,平均每35 h一个批次,发酵运行175 h,丁二酸平均质量浓度为87.8 g/L,平均生产强度为2.51 g/(L·h),平均转化率为0.86 g/g。结果表明,构建的纤维床反应器有利于实现丁二酸的高浓度、高生产强度和高转化率。
丁二酸;固定;发酵;反应器
丁二酸是一种常见的天然有机酸,也是一种重要的C4平台化合物,广泛应用于医药、食品、可降解塑料和化工行业。工业上通常通过丁烯二酸催化或者丁二腈水解还原制得丁二酸。2004年美国能源部将丁二酸列为最有希望实现生物法产业化的12种化合物之一[1]。生物基丁二酸的开发对于摆脱对化石资源的依赖,减少环境污染并减轻大气温室效应有着重要意义。
自2000年后,通过发酵法生产丁二酸取得的进展主要体现为:(1)以天然产丁二酸的琥珀酸放线杆菌Actinobacillussuccinogenes130Z[2]、NJ113[3]、CGMCC No.1593[4]和BasfiasucciniciproducensDSM 18541[5]为代表的厌氧发酵技术,产酸水平为40~108 g/L,生产强度0.9~1.3 g/(L·h),糖酸转化率0.50~0.87 g/g;(2)以E.coli工程菌NZN111、AFP111[6]、KJ122和KJ134[7]为代表的好氧-厌氧两阶段发酵技术,产酸55~99 g/L,生产强度0.9~1.1 g/(L·h),产率0.90~1.10 g/g;(3)以E.coli工程菌HL27659k[8]、酵母工程菌Suc-297[9]为代表的好氧发酵技术,产酸43~58 g/L,生产强度0.2~1.1 g/(L·h),产率0.20~0.60 g/g;(4)以CorynebacteriumglutamicumΔldhA-pCRA717为代表的生长限制工艺,最高产酸146 g/L,生产强度3.17 g/(L·h),产率0.92 g/g[10]。虽然利用Corynebacteriumglutamicum工程菌的产酸达到了高产酸浓度、高转化率和高生产强度,但这种生长限制工艺需要较高的细胞浓度(60%),为达到高细胞浓度,往往先生长培养,再通过离心分离或者膜分离方法收集细胞、重悬于反应液,这样的操作在实际生产中面临着困难。
生物法发酵产丁二酸属于常规的微生物厌氧发酵过程,传统的发酵工艺有分批、补料分批、半连续以及连续发酵等,新型的发酵工艺则是将传统的发酵工艺与固定化技术或生物反应器结合以增加细胞浓度、除去产物积累,从而达到提高总产物浓度或生产效率的目的。本课题组前期通过基因组改组手段,获得高产菌株AcitnobacillussuccinogenesF3-ZK(CCTCCNO:M2012036)[11],其最高产酸达到95.6 g/L,糖酸转化率0.71 g/g。然而利用琥珀酸放线杆菌发酵生产丁二酸的过程中,细胞浓度低及生长速度缓慢是主要限制因素。本工作针对该问题,提出采用固定化的方式将琥珀酸放线杆菌与载体结合,以期实现菌体从体系中的快速分离与重新使用,进而给连续生产带来便利。在固定化载体方面,分别使用甘蔗残渣、聚丙烯微米纤维膜以及棉纤维作为载体,通过优化载体使用量并研究载体的重复使用稳定性,进而构建琥珀酸放线杆菌固定化的转动式纤维床反应器,以期提高丁二酸生产效率。
1 材料与方法
1.1 材料
1.1.1 菌种和原材料
琥珀酸放线杆菌(Actinobacillussuccinogenes)CCTCC M2012036,由本实验室自主筛选诱变得到,保藏于中国典型培养物保藏中心(CCTCC)[11];甘蔗渣残渣由本实验室自制[12];聚丙烯微米纤维膜由浙江省纺织测试研究院提供;棉纤维购买于孚日集团股份有限公司(山东,中国)。
1.1.2 培养基
种子培养基配制方法见文献[13]。
发酵培养基制方法见文献[13],其中初始葡萄糖质量浓度为50 g/L。
MgCO3粉末在170℃条件下灭菌2 h。
1.2 实验方法
1.2.1 游离细胞摇瓶发酵方法
25 mL发酵培养基中以体积分数2.5%的接种量接入琥珀酸放线杆菌,加入1 g灭过菌的MgCO3,在厌氧培养箱中38℃静置培养48 h。
1.2.2 固定化细胞摇瓶发酵方法
将载体放入25 mL种子培养基中,以体积分数2.5%的接种量接入琥珀酸放线杆菌,放在厌氧培养箱中38℃下静置培养12 h后,取出载体,投入装有25 mL发酵培养基的三角瓶中,同时加入1 g灭过菌的MgCO3,在厌氧培养箱中38 ℃静置培养48 h。反复分批发酵时,将载体从发酵液中取出投入新鲜培养基。
1.2.3 纤维床反应器发酵产丁二酸
发酵罐上纤维床反应器吸附琥珀酸放线杆菌是将培养好的种子以体积分数2.5%的接种量添加到装有2 L种子培养基的反应器中,在38 ℃下培养6 h,当pH降低至6.2时,用蠕动泵将种子液排出,补加新鲜发酵培养基1.6 L,38 ℃,搅拌转速120 r/min,每隔3~4 h取样测葡萄糖质量浓度,当葡萄糖质量浓度低于5 g/L时,发酵结束。发酵过程中控制pH为6.5。当使用NH3·H2O-Na2CO3以及KOH-K2CO3作为调节剂时,当发酵液pH下降至6.5以下,通过蠕动泵自动流加NH3·H2O-Na2CO3以及KOH-K2CO3水溶液;使用MgCO3作为调节剂的时候,当发酵液pH下降至6.5以下,手动从进料口加入MgCO3固体粉末。纤维床反应器反复补料分批发酵是当发酵液中残糖质量浓度降低至10 g/L时,一次性加入高质量浓度的葡萄糖,使得发酵液中葡萄糖质量浓度达到55 g/L左右,待残糖质量浓度再一次降低到5 g/L以下时,将发酵液排出,添加新鲜培养基重复上述补料分批发酵,反复操作4批次。
1.2.4 分析方法
发酵液中生物量采用比浊法[14],糖、有机酸的测定采用高效液相色谱法[15]。
2 结果与分析
2.1 不同载体对琥珀酸放线杆菌的固定化及产酸稳定性
2.1.1 甘蔗渣残渣作为固定化载体
甘蔗渣是甘蔗提炼甘蔗汁后留下的纤维性物质,主要组分为纤维素、半纤维素和木质素。甘蔗渣经碱预处理联合纤维素酶、木聚糖酶、葡聚糖酶和果胶酶复合处理后的残渣为甘蔗渣残渣。从图1(a)可以看出,经过预处理以及酶解之后的甘蔗渣残渣空间结构松散,为菌体提供了附着空间。因此尝试使用甘蔗渣残渣作为载体吸附琥珀酸放线杆菌,以减少种子的培养操作进而缩短发酵周期。

图1 载体(a)甘蔗渣残渣、(b)聚丙烯微米纤维膜和 (c)棉纤维扫描电镜图Fig.1 SEM images of supports (a) sugarcane bagasse residue,(b) polypropylene microfiber membrane and (c) cotton cloth
对甘蔗渣残渣在发酵过程中的用量进行优化,初糖质量浓度为50 g/L,结果见表1。从表1可以看出,随着甘蔗渣残渣添加量的增加,丁二酸的质量浓度、发酵液中的生物量开始呈上升趋势;当甘蔗渣残渣的添加量为10 g/L时,丁二酸质量浓度达到了40.0±3.25 g/L,丁二酸对糖的转化率达到0.81±0.06 g/g的最高值。当甘蔗渣残渣的添加量由10 g/L增加到20 g/L时,丁二酸的产量下降,可能是过高的甘蔗渣残渣添加量影响了发酵液的传质。对生物量进行生物学统计分析,差异显著性检验,所得p>0.05,说明平均数之间差异不显著。

表1 不同甘蔗渣残渣添加量对丁二酸生产的影响Table 1 The effect of sugarcane bagasse residue usage on the production of succinic acid
进一步,将甘蔗渣残渣用于反复分批发酵,3个批次的丁二酸产量分别为40.2、40.0和39.8 g/L。然而,由于甘蔗渣残渣颗粒小,因此从发酵体系中分离回收不方便,为了便于载体的回收利用,接下来将使用连续的纤维材料作为固定化载体。
2.1.2 聚丙烯微米纤维膜作为固定化载体
聚丙烯微米纤维膜(图1(b))具有纤维细、比表面积大、孔隙小而孔隙率大的特性。本实验中使用的聚丙烯微米纤维膜主要性能参数为:膜外径约3.24±0.57 μm、微孔孔径约0.1~0.2 μm、孔隙率约40%~50%。在发酵液中初始葡萄糖质量浓度为35 g/L时,研究载体的表面积与发酵液体积比对琥珀酸放线杆菌生长和产酸的影响,结果如表2所示。当载体表面积与发酵液体积比为1.0∶1和1.5∶1 (cm2∶cm3)时,丁二酸的转化率高达0.87±0.05 g/g和0.88±0.04 g/g。考虑到经济效益,确定载体用量为载体表面积/发酵液体积比为1.0∶1 (cm2∶cm3)。对生物量进行生物学统计分析进行差异显著性检验,所得p<0.05,说明平均数之间差异显著。

表2 聚丙烯微米纤维膜用量对丁二酸生产的影响Table 2 Effect of polyproplene microfiber membrane usage on the production of succinic acid
在这一载体用量下,进行丁二酸的反复分批发酵。每一次发酵结束后,取出载体,置于无菌水中清洗并重新投入新鲜发酵液中,连续进行6批次发酵,结果如表3所示。在前5个批次的发酵实验中,体系内的琥珀酸放线杆菌具有较强活力,丁二酸的平均转化率为0.85±0.07 g/g。到了第6次发酵,菌体对葡萄糖的消耗和丁二酸生成能力开始下降。

表3 聚丙烯微米纤维膜吸附琥珀酸放线杆菌反复分批发酵产丁二酸Table 3 Repeated batch fermentation of Actinobacillus succinogenes-immobilized polypropylene microfiber membrane
2.1.3 棉纤维作为固定化载体
棉纤维材料具有大量的空隙(图1(c)),通过物理吸附的方式,能够将细胞吸附在棉纤维表面以及内部空隙之间。初糖质量浓度为50 g/L时考察了棉纤维材料用量对琥珀酸放线杆菌发酵丁二酸的影响。结果(表4)表明,当纤维载体表面积与装液量之比为2.0∶1时,产丁二酸质量浓度最高,为37.4±2.97 g/L;继续增加比例可能使得棉纤维载体相对发酵培养基体积过大,阻碍了传质的进行,丁二酸的质量浓度降低至34.2±3.00 g/L。综上所述,载体表面积与发酵液体积之比选择2.0∶1最合适。对生物量进行生物学统计分析进行差异显著性检验,所得p<0.05,说明平均数之间差异显著。
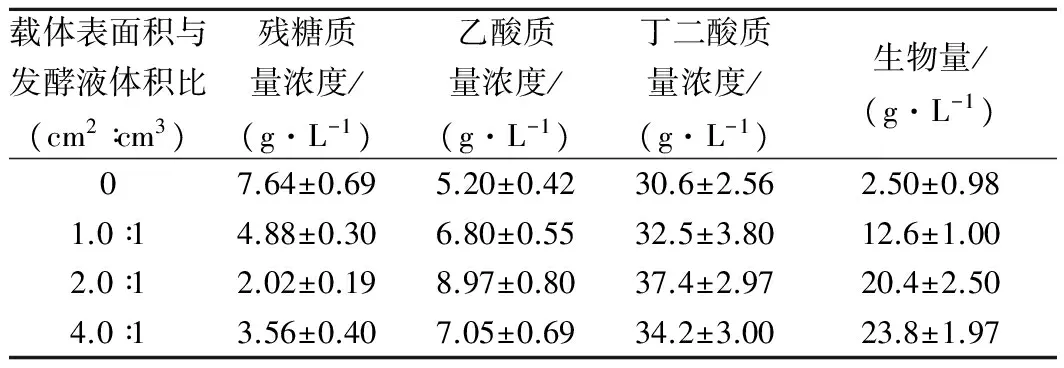
表4 棉纤维用量对丁二酸发酵产量的影响Table 4 Effect of cotton cloth usage on the production of succinic acid
进一步考察棉纤维吸附琥珀酸放线杆菌反复利用情况,摇瓶反复分批发酵进行了10批次,结果(表5)表明,丁二酸的产量在10批次内没有明显的变化,平均产酸36.5±3.50 g/L,平均转化0.85±0.06 g/g。

表5 棉纤维吸附琥珀酸放线杆菌摇瓶反复分批发酵产丁二酸Table 5 Repeated batch fermentation of Acitnobacillus succinogenes-immobilized cotton cloth
综合上述实验结果,甘蔗渣残渣、聚丙烯微米纤维膜和棉纤维材料均可以作为载体吸附琥珀酸放线杆菌,其中在摇瓶水平,当载体使用量都在最优条件时,聚丙烯微米纤维膜产丁二酸相对最优。从载体材料使用量来看,在25 mL的摇瓶发酵液体系中,3种载体的使用量分别是0.25 g甘蔗渣残渣、0.17 g聚丙烯微米纤维膜和1.76 g棉纤维,聚丙烯微米纤维膜使用量最少。从载体的来源来看,甘蔗渣是常见的农业废弃物,聚丙烯微米纤维膜和棉纤维目前均已工业化生产且棉纤维的成本更低廉。从载体的分离来看,当使用甘蔗渣残渣作为载体时,由于其呈粉末装分散在发酵液里,给载体的分离带来一定操作困难,棉纤维和聚丙烯微米纤维膜均易于从发酵体系中分离。从重复使用稳定性来看,棉纤维材料使用稳定性相对最优。考虑到反应器放大发酵时,载体的稳定性和强度至关重要,后续以棉纤维材料为例研究纤维床反应器。
2.2 纤维床反应器的构建及其对丁二酸的生产
2.2.1 纤维床反应器的构型
在棉纤维载体表面积与发酵液体积比为 2.0∶1 (cm2∶cm3)的基础上,将棉纤维载体平铺于铁丝网上并固定在3 L发酵罐(Biotech-3BG,上海市宝兴生物设备有限公司)的搅拌轴上,构建了转动式纤维床反应器(图2)。棉纤维材料吸附琥珀酸放线杆菌主要是依靠静电力,将细胞吸附在棉纤维载体表面,随着发酵培养基的更换以及跟随搅拌转轴的同时转动,衰老的细胞从棉纤维材料上脱落下来,同时强壮的新细胞附着在棉纤维载体上;另一方面,由于吸附作用并不稳定,细胞在搅拌作用下从棉纤维载体上脱落,同时又随着径向的作用重新吸附到棉纤维载体上,这样更加有利于细胞对底物的利用。

图2 内置式转动纤维床反应器实物图Fig.2 Image of rotary fibrous-bed bioreactor
2.2.2 不同pH调节剂对反应器运行效率的影响
丁二酸发酵过程中随着产酸的积累,pH会逐渐降低,当pH低于5.0时,细胞生长与产酸均停止;根据电子守恒理论计算方程可得:1 mol葡萄糖在0.86 mol CO2参与下,理论生成1.71 mol丁二酸[16]。这说明发酵过程中pH调节剂不仅需要调节pH,还需要提供CO2。因此,本实验在纤维床反应器的基础上研究不同pH调节剂对反应器产酸的影响。在这里选择的pH调节剂包括NH3·H2O-Na2CO3、KOH-K2CO3以及MgCO3。
利用上述pH调节剂将pH恒控制为6.5,对丁二酸生产的实验结果如表6所示。发现以MgCO3作为pH调节剂时,丁二酸浓度分别比其他二者提高了32%与20%。这可能是因为MgCO3是弱碱,Mg2+容易取代H+与丁二酸分子螯合形成络合物,减轻了未解离形式的丁二酸对细胞的抑制;此外有报道称K+、Na+与细胞膜的运输有关,因此可能会影响菌体对葡萄糖的利用。
2.2.3 纤维床反应器的运行稳定性
在3 L发酵罐的纤维床反应器中,反复补料分批发酵5批次,发酵运行175 h,发酵曲线如图3所示。平均每35 h一个批次,丁二酸平均质量浓度为87.8 g/L,平均生产强度为2.51 g/(L·h),平均转化率为0.86 g/g,在这5个批次中,剩余葡萄糖浓度均为5 g/L以下。其中第3批次时,获得的丁二酸质量浓度最大,为98.7 g/L,生产强度为2.77 g/(L·h),转化率为0.89 g/g。发酵第5个批次后,产酸下降,说明纤维床反应器采用补料分批发酵的操作方式的操作周期为5批次(175 h)左右,后续希望对反应器的材料和内部结构细节进行深入研究,从而进一步延长操作周期。
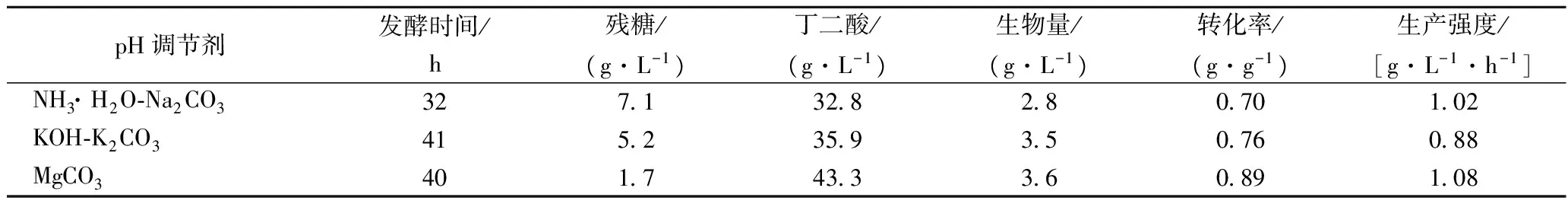
表6 不同pH调节剂对丁二酸生产的影响Table 6 Effect of pH regulator on the production of succinic acid

■丁二酸;▲葡萄糖;◇生物量图3 纤维床反应器反复补料分批发酵图Fig.3 Repeated fed-batch fermentation behavior of fibrous-bed bioreactor
3 结论
本文系统地研究了吸附琥珀酸放线杆菌的载体材料及其发酵产丁二酸性能,并构建转动式纤维床反应器实现丁二酸的高效生产。研究表明,棉纤维、聚丙烯微米纤维膜和甘蔗渣残渣均可以吸附琥珀酸放线杆菌,其中采用棉纤维作为载体,反复分批发酵运转10批次,结果平均产酸为36.5±3.50 g/L,平均转化率为0.85±0.06 g/g。进而利用棉纤维构建转动式纤维床反应器,采用补料分批发酵的操作方式,可实现同时高产酸、高生产强度以及高转化率,运行周期约为175 h,有较好的稳定性。
[1] BOZELL J J,PETERSEN G R.Technology development for the production of biobased products from biorefinerycarbohydrates—the US Department of Energy’s “Top 10” revisited[J].Green Chemistry,2010,41(28): 539-554.
[2] GUETTLER M V,JAIN M K,RUMLER D.Method for making succinic acid,bacterial variants for use in the process,and methods for obtaining variants[P].US 5573931.1996.
[3] 姜岷,欧阳平凯,王倩楠,等.一种产丁二酸的菌株及其筛选方法和应用[P].中国专利,申请号:200610085415.9.
[3] JIANG Min,OUYANG Ping-kai,WANG Qian-nan,et al.Screening and application of a strain to produce succinic acid[P].China 200610085415.9.2006
[4] 孙志浩,郑璞,刘宇鹏,等.一种微生物发酵生产丁二酸的菌种和方法[P].中国专利,申请号:20061 0038113.6.
[5] SCHLOTEN E,RENZ T,THOMAS J.Continuous cultivation approach for fermentative succinic acid production from crude glycerol byBasfiasucciniciproducensDD1[J].Biotechnology Letters,2009,31(12):1 947-1 951.
[6] DONNELLY M,MILLARD C S,STOLS L.A mutantE.colistrain with increased succinic acid production[P].CA 2236472 C.2012.
[7] JANTAMA K.Metabolic engineering ofEscherichiacolito efficiently produce succinate in mineral salts media[M].Dissertations & Theses-Gradworks,2008.
[8] LIN H,BENNETT GN,SAN KY.Chemostat culture characterization ofEscherichiacolimutant strains metabolically engineered for aerobic succinate production:A study of the modified metabolic network based on metabolite profile,enzyme activity,and gene expression profile[J].Metabolic Engineering,2005,7(5-6):337-352.
[9] YUZBASHEV T V,YUZBASHEVA E Y,SOBOLEVSKAYAo T I,et al.Production of succinic acid at low pH by a recombinant strain of the aerobic yeastYarrowialipolytica[J].Biotechnology & Bioengineering,2010,107(4):673-682.
[10] OKINO S,NOBURYU R,SUDA M,JOJIMA T,INUI M,YUKAWA H.An efficient succinic acid production process in a metabolically engineeredCorynebacteriumglutamicumstrain[J].Applied Microbiology and Biotechnology,2008,81(3):459-464.
[11] ZHENG Pu,ZHANG Kun,YAN Qiang, et al.Enhanced succinic acid production byActinobacillussuccinogenesafter genome shuffling[J].Journal of Industrial Microbiology &Biotechnology,2013,40(8):831-840.
[12] CHEN Peng-cheng,TAO Sheng-tao,ZHENG Pu.Efficient and repeated production of succinic acid by turning sugarcane bagasse into sugar and support[J].Bioresource Technology,2016,211:406-413.
[13] 刘璇,郑璞.基因组改造技术选育耐酸性琥珀酸放线杆菌[J].微生物学通报,2009,346(11):1 676-1 684.
[13] LIU Xuan,ZHENG Pu.BreedingActinobacillussuccinogeneswith acid-tolerance by genome shuffling[J].Microbiology China, 2009,346(11):1 676-1 684.
[14] LIU Yu-peng,ZHENG Pu,SUN Zhi-hao,et al.Economical succinic acid production from cane molasses byActinobacillussuccinogenes[J].Bioresource Technology,2008,99(6):1 736-1 742.
[15] 刘宇鹏,郑璞,孙志浩,等.采用离子排斥色谱法分析发酵液中的琥珀酸等代谢产物[J].食品与发酵工业,2006, 32(12) :119-123.
[15] LIU Yu-peng,ZHENG Pu,SUN Zhi-hao,et al.Determination of succinic acid and other metabolites from fermentation broth by ion-exclusion liquid chromatography[J].Food and Fermentation Industries,2006,32(12):119-123.
[16] MCKINLAY JB,VIEILLE C,ZEIKUS JG.Prospects for a bio-based succinate industry[J].Applied Microbiology and Biotechnology,2007,76(4):727-740.
ImmobilizationofActinobacillussuccinogenesandtheproductionofsuccinicacidusingfibrous-bedbioreactor
CHEN Peng-cheng,ZHENG Pu*
(The Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, China)
In this paper,sugarcane bagasse residue,polypropylene microfiber membrane and cotton cloth were adopted as supports to immobilizeActinobacillussuccinogenesfor the fermentative production of succinic acid.The usage of supports was optimized to improve the yield of succinic acid and repeated batch fermentation was conducted to study the reusable stability of supports.Polypropylene microfiber membrane was preferred in the production of succinic acid while cotton cloth was preferred in the reusable stability test.As a result,cotton cloth was used in the construction of a fibrous-bed bioreactor.In the study of the effect of pH regulator on bioreactor efficiency,there were 32% and 20% increase in succinic acid concentration when using MgCO3as the pH regulator compared with that using NH3·H2O-Na2CO3and KOH-K2CO3.Repeated fed-batch fermentation was operated in the bioreactor with the average batch time of 35 h and the total operation time of 175 h.Results showed that the average concentration,productivity and yield of succinic acid were 87.8 g/L,2.51 g/(L·h) and 0.86 g/g,respectively.Results showed that the fibrous-bed bioreactor reported in this paper should be helpful for high concentration,high productivity and high yield of succinic acid.
succinic acid; immobilization; fermentation; bioreactor
10.13995/j.cnki.11-1802/ts.015305
博士,讲师(郑璞教授为通讯作者,E-mail:zhengpu@jiangnan.edu.cn)。
国家自然科学基金(21604032);“十二五”农村领域国家科技计划课题(2015BAD15B04);中央高校基本科研业务费专项资金资助(JUSRP116031);江南大学工业生物技术教育部重点实验室开放课题(KLIB-KF201501)
2017-07-25,改回日期:2017-08-03
