芒果苷-葡甲胺-F68共研磨物的研究
2018-01-03胡丽玲莫江文
胡丽玲,莫江文,彭 艳
芒果苷-葡甲胺-F68共研磨物的研究
胡丽玲1,2,莫江文1,2,彭 艳1,2
目的提高难溶性药物芒果苷(Mangiferin)的溶出度。方法将芒果苷、葡甲胺和泊洛沙姆188(F68)共研磨制成共研磨物,经显微镜观察此共研磨物晶体的变化,经HPLC测定该共研磨物的含量,经小杯法测定该共研磨物的溶出度。结果葡甲胺可使芒果苷的晶体明显变小,再加入F68后晶体变模糊;芒果苷制备成芒果苷-葡甲胺-F68共研磨物后实测含量增加,溶出速度加快。结论芒果苷-葡甲胺-F68共研磨物可明显增加芒果苷的溶出度,且方法简便。
芒果苷;葡甲胺;F68;共研磨物;溶出度
0 引言
芒果苷(Mangiferin)又名芒果素、知母宁,广泛存在于包括知母、黄柏等在内的漆树科、水龙骨科和龙胆科等天然药物中[1]。近年来,芒果苷在抗炎[2]、抗氧化[3]、抗糖尿病[4]、抗癌[5-6]、抗高尿酸血症[7-8]等表现出来的特殊生物活性和药理作用不断被揭示,其作为一种具有广泛药理活性的天然来源的化合物,正在引起相关研究领域,尤其是抗癌和糖尿病治疗领域的极大关注。芒果苷是一种具有双苯吡喃酮结构的碳糖苷,水溶性极差,也不溶于非极性溶剂,从而导致其口服生物利用度极低(仅1.2%)[9],亦难以制成稳定的、符合临床用药安全的注射液,从而限制了其临床应用和新药开发。因此,本课题旨在寻找一种能大大提高芒果苷溶解度的载体,为芒果苷新药的开发提供研究资料。
1 材料与仪器
1.1 材料 芒果苷标准品(购自中国药品生物制品检定所,纯度98.4%,批号:111607-200402),聚乙二醇 200(PEG200,化学纯,天津市瑞金特化学品有限公司),聚乙二醇 400(PEG400,化学纯,天津市福晨化学试剂厂),聚乙二醇 600和聚乙二醇2000(PEG600和PEG2000,化学纯,国药集团化学试剂有限公司),吐温80(化学纯,国药集团化学试剂有限公司),甲醇(色谱纯,江苏汉邦科技有限公司),无水乙醇(分析纯,天津市永大化学试剂有限公司),冰乙酸(分析纯,天津博迪化工股份有限公司),乙腈(色谱纯,天津市康科德科技有限公司),磷酸二氢钾(分析纯,天津市永大化学试剂有限公司),磷酸氢二钾(分析纯,广东汕头市西陇化工厂),1,2-丙二醇(分析纯,国药集团化学试剂有限公司),葡甲胺(分析纯,上海阿拉丁生化科技股份有限公司),氢化蓖麻油(RH40)(BASF,德国),泊洛沙姆F68 (BASF,德国)。
1.2 仪器 PM系列型行星式球磨机(南京顺驰科技发展有限公司,中国),光学显微镜(Motic&107M),离心机(上海菲恰尔分析仪器有限公司,中国),SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司,中国),WG-71电热鼓风干燥箱(天津市泰斯特仪器有限公司,中国),KQ5200E型超声清洗器(昆山市超声仪器有限公司,中国),BSA124S电子分析天平(赛多利斯,德国),pHS-2C型酸度计(上海伟业仪器厂,中国),UV5100紫外/可见分光光度计(安徽皖仪股份有限公司,中国),DF-101S集热式磁力加热搅拌器(金坛市医疗仪器厂,中国),高效液相色谱系统(L-7110输液泵、L-7420紫外检测器,Hitachi,日本)。
2 方法
2.1 芒果苷的含量测定方法[10]精密称取芒果苷标准品适量(约50 mg),置100 mL量瓶,用甲醇溶解并稀释至刻度,摇匀,取适量溶液离心,取上清液,高效液相色谱法测定。色谱条件:用十八烷基键合硅胶为填料(C18柱,Haito Pack ODS,5 μm,100 mm×4.6 mm),乙腈∶0.1%冰醋酸(16∶84)为流动相,流速为1.0 mL/min,检测波长259 nm,进样量20 μL。
2.2 表观溶解度测定 将过量芒果苷分散在如表1所示的溶剂体系中,超声处理10 min,25 ℃放置24 h,取上清液,离心,适当稀释后,按“2.1”项下方法中的HPLC测定溶解度。由结果可知,芒果苷在甲醇、PBS pH 8、丙二醇、PEG400中溶解性很好,但芒果苷在葡甲胺水溶液中溶解性最为明显,这可能与芒果苷3位酚羟基具有酸性,可与葡甲胺成盐溶解性提高有关。根据溶解度测定结果,确定用PBS pH 8作为后续溶出度检查的释放介质。
2.3 共研磨物的制备
2.3.1 干法共研磨 在容积100 mL的氧化锆磨罐中加入直径为1 mm的氧化锆球磨珠100 g,按表2中的处方组成,称取芒果苷和辅料,置磨罐中。磨罐置行星式球磨机内,转速1 027 r/min,研磨1 h。其中,处方1、处方2在室温下研磨;处方3、处方4将磨罐置60 ℃水浴加热,待PEG或F68熔融后,趁热球磨。
上述处方经研磨后物料呈不同形态:处方1中PEG为大的块状,表面吸附有芒果苷,部分芒果苷PEG混合呈蜡状黏在磨罐内壁;处方2中F68大部分呈颗粒状;处方3和处方4,因球磨机无控温装置,研磨过程随着温度的降低载体材料凝固而无法研磨,重新加热熔融后,补加适量PEG200,尽管可使物料在室温下呈液态,但因其黏度过大而球磨珠无法运动。

表1 芒果苷在不同溶剂中的表观溶解度
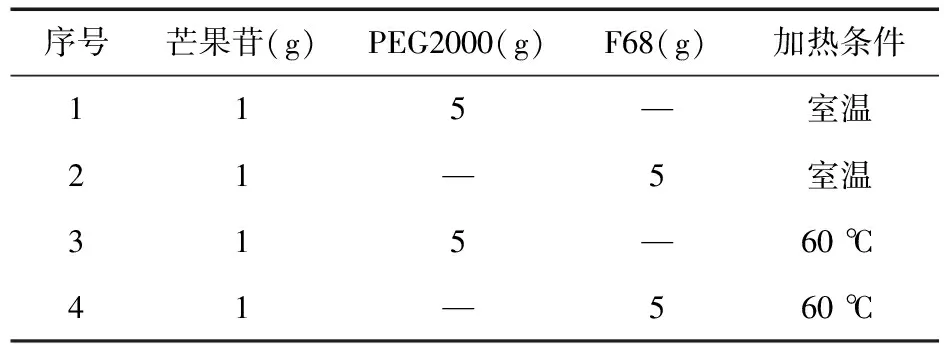
表2 干法共研磨的处方组成
2.3.2 液体多元醇为介质湿法研磨 在容积100 mL 的氧化锆磨罐中加入直径为1 mm的氧化锆球磨珠100 g或75 g(处方7),按表3中的处方组成,称取芒果苷和辅料,置磨罐中。磨罐置行星式球磨机内,转速1 027 r/min,研磨4 h。间隔1 h,取出物料,显微镜下观察。显微镜下可观察到药物晶体逐渐变小,但吐温80对晶体的减小无明显的促进作用,且研磨2 h 与4 h的效果无明显改善。

表3 液体多元醇为介质湿法研磨的处方组成
2.3.3 芒果苷-葡甲胺共研磨 在容积100 mL的氧化锆磨罐中加入直径为1 mm的氧化锆球磨珠75 g,按表4中的处方组成,称取芒果苷和辅料,置磨罐中。磨罐置行星式球磨机内,转速1 027 r/min,研磨4 h。间隔1 h,取出物料,显微镜下观察。显微镜下可观察到药物晶体逐渐变小,与5~7组相比,晶体变小最为明显,当加入F68后,芒果苷原有的晶体形态变模糊,粒径变小(图1)。同时,按“2.1”项下HPLC法测定共研磨物中芒果苷的含量可知,芒果苷-葡甲胺-F68的实测含量为70.53%。

表4 芒果苷-葡甲胺共研磨的处方组成

图1 显微照片
注:A.芒果苷原料,B.芒果苷-葡甲胺物理混合物,C.芒果苷-葡甲胺共研磨物,D.芒果苷-葡甲胺-F68共研磨物
2.4 理化性质 由偏光显微镜照片可知,随着辅料的加入,采用行星式球磨法进行干法共研磨制备芒果苷-葡甲胺-F68共研磨物,芒果苷原有的晶体形态变模糊,粒径变小,见图1。
2.5 溶出度 按照中国药典附录溶出度测定法(小杯法)测定溶出度,以PBS pH 8 200 mL为溶出介质,转速50 r/min。取葡甲胺-芒果苷共研磨物、葡甲胺-芒果苷-F68共研磨物、葡甲胺-芒果苷物理混合物和芒果苷原料药(约相当于芒果苷20 mg),精密称定,置溶出杯中,分别于10、20、30、60、120 min取样3 mL,同时补加等体积的介质,样品过滤后用HPLC测定芒果苷的溶出量。
由图2可知,芒果苷-葡甲胺共研磨物与原料药的溶出曲线几乎重合,这可能与研磨时物料结块,研磨不充分有关;物理混合物组溶出较快,而芒果苷-葡甲胺-F68共研磨物的溶出速度最快,F68自身亲水性和对芒果苷的增溶效果,以及芒果苷与葡甲胺的成盐作用均是溶出快的可能原因。
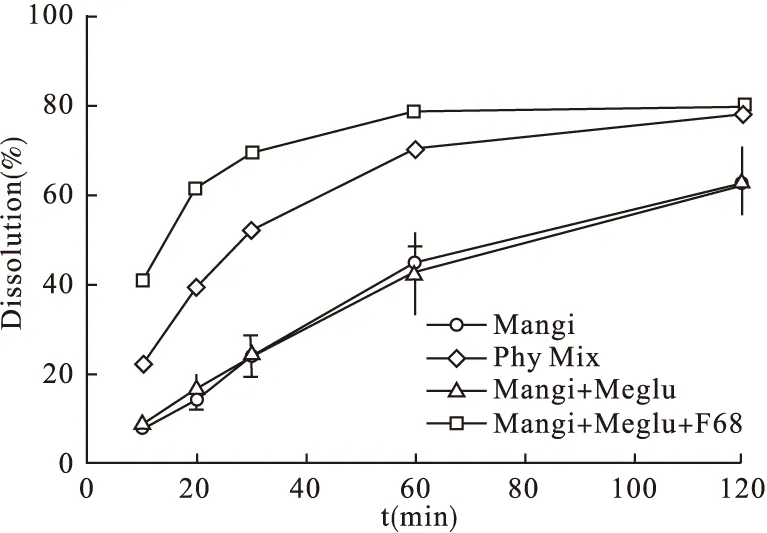
图2 芒果苷—葡甲胺共研磨物的溶出度曲线
2.6 重现性考察 按“2.3.3”项下的方法制备3批芒果苷-葡甲胺-F68共研磨物,按“2.5”项下的方法测定芒果苷的溶出度,3批共研磨物的溶出曲线基本一致,表明该处方工艺重现性良好。见图3。
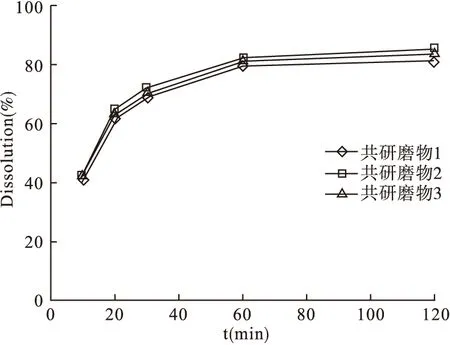
图3 重现性考察
3 结果
经表观溶解度测定,芒果苷在葡甲胺水溶液中溶解性明显,浓度达5 208.54 μg/mL;经显微镜观察,葡甲胺促进芒果苷晶体变小的效果最为明显,再加入F68后晶体变模糊;经HPLC法测定芒果苷-葡甲胺-F68实测含量为70.53%(w/w);经溶出度测定法显示芒果苷-葡甲胺-F68共研磨物的溶出速度显著加快,重现性良好。
4 讨论
表观溶解度测定结果(表1)显示,芒果苷在有机溶剂甲醇、丙二醇中的溶解度较高,但甲醇中溶解度仅为840.21 μg/mL,采用溶剂挥发法仍存在困难。熔融法需要载体材料和药物处于熔融状态,而芒果苷熔点为267~272 ℃[11],熔融同时分解。因此,研磨法是比较可行的方案。
葡甲胺(Meglumine)为N-甲基-D-葡糖胺,是一种重要的有机化工原料,主要用于合成表面活性剂医药染料和树脂等。葡甲胺分子结构中含有5个醇-OH基和1个-NH-基(图4),分子极性很强,是一种安全无毒的游离碱类化合物,在医药工业中常用做助溶剂,在一定条件下,葡甲胺与一些疏水难溶性药物形成非金属盐化合物或形成分子复合物,从而大大提高原药物的溶解度,为难溶性药物的应用提供新的化合物形式[12-14]。

图4 芒果苷(A)和葡甲胺(B)的结构式
芒果苷为双苯并吡喃酮结构的碳糖苷[11],水溶性差。其1位酚羟基与9位酮羰基形成氢键;6、7位为邻二酚羟基结构形成氢键缔合;3位酚羟基为游离态,具有弱酸性,可以与无机碱(如NaHCO3[15])或有机碱反应;2位连接的吡喃糖结构极性较大。芒果苷3位酚羟基可与碱反应成盐,葡甲胺的N原子具有碱性,可与芒果苷3位酚羟基反应成盐,且N原子上连接的葡萄糖具有较高极性,羟基可与芒果苷中的羟基形成氢键,可能进一步提高芒果苷的溶解性。
[1] 张立,吴俊标,朱秋玲.芒果苷单钠盐对链脲佐菌素所致2型糖尿病小鼠胰岛素抵抗的影响[J].广东医学,2016,37(24):3650-3654.
[2] Bulugonda RK,Kumar KA,Gangappa D,et al.Mangiferin from Pueraria tuberosa reduces inflammation via inactivation of NLRP3 inflammasome[J].Sci Rep,2017,7:42683.
[3] Lobo FA,Nascimento MA,Domingues JR,et al.Foam mat drying of Tommy Atkins mango:effects of air temperature and concentrations of soy lecithin and carboxymethylcellulose on phenolic composition,mangiferin,and antioxidant capacity[J].Food Chem,2017,221:258-266.
[4] 范敏,周敏,董世庆,等.芒果苷对妊娠期糖尿病大鼠抗氧化能力的影响[J].临床和实验医学杂志,2017,16(10):943-946.
[5] Rajendran P,Rengarajan T,Nishigaki I,et al.Potent chemopre-ventive effect of mangiferin on lung carcinogenesis in experimental Swiss albino mice[J].J Cancer Res Ther,2014,10(4):1033-1039.
[6] Li H,Huang J,Yang B,et al.Mangiferin exerts antitumor activity in breast cancer cells by regulating matrix metalloproteinases,epithelial to mesenchymal transition,and beta-catenin signaling pathway[J].Toxicol Appl Pharm,2013,272(1):180-190.
[7] 胡庆华,张宪,王钰,等.芒果苷促进高尿酸血症小鼠尿酸排泄和肾功能改善以及调节相关肾脏转运体的作用[J].药学学报,2010,45(10):1239-1246.
[8] Yang H,Gao L,Niu Y,et al.Mangiferin inhibits renal urate reabsorption by modulating urate transporters in experimental hyperuricemia[J].Biol Pharm Bull,2015,38(10):1591-1598.
[9] Han D,Chen C,Zhang C,et al.Determination of mangiferin in rat plasma by liquid-liquid extraction with UPLC-MS/MS[J].J Pharm Biomed Anal,2010,51(1):260-263.
[10] 宋泽璧,吴莹,高慧.HPLC法测定盐炙前后知母中新芒果苷、芒果苷和异芒果苷[J].现代药物与临床,2015,30(2):145-148.
[11] Sanugul K,Akao T,Li Y,et al.Isolation of a human intestinal bacterium that transforms mangiferin to norathyriol and inducibility of the enzyme that cleaves a C-glucosyl bond[J].Biol Pharm Bull,2005,28(9):1672-1678.
[12] 刘葵葵,张琳,李欣,等.葡甲胺对瑞格列奈助溶作用的研究[J].中国药师,2017,20(1):189-192.
[13] 付修志,毛黎顺,孙玲,等.注射用兰索拉唑中葡甲胺含量的测定方法[J].南京工业大学学报:自然科学版,2015,37(6):131-134.
[14] 林建广,周忠,王超,等.水飞蓟宾葡甲胺的结构与溶解性[J].天然产物研究与开发,2009,21(2):214-216.
[15] Garrido G,Gonzalez D,Lemus Y,et al.Protective effects of a standard extract of Mangifera indica L.(VIMANG) against mouse ear edemas and its inhibition of eicosanoid production in J774 murine macrophages[J].Phytomedicine,2006,13(6):412-418.
Studyongroundmixtureofmangiferin-meglumine-F68
HU Li-ling1,2,MO Jiang-wen1,2,PENG Yan1,2
(1.the First College of Clinical Medical Science,China Three Gorges University,Yichang 443000,China;2.Department of Pharmacy,Yichang Central People′s Hospital,Yichang 443000,China)
ObjectiveTo improve the dissolution rate of a poorly water-soluble drug,mangiferin.MethodsGround mixture of mangiferin with meglumine and F68 were prepared by co-grinding in a ball mill.The changes in the ground mixture′s crystal were observed by microscope,the contents of the ground mixture were measured by HPLC,and the dissolution rate of the ground mixture was detected by small glass-method.ResultsMeglumine could reduce the crystal of mangiferin significantly,and the crystal was blurred after being added F68;the actual content was increased and the dissolution rate was speeded up when mangiferin-meglumine-F68 ground mixture was prepared from mangiferin.ConclusionThe dissolution rate of mangiferin can be improved by co-grinding with meglumine and F68,and the method is simple.
Mangiferin;Meglumine;F68;Ground Mixture;Dissolution
2017-05-16
1.三峡大学第一临床医学院,湖北 宜昌 443000;2.宜昌市中心人民医院药学部,湖北 宜昌 443000
宜昌市科学研究与开发项目医疗卫生课题(A13301-09);湖北省自然科学基金(2013CFB389)
10.14053/j.cnki.ppcr.201712017
