B7-1人-鼠嵌合抗体对小鼠慢性移植物抗宿主病(cGVHD)狼疮样肾炎的免疫干预效应
2018-01-03沈立军王志遥颜天铭王玉玉邱玉华
朱 莹,王 婧,沈立军,王志遥,颜天铭,王玉玉,邱玉华
B7-1人-鼠嵌合抗体对小鼠慢性移植物抗宿主病(cGVHD)狼疮样肾炎的免疫干预效应
朱 莹1,王 婧2a,沈立军2b,王志遥2c,颜天铭2c,王玉玉2c,邱玉华2c
目的探讨在诱导cGVHD小鼠狼疮样肾炎模型并通过各项指标鉴定其造模成功的基础上,运用自行研制的B7-1人-鼠嵌合抗体阻断B7/CD28共刺激信号通路对小鼠狼疮样肾炎模型病理损伤的逆转效应。方法将6~8周龄雌性(C57BL/6×BALB/c)BCF1小鼠随机分为4组,模型组于0、3、7和11 d经眼眶静脉注射100 μL雌性亲代BALB/c小鼠脾脏细胞107/只。抗体干预组在造模后第1、3、5、8、15、30及60天分别经眼眶静脉注射100 μL B7-1人-鼠嵌合抗体(克隆号2B11) 200 μg/只,环磷酰胺(CTX)干预组在末次注射淋巴细胞后第1、3、5、8、15天分别腹腔注射100 μL CTX 2.5 mg/只。按照上述时间点分析小鼠抗dsDNA抗体、ANA及尿蛋白含量,12周时处死小鼠观察肾脏组织HE染色、免疫复合物(IC)沉积等情况。结果模型组100%小鼠出现蛋白尿,尿蛋白含量为++~++++,抗体干预组12周时仅有30%的小鼠出现蛋白尿,尿蛋白含量为+~++;12周时与模型组相比,抗体干预组小鼠血清抗dsDNA抗体阳性率由50%降至0;抗体干预组ANA阳性率由90%降至40%,且荧光面积与荧光亮度均下降;HE染色镜下观察,抗体干预组肾小球囊腔大小较为均一,炎性细胞浸润减少;直接免疫荧光法可见抗体干预组肾小球血管襻IC沉积减少。结论B7-1人-鼠嵌合抗体可通过阻断或削弱B7/CD28共刺激信号通路,减少自身抗体和IC生成,逆转狼疮肾炎的病理损伤,提示该自行研制的B7-1人-鼠嵌合抗体对狼疮肾炎具有潜在的防治作用。
B7-1人-鼠嵌合抗体;抗核抗体;免疫干预;cGVHD;狼疮肾炎
0 引言
B7-1(又称CD80)是表达于活化B淋巴细胞、活化T淋巴细胞、巨噬细胞、外周血单核细胞及树突状细胞表面的重要共刺激分子,是T淋巴细胞活化时必需的膜抗原。B7-1与相应的受体CD28结合,其介导的共刺激信号不仅能促进T细胞活化、增殖、分化,也是T细胞发挥免疫效应所必需的[1]。该信号通路过度活化,则有可能导致自身免疫性疾病(Autoimmune disease,AID)的发生[2]。
AID的发病原理是自身反应性T、B细胞过度活化,产生大量自身抗体。这些自身抗体对自身抗原发生免疫反应而导致自身组织损害所引起的累及多系统、多器官的一类全身性疾病。SLE是AID的典型代表。B7/CD28共刺激信号通路的过度活化与AID的发生密切相关,已有文献报道B7-1和B7-2单克隆抗体可有效减少SLE模型小鼠免疫细胞的活化,自身抗体的生成,逆转SLE的肾脏病理损伤。
嵌合抗体(Chimeric antibody)是由鼠源性抗体的可变区基因与人抗体的恒定区基因拼接而成的嵌合基因,插入载体后转染至骨髓瘤组织表达的抗体分子。因其减少了鼠源成分,从而降低了人抗鼠抗体反应(Human anti-murine-antibody response,HAMA)[3]的发生,成为了新的研究热点。
本研究在建立和人SLE类似的慢性移植物抗宿主病(cGVHD)小鼠狼疮样肾炎疾病模型并对其进行生物学鉴定的基础上[4],运用自行研制的B7-1人-鼠嵌合抗体阻断B7/CD28共刺激信号通路对其进行干预。通过分析尿蛋白动态变化、血清中ANA和dsDNA含量、肾脏病理学改变等指标动态评价嵌合抗体对疾病模型的免疫干预效应[5],同时为该类疾病寻找新的特异、高效、低毒的生物干预手段。
1 材料与方法
1.1 材料 6~8周龄C57BL/6雄性小鼠5只,体重25~30 g;6~8周龄BALB/c雌性小鼠10只,体重25~30 g,购自上海斯莱克实验动物有限公司;Albustix尿蛋白试纸购自美国Bayer公司;PE-Anti-Human IgG(Fc)抗体购自美国eBioscience公司;PE、碱性磷酸酶(AP)-Goat-Anti-Mice IgG抗体购自美国联科生物公司;抗核抗体(ANA)和抗dsDNA抗体检测试剂盒均购自北京和杰创新生物医学科技有限公司;分泌B7-1人-鼠嵌合抗体的基因工程细胞株CHO-ch4E5(克隆号2B11)由本室自行研制。
1.2 方法
1.2.1 B7-1人-鼠嵌合抗体的制备及纯化 取生长状态良好、能稳定分泌B7-1人-鼠嵌合抗体的基因工程细胞株CHO-ch4E5(克隆号2B11)重悬接种于无血清培养基中,调整细胞浓度为106/mL,37 ℃、5% CO2滚瓶培养。6~7 d后收集上清,高速离心和超滤浓缩后,ProteinG亲和层析柱分离纯化,机器自动定量,过滤除菌,-80 ℃保存[6]。
1.2.2 B7-1人-鼠嵌合抗体对细胞膜型B7-1分子的识别 将细胞株L929-mock、转染人B7-1基因的小鼠成纤维细胞株L929-B7-1、人淋巴瘤细胞Daudi和新鲜小鼠脾脏细胞经PBS洗涤,调整细胞为每管3×105/100 μL,分别加入B7-1人鼠嵌合抗体0.5 μg/10 μL,4 ℃孵育40 min。PBS洗涤后加入2 μL(0.5 mg/mL)PE标记Anti-Human IgG(Fc)抗体,4 ℃孵育40 min,充分洗涤后经流式细胞仪分析。
1.2.3 cGVHD小鼠狼疮样肾炎模型建立 将6~8周龄雌性(C57BL/6×BALB/c)BCF1小鼠20只随机分为4组,每组5只。其中15只于0、3、7和11 d经眼眶静脉注射100 μL雌性亲代BALB/c小鼠脾脏细胞107/只。其余5只作为对照组,注射等体积生理盐水。
1.2.4 B7-1人-鼠嵌合抗体对小鼠疾病模型的免疫干预 取已经造模的15只小鼠随机分为3组,每组5只。抗体干预组:于末次注射淋巴细胞后第1、3、5、8、15、30、60天分别经眼眶静脉注射100 μL B7-1人-鼠嵌合抗体(克隆号2B11)200 μg/只[6];模型组:给予等剂量的人同型IgG;CTX干预组:于末次注射淋巴细胞后第1、3、5、8、15天分别腹腔注射100 μL CTX 2.5 mg/只。
1.2.5 尿蛋白含量的测定 末次注射淋巴细胞后每2周定时采集小鼠晨尿,Albustix试纸法检测尿蛋白。将试纸反应块浸没至尿液中,1 min内读取结果,与标准显色带比对,依据反应区显色深浅判断尿蛋白含量。
1.2.6 血清抗dsDNA抗体和ANA检测水平的测定 末次注射淋巴细胞后定时每2周采集小鼠血清,间接免疫荧光法检测抗dsDNA抗体:血清1∶100稀释后,25 μL/孔与抗原片室温避光孵育30 min,设置阴性、阳性对照。洗涤后加入抗dsDNA抗体荧光二抗25 μL/孔,室温孵育30 min,洗涤封片后荧光显微镜下观察。结果判定:抗dsDNA抗体阳性时胞核与动基体表现为均质或环状荧光,且荧光为一大一小成对出现;阴性时四膜虫虫体轮廓清晰,可看到有鞭毛,虫体内无荧光。
间接免疫荧光法检测ANA:血清1∶100稀释后,25 μL/孔与抗原片室温避光孵育30 min,设置阴性、阳性对照。洗涤后加ANA荧光二抗25 μL/孔,室温孵育30 min,洗涤封片后荧光显微镜下观察。结果判定:ANA阴性时整个细胞区域呈现极微弱亮度和本底相近的均匀荧光,ANA阳性时表现不同的核型,可分为:均质型、斑点型(又称核颗粒型、核斑块型)、核仁型、核膜型、着丝点型、线粒体型和核糖体型等。
1.2.7 肾脏病理学改变的观察 末次造模后12周颈椎脱臼处死所有小鼠。分离肾脏,一侧经10%中性福尔马林固定后制备石蜡切片,HE染色,普通光学显微镜下观察肾脏肾小球形态。
1.2.8 小鼠肾脏免疫复合物(IC)的检测 取上述制备好的肾脏石蜡切片,PBS漂洗3次后加3% BSA封闭,加入PE-羊抗鼠 IgG,4 ℃孵育过夜(18~24 h),漂洗封片后,置于落射荧光显微镜下观察IC的沉积。

杨年丰疑惑地打量高河一番,走进房间坐在床边,然后双眼直勾勾地望着高河。高河擦了擦鬓角上流下来的汗,问道:“大表哥,什么事?”
2 结果
2.1 B7-1人-鼠嵌合抗体对细胞膜型B7-1分子的识别 间接免疫荧光法及流式细胞术分析结果显示,B7-1人-鼠嵌合抗体与L929-mock、L929-B7-1、Daudi和小鼠脾脏细胞的结合率分别为1.02%、94.2%、93.8%和54.3%。见图1。
2.2 小鼠蛋白尿检测 模型组小鼠从第2周起有50%的小鼠开始出现蛋白尿,尿蛋白含量为+~+++。且尿蛋白小鼠数量和尿蛋白量随时间增长而逐渐增大。12周时,模型组100%的小鼠出现蛋白尿,尿蛋白含量为++~++++;抗体干预组同期有30%的小鼠出现蛋白尿,且尿蛋白含量均≤++;CTX干预组同期有40%的小鼠出现蛋白尿,尿蛋白含量均≤+++。对照组蛋白尿含量始终为阴性(<+)。见表1。

表1 12周时各组小鼠尿蛋白程度(只)
注:*与模型组比较,P<0.05
2.3 小鼠血清抗dsDNA抗体和ANA的检测 模型组小鼠血清抗dsDNA抗体的检测结果显示,末次注射14 d时阳性率为20%,28 d时达到50%;而ANA在14 d时阳性率为70%,28 d时上升至90%,以均质型和核膜型为主。12周时,抗体干预组和CTX干预组均未检测到抗dsDNA抗体,ANA的表达荧光亮度明显低于模型组,但仍然高于对照组。对照组在任何实验阶段均未检测到抗dsDNA抗体和ANA的表达。见图2、图3。
2.4 肾脏组织的病理学改变 HE染色显示,模型组小鼠部分肾小球体积代偿性增大,肾小球大小不一,肾小球和血管周围有大量炎性细胞浸润,壁层和脏层上皮细胞增生,可见细胞新月体生成。极少部分肾小球体积缩小,周围纤维化,甚至形成纤维新月体。肾小球囊腔可见厚薄不均一,狭窄,甚至闭塞。抗体干预组和CTX干预组肾脏病理改变轻于模型组,但仍然比对照组严重。表现为肾小球体积轻度增大,肾小球囊腔厚薄略微不均一,有少量炎性细胞浸润,未见新月体。对照组未见肾小球明显增大,大小均一,肾小球囊腔清晰可见,淋巴细胞数量未见明显增多。见图4。
2.5 肾脏组织免疫复合物荧光染色观察 实验小鼠的肾脏组织切片经直接免疫荧光法染色,结果显示,模型组肾小球部位有红色明亮的颗粒状荧光伴肾小球毛细血襻分布,可大致反映出肾小球轮廓。抗体干预组和CTX干预组肾小球部位也可见少量微弱荧光,荧光面积和荧光亮度都弱于模型组。对照组肾小球部位无荧光。见图5。
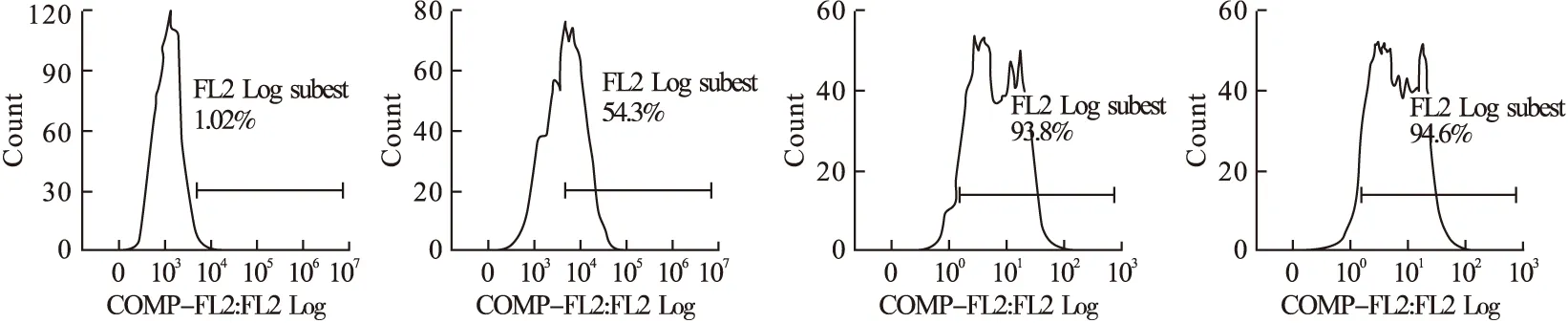
图1 B7-1人-鼠嵌合抗体对膜型B7-1分子的识别
3 讨论
红斑狼疮是一种严重的全身性自身免疫病,多发于育龄女性[7],狼疮肾炎是其最严重的并发症,也是最常见的死亡原因[8]。目前,临床上多采用糖皮质激素和免疫抑制剂来治疗红斑狼疮,而这些药物长期大量使用会带来严重的不良反应,因此,研究通过干预共刺激分子的生物疗法具有重要的意义和良好的应用前景[9]。
B7分子的表达异常与红斑狼疮的发生发展有着密切的关系。红斑狼疮患者体内APC细胞表面的CD80和CD86分子表达均高于正常人,提示红斑狼疮存在APC异常活化和增殖的现象[10-11]。
目前常用的诱导狼疮样肾炎模型的方法有2种:一种是化学法,利用降植烷(Pristane)的化学特性构建狼疮样肾炎模型;另一种是运用亲代淋巴细胞注射诱导cGVHD模型[12]。cGVHD模型具有发病机理和人类SLE类似,成模迅速(<28 d),动物来源方便,成本低,发病率高且稳定性好,病理学特点与人类SLE特点相似等优点。尿蛋白的出现是反映肾脏功能受损、肾单位滤过膜是否完整的重要标志[13]。模型组小鼠从第2周起有50%的小鼠开始出现蛋白尿,且随着时间的推移,尿蛋白小鼠的数量和尿蛋白的量也逐渐增大。到12周时,100%的模型组小鼠出现蛋白尿。抗体干预组12周时有30%的小鼠出现蛋白尿,尿蛋白的严重程度也较模型组有所减轻。

图2 小鼠12周血清抗dsDNA抗体的表达(100×)

图3 小鼠12周血清ANA的表达(400×)

图4 小鼠肾脏组织HE染色结果(400×)

图5 小鼠肾脏组织免疫复合物(IC)的沉积(400×)
在血清中检测出自身抗体是诊断系统性红斑狼疮的重要依据,临床上把血清中抗dsDNA抗体和ANA的检出视为诊断狼疮肾炎的“金标准”[14]。患者体内的抗dsDNA抗体含量与疾病的活动正相关,可作为疗效评估的指标[15]。模型组小鼠末次注射14 d时抗dsDNA抗体阳性率为20%,28 d时达到50%;而ANA在14 d时的阳性率为70%,28 d时升至90%。抗体干预组未检测出抗dsDNA抗体,ANA阳性率和荧光强度均降低。
红斑狼疮产生大量的自身抗体后,会大量沉积在肾小球基底膜,造成肾小球功能异常,引起狼疮肾炎。12周时小鼠肾脏组织病理切片HE染色结果显示,模型组部分肾小球体积代偿性增大,肾小球大小不一;肾小球血管襻和肾脏小血管周围有大量炎性细胞浸润;肾小球囊腔厚薄不均一,狭窄,闭塞;部分肾小球甚至可见到新月体。而抗体干预组仅出现少量肾小球体积轻微增大,肾小球囊腔厚薄略微不均一,有少量炎性细胞浸润,病理损伤情况得到了很大改善。免疫荧光结果可见,抗体干预组沉积在肾小球毛细血管襻附近的免疫复合物的荧光大小和亮度均小于模型组。结果表明,干预后免疫复合物在肾小球的沉积大大减少,肾小球的组织形态得到一定程度的恢复,病变的肾小球功能也得到了一定改善。
本实验通过尿蛋白、免疫学、血清学及病理学等指标动态多角度分析,说明运用B7-1嵌合抗体阻断B7-CD28共刺激信号通路,可减少自身抗体的生成,减少免疫复合物在肾脏的沉积,对小鼠狼疮样肾炎肾脏的病理损伤起到了一定程度的逆转效应。但其分子作用机制仍需进一步实验分析探讨。随着科学研究的进展,阻断共刺激分子和基因工程抗体的运用,将会部分替代现行的毒副作用较大的糖皮质激素和免疫抑制剂治疗方案,为红斑狼疮的治疗提供特异、高效、低毒的选择[16]。
[1] Birnbaum ME,Mendoza JL,Sethi DK,et al.Deconstructing the peptide-MHC specificity of T cell recognition[J].Cell,2014,157(5):1073-1087.
[2] 邱玉华,郭玲,王月丹,等.鼠抗人B7-1分子功能性单克隆抗体的制备及生物学特性[J].中国免疫学杂志,2000,16(11):589-593.
[3] Steinhoff K,Pierer M,Siegert J,et al.Visualizing inflammation activity in rheumatoid arthritis with Tc-99 m anti-CD4-mAb fragment scintigraphy[J].Nucl Med Biol,2014,41(4):350-354.
[4] 沈立军,孔永,邱玉华.Pristane诱导的系统性红斑狼疮小鼠模型的研究进展[J].中国免疫学杂志,2016,32(6):900-903.
[5] Bruschi M,Sinico RA,Moroni G,et al.Glomerular autoimmune multicomponents of human lupus nephritis in vivo:α-enolase and annexin AI[J].J Am Soc Nephrol,2014,25(11):2483-2498.
[6] Shi Q,Gao ZY,Xie F,et al.A novel monoclonal antibody against human CD80 and its immune protection in a mouse lupus-like disease[J].Int J Immunopathol Pharmacol,2011,24(3):583-593.
[7] Raymond W,Ostli-Eilertsen G,Griffiths S,et al.IL-17A levels in systemic lupus erythematosus associated with inflammatory markers and lower rates of malignancy and heart damage:evidence for a dual role[J].Eur J Rheumatol,2017,4(1):29-35.
[8] De Groof A,Hémon P,Mignen O,et al.Dysregulated lymphoid cell populations in mouse models of systemic lupus erythematosus[J].Clin Rev Allergy Immunol,2017.[Epub ahead of print]
[9] Bentzen AK,Hadrup SR.Evolution of MHC-based technologies used for detection of antigen-responsive T cells[J].Cancer Immunol Immunother,2017,66(5):657-666.
[10] Luo Q,Huang Z,Ye J,et al.PD-L1-expressing neutrophils as a novel indicator to assess disease activity and severity of systemic lupus erythematosus[J].Arthritis Res Ther,2016,18:47.
[11] 沈立军.B7-1单克隆抗体对小鼠狼疮样肾炎模型的免疫干预效应及分子机制研究[D].苏州大学,2013.
[12] 沈辉,朱玉强,孔永,等.B7-1人-鼠嵌合抗体对小鼠狼疮样肾炎模型的免疫干预效应[J].中国免疫学杂志,2015,31(9):1200-1205.
[13] 韩莲花,蔡磊,朱莹,等.慢性移植物抗宿主病狼疮样肾炎小鼠模型的建立及免疫病理学鉴定[J].现代免疫学,2014,34(2):115-119.
[14] Jackson SW,Jacobs HM,Arkatkar T,et al.B cell IFN-γ receptor signaling promotes autoimmune germinal centers via cell-intrinsic induction of BCL-6[J].J Exp Med,2016,213(5):733-750.
[15] Gao N,Dresel J,Eckstein V,et al.Impaired suppressive capacity of activation-induced regulatory B cells in systemic lupus erythematosus[J].Arthritis Rheumatol,2014,66(10):2849-2861.
[16] Scopelitis E,Biundo JJ,Alspaugh MA.Anti-SS-A antibody and other antinuclear antibodies in systemic lupus erythematosus[J].Arthritis Rheum,1980,23(3):287-293.
ImmuneinterventioneffectofB7-1chimericantibodyonlupusnephritisofchronicgraft-hostdisease(cGVHD)mice
ZHU Ying1,WANG Jing2a,SHEN Li-jun2b,WANG Zhi-yao2c,YAN Tian-ming2c,WANG Yu-yu2c,QIU Yu-hua2c
(1.Center for Clinical Laboratory,the First Affiliated Hospital of Soochow Hospital,Suzhou 215006,China;2.a.Laboratory Animal Center,b.Institutes of Biology and Medical Sciences,c.Department of Immunology,Soochow University,Suzhou 215006,China)
ObjectiveTo study the immune intervention effect of B7-1 chimeric antibody on lupus nephritis on the basis of the use of chronic graft-host disease (cGVHD) mice lupus nephritis model and its biological identification.Methods6~8 weeks aged female (C57BL/6×BALB/c)BCF1 mice were randomly divided into four groups.Each mouce in model group was intravenously injected by 100 μL orbital veins 107on the 0,3rd,7th and 11th day.Each mouse in antibody treatment group was injected B7-1 chimeric antibody by 100 μL orbital vein 200 μg on the 1st,3rd,5th,8th,15th,30th and 60th day respectively,while each mouse in CTX treatment group was injected 100 μL CTX 2.5 mg on the 1st,3rd,5th,8th and 15th day respectively.The urine protein,anti-dsDNA antibody and ANA content were analyzed at each time point.After the mice were sacrificed on the twelfth weeks,the HE staining of kidney tissue and immune complexes (IC) deposition was observed.ResultsAt the 12 th week,100% of the model mice were detected proteinuria(++~++++) while only 30% of the antibody treatment group mice(+~++).At the 12 th week,the anti-dsDNA antibody positive rate in antibody treatment group were zero while the model group were 50%,ANA positive rate were 40% while the model group were 90%;HE staining and microscopic observation,only part of the antibody treatment group appeared glomerular swelling,less lymphocyte infiltration and crescent generation;direct immunofluorescence have seen less IC deposited in glomerular vascular loops,the fluorescence area and brightness were weaker than the model group.ConclusionB7-1 chimeric antibody can decrease the generation of autoantibodies and IC,decrease the pathological damage of lupus nephritis by blocking or weakening the B7/CD28 co-signaling pathways,which suggested that self-developed B7-1 human-mouse chimeric antibody can prevent and control lupus nephritis.
B7-1 human-mouse chimeric antibody;ANA;Immune intervention;cGVHD;Lupus nephritis
2017-06-19
1.苏州大学附属第一医院临床检测中心,江苏 苏州 215006;2.苏州大学a.实验动物中心,b.生物医学研究院,c.医学部免疫学系,江苏 苏州 215006
国家自然科学基金面上项目(81373236)
10.14053/j.cnki.ppcr.201712005
