1,25-二羟维生素D3对哮喘大鼠气道平滑肌细胞增殖及RhoA表达的影响
2018-01-03田维敏吴妙心
田维敏,宿 桐,黄 萍,吴妙心
1,25-二羟维生素D3对哮喘大鼠气道平滑肌细胞增殖及RhoA表达的影响
田维敏1*,宿 桐2,黄 萍1,吴妙心1
目的观察1,25-(OH)2D3对哮喘大鼠AMSCs增殖及RhoA表达的影响,探讨其在哮喘治疗中的作用。方法用卵白蛋白致敏和激发建立急性哮喘模型,原代培养急性哮喘大鼠的ASMCs,以1,25-(OH)2D3作为干预因素,CCK8法检测1,25-(OH)2D3对ASMCs增殖的影响,测定细胞增殖活力;用TNF-α、1,25-(OH)2D3和地塞米松(DXM)处理体外培养的急性哮喘大鼠ASMCs并分组:对照组(N)、哮喘组(A组)、1,25-(OH)2D3组(VD组)、DXM组、1,25-(OH)2D3+DXM联合治疗组(L组)。用Transwell小室检测细胞迁移;流式细胞仪测定细胞周期。同时采用Real time PCR和Western blot方法检测肺组织和ASMCs中RhoA的表达变化,研究其作用机制。结果1,25-(OH)2D3在10-9~10-6mol/L浓度下能显著抑制ASMCs的增殖,且为浓度依赖性(P<0.05);1,25-(OH)2D3对哮喘大鼠的ASMCs的抗增殖作用呈现时间依赖性;1,25-(OH)2D3对哮喘大鼠的ASMCs迁移有明显的抑制作用;1,25-(OH)2D3显著抑制哮喘大鼠ASMCs细胞周期中G1/S期的转化;1,25-(OH)2D3抑制并减少了RhoA/Rho激酶信号通路中RhoA基因和蛋白的表达。结论1,25-(OH)2D3能显著抑制哮喘大鼠ASMCs的增殖、迁移及细胞周期的进展,这种多重的抑制作用可能是其通过调控RhoA/Rho激酶信号通路而实现其调节哮喘气道炎症、AHR和气道重塑的作用机制之一。
哮喘;1,25-二羟维生素D3;气道平滑肌细胞;增殖;迁移;细胞周期;RhoA
0 引言
支气管哮喘的发病机制复杂,气道慢性炎症、气道高反应性(Airway hyperresponsiveness,AHR)和不可逆性气流受阻是哮喘的三大特征,除炎症细胞外,气道结构细胞如气道平滑肌细胞(Airway smooth muscle cells,ASMCs)、成纤维细胞和上皮细胞也发挥着重要的作用[1]。ASMCs具有收缩功能,能表达黏附分子,释放细胞因子,产生基质成分和金属蛋白酶等,这些物质可促进ASMCs增殖,加重气道重构[2],并与AHR密切相关。ASMCs增生和肥大是气道重塑的主要病理改变,而气道重塑最终可导致不可逆的气流阻塞及肺功能进行性和持续性的损害,有效抑制ASMCs的过度增殖,是治疗哮喘的重要途径。
糖皮质激素是治疗哮喘的基本药物,主要通过抑制气道炎症和ASMCs增殖来治疗哮喘[3],但其长期吸入是否会导致全身不良反应仍不清楚,且糖皮质激素无法完全阻断炎性递质。有研究显示,吸入糖皮质激素可引起肾上腺功能抑制。
1,25-二羟维生素D3[1,25-dihydroxyvitamin D3,1,25-(OH)2D3] 是体内最重要的维生素D的活性代谢产物,可作用于免疫反应,在防治自身免疫性疾病方面亦有一定疗效[4-5]。1,25-(OH)2D3可有效抑制多种类型细胞的增殖和诱导细胞凋亡,Kim等[6]的研究表明,1,25-(OH)2D3抑制了VEGF诱导的ASMCs增殖并使细胞周期停滞,但其在哮喘中对ASMCs的作用机制目前尚未明确,本研究就此进行探讨。
1 材料与方法
1.1 材料 健康雌性SPF级Wistar大鼠,体重150~160 g,由厦门大学医学院动物实验中心提供。卵白蛋白(Ovalbumin,OVA)购自美国Sigma公司,灭活百日咳杆菌疫苗购于北京生物制品研究所,1,25-(OH)2D3口服制剂购自美国Sigma公司,布地奈德混悬液购自澳大利亚阿斯利康公司,重组人TNF-α、RhoA购于Peprotech公司,地塞米松(Dexamethasome,DXM)购于Sigma公司。
1.2 方法
1.2.1 模型制作 按照Wistar大鼠哮喘模型制作方法制作哮喘模型[7]。根据随机化分配原则将40只SPF级Wistar大鼠分为5组,每组8只。正常对照组(N组)、哮喘组(A组)、1,25-(OH)2D3组(VD组)、布地奈德组(P组)和1,25-(OH)2D3与吸入用布地奈德混悬液联合治疗组(L组)。
1.2.2 取材、细胞的纯化及传代 取前述哮喘模型大鼠,10%水合氯醛40 mg/kg麻醉,无菌取气管,剥离气管内、外膜及软骨,剪碎剩余的平滑肌条。经离心,胰酶和Ⅳ型胶原酶消化后,应用差速贴壁法来纯化细胞,然后接种至培养瓶中进行培养,当细胞长至80%~90%融合时进行传代。
1.2.3 细胞分组 将培养至4~6代长致80%融合的急性哮喘模型大鼠的ASMCs做同步化处理,进行分组并参照文献[4-5,8-9]处理细胞:对照组(N组)为急性哮喘模型组、TNF-α组(A组)、1,25-(OH)2D3组(VD组)、DXM组(P组)、1,25-(OH)2D3+DXM 联合治疗组(L组)。
1.2.4 确定1,25-(OH)2D3作用的最佳浓度 取对数生长期的ASMCs,以6×103/well接种于96孔培养板内孵育,待细胞完全贴壁伸展后将其同步化,给予TNF-α刺激,并将细胞分6个亚组:分别加入10-6~10-11mol/L 1,25-(OH)2D3孵育24 h,每孔加入CCK8液孵育1 h,选择450 nm波长,用自动酶联检测仪测定各孔吸光度值,记录、分析、确定1,25-(OH)2D3最佳作用浓度。
1.2.5 确定1,25-(OH)2D3作用的最佳时间 继续用CCK8法对1,25-(OH)2D3进行多时间点的抗增殖作用检测。分别于1,25-(OH)2D3刺激后12、24、36、48 h各取一块培养板,检测A450nm值,比较各时间点下1,25-(OH)2D3对ASMCs的增殖抑制率,确定1,25-(OH)2D3的最佳作用时间。
1.2.6 Transwell小室检测ASMCs的跨膜迁移 将Transwell小室上下室之间用预处理的孔径8 μm的聚碳酸脂膜隔开。上室加入细胞悬液,下室加入趋化诱导物。按“1.2.3”项下方法分组,24 h后加入24孔板中,置于培养箱培养24 h,细胞通过膜上的小孔迁移、黏附到膜的下面,将膜下面的ASMCs经固定、染色、透明及封片,倒置显微镜(200×)下随机计数5个视野的细胞数,取均值。
1.2.7 流式细胞仪检测 ASMCs的细胞周期取对数生长期ASMCs接种于25 mL培养瓶内,细胞完全贴壁伸展且汇合近瓶底面积的80%时,弃上清。按Transwell小室细胞分组方法给细胞分组和处理,孵育24 h,然后消化、水洗,制备细胞悬液,经离心、弃上清、酒精固定等处理后,将1×10-7个ASMCs悬浮于1 mL碘化吡啶染液中37 ℃避光30 min,用流式细胞仪检测各组细胞周期。
依公式PI=(S+G2/M)/(G0/1+S+G2/M)×100%计算细胞增殖指数(PI)。
询问了解患者的亚急性甲状腺炎情况与病史,对患者进行详细的身体检查,进行确切的诊断,了解患者的禁忌情况等,以上检查与询问情况进行保密。本组患者同时进行核医学及超声检查。
1.2.8 RT-PCR检测大鼠肺组织和ASMCs中RhoA的mRNA表达 采用SYBR Green I荧光染料嵌合法,分别制作目的基因RhoA和管家基因GAPDH的标准曲线。利用标准曲线对样品中的目的基因和管家基因分别进行定量。采用TRIzol法抽提总RNA,并逆转录合成cDNA,再以此模板进行PCR扩增。引物序列见表1。

表1 引物序列
扩增片段长度114 bp。反应条件:95 ℃变性30 s,95 ℃退火5 s,60 ℃延伸34 s,共40个循环。以预实验中Ct值为18的样品作为标准品,用RNasefree dH20依次稀释,与样品同时扩增。反应结束后进行标准梯度点分析,若相关系数γ2>0.96,表明线性关系良好,可确定为定量标准曲线。根据标准曲线,荧光定量PCR仪自动分析并计算结果,待测基因mRNA的相对表达量应用2-△△Ct方法得出相对倍数。
1.2.9 Western blot检测各组大鼠肺组织及细胞中RhoA蛋白表达 取出冻存的标本,将组织块剪碎,消化收集各组细胞,裂解离心提取蛋白质,将样本用裂解缓冲液稀释,各标本蛋白上样50 μL,上清用12% 聚丙烯酰胺凝胶电泳后,再转印至硝酸纤维素膜。用含5%去脂奶粉的TBS封闭4 ℃过夜。取出膜后,TBS洗膜,加入一抗(1∶400),室温下孵育2 h,加入碱性磷酸酶标记的二抗(1∶2 000),室温下孵育2 h,清洗,发光。每组实验均重复3次,采用FlourChem V 2.0凝胶成像分析软件(America)分析,记录每条蛋白电泳带的灰度值,进行定量分析。蛋白含量=样本蛋白灰度值/同一样本β-actin灰度值。

2 结果
2.1 CCK8法检测1,25(OH)2D3对ASMCs增殖活力的影响 在TNF-α刺激的ASMCs增殖的基础上,分别加入不同浓度1,25(OH)2D3培养24 h,用CCK8法测定各组A450nm吸光度值,发现10-9~10-6mol/L的VD组A450nm值均较A组明显下降,具有浓度依赖性,因10-7mol/L作用已非常明显,故选10-7mol/L作为后续的实验研究,见表2。

表2 不同浓度1,25(OH)2D3对ASMCs增殖活力的影响(n=8)
注:a.与N组比较,P<0.01;b.与A组、VD 10-11mol/L、VD 10-10mol/L比较,P<0.01;c.与VD 10-9mol/L比较,P<0.01;d.与VD 10-8mol/L比较,P<0.05;e.与VD 10-8mol/L比较,P<0.01;f.与VD 10-7mol/L比较,P<0.01
2.2 用CCK8法对10-7mol/L 1,25(OH)2D3抗ASMCs增殖的多时间点作用的检测 用CCK8法对10-7mol/L 1,25(OH)2D3进行多时间点的抗增殖作用检测,可见随时间延长,1,25(OH)2D3对TNF-α刺激的ASMCs的抗增殖作用越明显,具有时间依赖性,见表3。

表3 10-7mol/L 1,25(OH)2D3对TNF-α刺激的ASMCs增殖的影响(A450nm吸光度值)(n=8)
注:a.与N组比较,P<0.05;b.与A组比较,P<0.05
2.3 1,25(OH)2D3对TNF-α刺激的ASMCs迁移的影响 由表4可见,1,25(OH)2D3对TNF-α刺激的ASMCs的迁移有明显的抑制作用,其迁移细胞数较A组明显减少(P<0.01),较P组增多,差异有统计学意义(P<0.01);联合治疗组较VD组和P组明显减少,差异有统计学意义(P<0.05)。提示1,25(OH)2D3可以抑制TNF-α诱导的ASMCs迁移,但其作用弱于DXM,二者联合应用作用明显。
2.4 1,25(OH)2D3对TNF-α处理的ASMCs细胞周期的影响 采用流式细胞仪检测各组细胞的细胞周期。结果显示,TNF-α刺激后,ASMCs的PI较N组明显增高(P<0.05),而VD组PI降低(P<0.05);进一步比较细胞周期的时相分布,可见1,25(OH)2D3显著增加了TNF-α刺激的G0/1期比例(P<0.05),相应地减少了S期及G2/M期的比例(P<0.05),即阻止了细胞由G0/1期向S期的转化;但其作用弱于P组和L组(P<0.05),见表5。

表4 各组ASMCs迁移情况(n=8)
注:a.与N组比较,P<0.01;b.与A组比较,P<0.05;c.与VD组比较,P<0.05;d.与P组比较,P<0.05

表5 各组ASMCs细胞周期比较(n=5)
注:a.与N组比较,P<0.05;b.与A组比较,P<0.05;c.与VD组比较,P<0.05;d.与P组比较,P<0.05
2.5 Real time PCR检测1,25(OH)2D3对哮喘大鼠气道及平滑肌细胞RhoA mRNA表达的影响 实时定量PCR的相对定量分析显示,在肺组织与ASMCs水平上,各模型组大鼠RhoA特异产物的融解温度为88.0 ℃。经GAPDH内参照标化后,比较各目的基因mRNA的相对含量,可见各组均较C组增高(P<0.01);各治疗组经治疗后,较TNF-α组显著下降(P<0.01);1,25(OH)2D3作用弱于P组和L组(P<0.01);L组作用明显优于VD组、P组,组织水平上仍高于N组(P<0.05),但细胞水平上与N组比较差异无统计学意义(P>0.05),见表6。
2.6 Western blot检测1,25(OH)2D3对哮喘大鼠气道及平滑肌细胞RhoA蛋白表达的影响 在肺组织与ASMCs水平上,VD组、P组及L组均显著下调了哮喘大鼠RhoA的蛋白表达(P<0.01);L组与N组比较,差异无统计学意义(P>0.05)。说明在治疗哮喘方面,1,25(OH)2D3与糖皮质激素联合应用有协同效应,见表7、图1、图2。
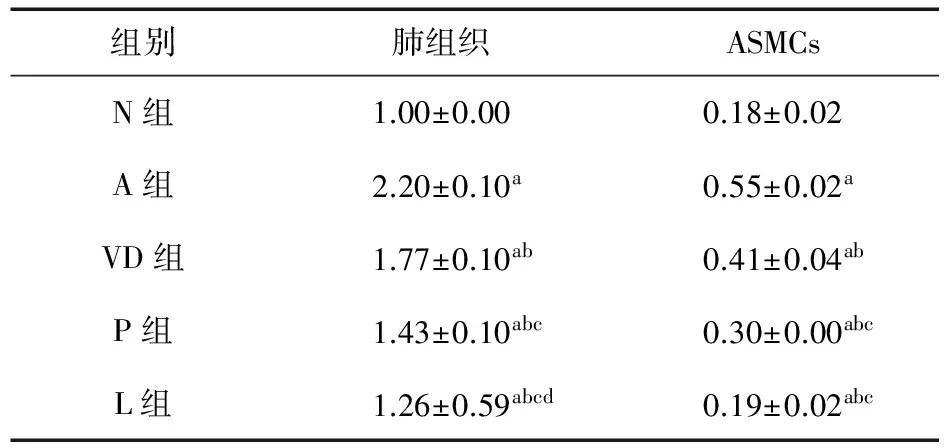
表6 各组大鼠肺组织及ASMCs中RhoA mRNA表达
注:a.与N组比较,P<0.01;b.与A组比较,P<0.01;c.与VD组比较,P<0.01;d.与P组比较,P<0.01
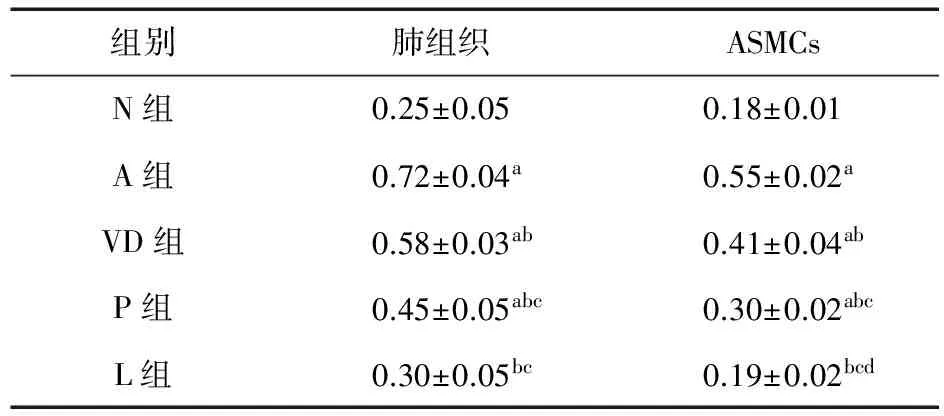
表7 各组大鼠肺组织及ASMCs中RhoA蛋白表达灰度值(n=3)
注:a.与N组比较,P<0.01;b.与A组比较,P<0.01;c.与VD组比较,P<0.01;d.与P组比较,P<0.05
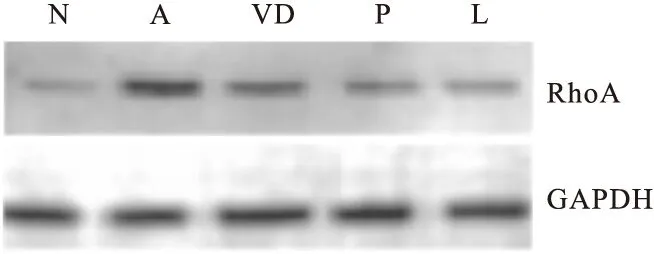
图1 肺组织中RhoA的蛋白表达

图2 ASMCs中RhoA的蛋白表达
3 讨论
哮喘是一种以气道慢性炎症、AHR和气道重塑为特征的异质性疾病。气道重塑是指发生在气道的结构改变,包括炎症细胞浸润、杯状细胞增生、黏液分泌增加、细胞外基质沉积、基底膜和平滑肌层增厚、新生血管生成等[10],与气道慢性炎症、ASMC功能紊乱共同构成支气管哮喘的三个主要病理特征。气道重塑与哮喘患者预后不良有关,直接影响患者病情转归。因此,识别支气管气道重塑的分子生物学机制对哮喘的治疗尤为重要。
ASMCs是各种炎症介质和神经递质引起收缩的部分,也是各种炎症因子、细胞因子、趋化因子及生长因子的来源,存在收缩和合成两种表型,二者在一定条件下可以相互转化,其特点为强大的生长和迁移能力。ASMCs的迁移是哮喘气道重塑的重要特征之一。各种丝裂原和介导ASMCs增殖的信号转导途径均可导致ASMCs的增殖、迁移和细胞周期的进展[11-13]。细胞周期有两个关键性限制点,分别为G1/S 期、G2/M 期[14],细胞在G1期对细胞外信号发生应答,如能越过G1/S 期限制点,则细胞周期就可自主进行,故G1期时程决定了细胞周期的长短。哮喘时,细胞外的各种丝裂原通过不同的信号转导途径促进ASMCs 增殖,因此,若能阻断细胞完成细胞分裂周期,就可望达到控制或逆转气道重构的目的,从而控制哮喘。
Rho/Rock信号通路参与细胞的多种生物学行为,可调节结构细胞、炎症细胞、细胞因子和炎症介质等[15]。Rho蛋白是具有GTP酶活性的Ras超家族中的小分子G蛋白成员,以活化的Rho-GTP 形式和非活化的Rho-GDP 形式两种状态存在于细胞质中,具有活性的RhoA可影响细胞的骨架结构和形态,使平滑肌产生收缩等生理功能。Rock是Rho 激酶下游靶效应分子,以两种同源性极高的异构体形式存在(Roka/Rock2、Rokβ/Rockl),分别存在于肺、肝脏、骨骼肌、心脏等组织器官中[16]。多种炎症介质和细胞因子等可使Rho活化,ROCK与GTP结合蛋白Rho相互作用,通过磷酸化激活多种下游蛋白或核因子,从而引起细胞骨架、肌动蛋白纤维的形成和组装,在机体的各项调节功能中起重要作用。研究表明,Rho/Rho激酶信号通路选择性抑制剂可明显抑制5-HT诱导的大鼠ASMC的增殖,且使细胞停滞于G0/G1期。抑制Rho激酶可以减少气道重塑和AHR,还可以减少气道炎症和氧化应激[17]。综上所述,Rho/Rock激酶信号通路可通过介导ASM收缩、成肌纤维细胞分化和ASMCs成熟、气道壁间质细胞增殖和迁移以及炎症细胞的迁移,在哮喘等慢性气道炎症疾病的发生过程中发挥重要作用。
吸入糖皮质激素是目前长期预防和治疗哮喘的一线药物[18],主要通过抑制气道炎症治疗哮喘,并能有效抑制ASMCs 的增殖,但其作用是非特异的,长期应用会引起一系列代谢及内分泌紊乱等不良反应,且随着病程的进展,哮喘患者还有可能出现不同程度的气道重塑,最终发展成为不可逆的气流阻塞。
维生素D缺乏与哮喘、过敏性鼻炎和喘息密切相关[19-20],可导致哮喘加重[21],增加炎症介质诱导的气道重塑[22]。1,25-(OH)2D3可抑制多种类型细胞的增殖和细胞因子的产生[23],同时可诱导细胞的凋亡和分化[24]。本课题组既往研究发现,1,25-(OH)2D3通过部分抑制哮喘大鼠气道和血清中Eotaxin、IL-8、IgE的产生等来减少气道炎症、AHR和改善肺功能[25]。另有研究发现,维生素D可增强激素抵抗性哮喘和激素敏感性哮喘患者单核细胞的抗炎效应,并可增强激素的作用[26]。Th17细胞因子在哮喘,包括激素抵抗性哮喘的发病机制中起重要作用,严重哮喘患者Th17细胞因子水平增加。Th17不能被类固醇激素抑制,而1,25-(OH)2D3可通过T细胞和DCs介导的通路抑制Th17细胞因子的产生,表明维生素D对于哮喘患者可增强类固醇的效应[27-28]。
本实验采用CCK8法检测在10-11~10-6mol/L浓度范围内1,25(OH)2D3对ASMCs增殖活力的影响。研究发现,1,25-(OH)2D3在10-9~10-6mol/L浓度范围内对ASMCs表现出明显的浓度依赖性的增殖抑制作用;1,25(OH)2D3可抑制哮喘大鼠的ASMCs的增殖和迁移,将细胞阻滞在细胞周期的G1期而产生增殖抑制效应。1,25-(OH)2D3减少了RhoA蛋白和mRNA的表达,抑制了Rho/ROCK信号通路,进而抑制了哮喘的气道炎症、AHR和气道重塑。1,25-(OH)2D3在本部分试验中的作用弱于糖皮质激素,但联合应用作用明显,表明1,25(OH)2D3可以增强类固醇效应。然而,亦有研究发现,维生素D3并没有降低持续性哮喘和维生素D缺乏的成人哮喘患者首次治疗失败或加重的发生率[29],这些研究结果不支持有症状的哮喘患者补充维生素D3治疗的战略。因此,1,25-(OH)2D3,在临床上是否能辅助糖皮质激素治疗哮喘,还有待于进一步探讨,以期发现更合理的临床应用方式。
[1] Carlin SM,Resink TJ,Tamm M,et al.Urokinase signal transduction and its role in cell migration[J].FASEB,2005,19(2):195-202.
[2] Black JL,Roth M,Lee J,et al.Mechanisms of airway remodeling:airway smooth muscle[J].Am J Respir Crit Care Med,2001,164 (10 Pt 2):63-66.
[3] Ammit AJ,Pamettieri RA Jr.Invited review:the circle of life:cell cycle regulation in airway smooth muscle[J].Appl Physiol,2001,91(3):1431-1437.
[4] Goltzman D,Miao D,Panda DK,et al.Effect of calcium and the vitamin D system on skeletal and calcium homeostasis:lessons from genetic models[J].Steroid Biochem Mol Biol,2004,89/90:485-489.
[5] Yamada S,Shimizu M,Yamamoto K.Structure function relationships of vitamin D including ligand recognition by the vitamin D receptor[J].Med Res Rev,2003,23(1):89-115.
[6] Kim SH,Pei QM,Jiang P,et al.Effect of active vitamin D3on VEGF-induced ADAM33 expression and proliferation in human airway smooth muscle cells:implications for asthma treatment[J].Respir Res,2017,18(1):7.
[7] Vanacker NJ,Palmans E,Kips JC,et al.Fluticasone inhibits but does not reverse allergen-induced structural airway changes[J].Am J Respir Crit Care Med,2001,163:674-679.
[8] Xu SY,Xu YJ,Zhang ZX,et al.Contribution of protein kinase C to passively sensitized human airway smooth muscle cells proliferation[J].Chin Med J(Engl),2004,117(1):30-36.
[9] Poon AH,Laprise C,Lemire M,et al.Association of vitamin D receptor genetic variants with susceptibility to asthma and atopy[J].Am J Respir Crit Care Med,2004,170:967-973.
[10] Shifren A,Witt C,Christie C,et al.Mechanisms of remodeling in asthmatic airways[J].J Allergy(Cairo),2012,2012:316049.
[11] Takeda N,Sumi Y,Préfontaine D,et al.Epithelium-derived chemokines induce airway smooth muscle cell migration[J].Clin Exp Allergy,2009,39(7):1018-1026.
[12] Stamatiou R,Paraskeva E,Gourgoulianis K,et al.Cytokines and growth factors promote airway smooth muscle cellproliferation[J].ISRN Inflamm,2012,2012:731472.
[13] Yang YG,Tian WM,Zhang H,et al.Nerve growth factor exacerbates allergic lung inflammation and airway remodeling in a rat model of chronic asthma[J].Exp Ther Med,2013,6(5):1251-1258.
[14] Blagosklonny MV,Pardee AB.The restriction point of the cell cycle[J].Cell Cycle,2002,10(2):103-110.
[15] Palermo B,Garbelli S,Mantovani S,et al.Qualitative difference between the cytofoxic T lymphocyte responses to melanocyte antigens in melanoma and vitiligo[J].Eur J Immunol.2005,35(11):3153-3162.
[16] Amano M,Nakayama M,Kaibuchi K.Rho-kinase/ROCK:A key regulator of the cytoskeleton and cell polarity[J].Cytoskeleton(Hoboken),2010,67(9):545-554.
[17] Possa SS,Charafeddine HT,Righetti RF,et al.Rho-kinase inhibition attenuates airway responsiveness,inflammation,matrix remodeling,and oxidative stress activation induced by chronic inflammation[J].Am J Physiol Lung Cell Mol Physiol,2012,303(11):L939-L952.
[18] 申昆玲,李云珠,李昌崇,等.糖皮质激素雾化吸入疗法在儿科应用的专家共识[J].临床儿科杂志,2011,29(1):86-91.
[19] Bener A,Ehlayel MS,Bener HZ,et al.The impact of Vitamin D deficiency on asthma,allergic rhinitis and wheezing in children:An emerging public health problem[J].Family Community Med,2014,21(3):154-161.
[20] 谭力,吴澄清,张泉.支气管哮喘患儿血清25-羟维生素D3水平及其与肺功能、呼出气一氧化氮的关系[J].中国小儿急救医学,2016,23(9):613-615,630.
[21] Salas NM,Luo L,Harkins MS.Vitamin D deficiency and adult asthma exacerbations[J].Asthma,2014,51(9):950-955.
[22] Sypniewska G,Krintus M,Fulgheri G,et al.25-Hydroxyvitamin D,biomarkers of eosinophilic inflammation,and airway remodeling in children with newly diagnosed untreated asthma[J].Allergy Asthma Proc,2017,38(3):29-36.
[23] Damera G,Fogle HW,Lim P,et al.Vitamin D inhibits growth of human airway smooth muscle cells through growth factor-induced phosphorylation of retinoblastoma protein and checkpoint kinase 1[J].Br J Pharmacol,2009,158(6):1429-1441.

[25] Tian WM,Yang YG,Shang YX,et al.Role of 1,25-dihydroxyvitamin D3in the treatment of asthma[J].Eur Rev Med Pharmacol,2014,18(12):1762-1769.
[26] Zhang Y,Leung DY,Goleva E.Anti-inflammatory and corticosteroid-enhancing actions of vitamin D in monocytes of patients with steroid-resistant and those with steroid-sensitive asthma[J].Allergy Clin Immunol,2014,133(6):1744-1752.
[27] Hamzaoui A,Berraïes A,Hamdi B,et al.Vitamin D reduces the differentiation and expansion of Th17 cells in young asthmatic children[J].Immunobiology,2014,219(11):873-879.
[28] Nanzer AM,Chambers ES,Ryanna K,et al.Enhanced production of IL-17A in patients with severe asthma is inhibited by 1,25-dihydroxyvitamin D3in a glucocorticoid-independent fashion[J].J Allergy Clin Immunol,2013,132(2):297-304,e3.
[29] Castro M,King TS,Kunselman SJ,et al.Effect of vitamin D3on asthma treatment failures in adults with symptomatic asthma and lower vitamin D levels:the VIDA randomized clinical trial[J].JAMA,2014,311(20):2083-2091.
Effectsof1,25-dihydroxyvitaminD3onproliferationofASMCsandRhoAinasthmaticrats
TIAN Wei-min1*,SU Tong2,HUANG Ping1,WU Miao-xin1
(1.Department of Pediatrics,Zhongshan Hospital,Xiamen University,Xiamen 361004,China;2.the First Clinical College,Tongji Medical College of Huazhong University of Science and Technology,Wuhan 430030,China)
ObjectiveTo observe the effect of 1,25-(OH)2D3on proliferation of ASMCs and RhoA in asthma rats,and explore its role in the treatment of asthma.MethodsAcute asthma models of Wistar rats were established with ovalbumin sensitizing and challenging,ASMCs of acute asthmatic rats were primarily cultured.1,25-(OH)2D3as the intervention factors,the effect of 1,25-(OH)2D3on proliferation and proliferation activity of ASMCs was determined by CCK8.The cultured ASMCs of acute asthma rat in vitro were divided into 5 groups:control group (group N),TNF-α group (group A),1,25-(OH)2D3group (group VD),DXM group,1,25-(OH)2D3+DXM group (group L). The cell migration was detected by Transwell chamber;cell cycle was analyzed by flow cytometry. Meanwhile,the expression of RhoA in lung tissue and ASMCs was detected by Real time PCR and Western blot,and the mechanism of action was analyzed.Results1,25-(OH)2D3could significantly inhibit the proliferation of ASMCs in a concentration dependent manner (P<0.05);1,25-(OH)2D3had anti-proliferative effects on ASMCs of asthmatic rats in a time dependent manner;1,25-(OH)2D3had obviously inhibitory effect on the migration of ASMCs in asthmatic rats;1,25-(OH)2D3could significantly inhibit the cell cycle conversion during G1/S period in ASMCs of asthma rats;1,25- (OH)2D3could inhibit and decrease the expression of RhoA gene and protein in Rho/Rho kinase signaling pathway.Conclusion1,25-(OH)2D3can inhibit the proliferation,migration and cell cycle progression of ASMCs,which may be one of the mechanisms by which RhoA/Rho kinase signaling pathway regulates airway inflammation,AHR and airway remodeling in asthma.
Asthma;1,25-(OH)2D3;ASMCs;Proliferation;Migration;Cell cycle;RhoA
2017-06-05
1.厦门大学附属中山医院儿科,厦门 361004;2.华中科技大学同济医学院第一临床学院,武汉 430030
福建省自然科学基金项目(2016J01615)
*
10.14053/j.cnki.ppcr.201712002
