胃肠间质瘤临床、病理及预后因素的分析
2018-01-02张士岭
陈 鲧,张士岭
(1.宁波市鄞州人民医院 病理科,浙江 宁波 315040;2.宁波市临床病理诊断中心 实验病理科,浙江 宁波 315000)
胃肠间质瘤临床、病理及预后因素的分析
陈 鲧1,张士岭2
(1.宁波市鄞州人民医院 病理科,浙江 宁波 315040;2.宁波市临床病理诊断中心 实验病理科,浙江 宁波 315000)
目的总结胃肠间质瘤(gastrointestinal stromal tumors,GIST)常见的临床、病理因素,找出影响其预后的独立危险因素。方法收集术后经病理和免疫组化检测确诊为GIST的患者86例;对GIST的各种临床、病理因素与5年生存率进行单因素分析,对单因素分析中有差异的指标进行Logistic回归分析,找出影响预后的独立危险因素。结果单因素分析显示,肿瘤完整切除与否、切缘情况、破裂与否、转移与否、细胞核分裂像计数、Ki-67指数(5%)、NIH评估分级以及术后是否服药甲磺酸伊马替尼与5年生存率关系密切,差异具有统计学意义(均P<0.05);Logistic回归分析显示,肿瘤完整切除与否、切缘情况、破裂与否、转移与否、Ki-67指数(5%)、细胞核分裂像计数、NIH评估分级以及术后是否服用甲磺酸伊马替尼均为影响患者预后的独立危险因素(均P<0.05)。结论肿瘤完整切除与否、切缘情况、破裂与否、转移与否、Ki-67指数(5%)、细胞核分裂像计数、NIH评估分级以及术后是否服用甲磺酸伊马替尼均影响患者预后。
胃肠间质瘤;临床;病理;预后
胃肠间质瘤(gastrointestinal stromal tumors,GIST)是位于腹腔的间叶源性肿瘤,最多见于胃和小肠,其次是结直肠、食管、大网膜以及肠系膜等部位。GIST患者往往缺乏特异性的临床症状,大多数症状通常与肿瘤的部位和大小有一定关系,如腹部包块、腹部疼痛、消化道出血等等,甚至有10%~30%的患者没有任何不适。目前已证实,在GIST的发生、发展过程中,c-kit基因与PDGFRA基因的突变起到了关键性作用;而2013版的中国胃肠间质瘤诊断治疗共识也明确GIST的最终确诊必须结合病理检测和免疫组化检测(CD34、CD117、DOG-1、Ki-67等)的结果[1]。手术是GIST最有效的治疗手段,但由于较高的复发率导致不少患者的预后不甚理想。本研究回顾性分析GIST患者的临床资料,试图通过总结GIST常见的临床、病理因素,运用多因素回归分析,找出可能影响预后的独立危险因素。
1 资料与方法
1.1 一般资料 收集2011年1月—2012年1月我院胃肠外科术后经病理和免疫组化检测确诊为GIST的患者86例,均为初次诊断GIST的患者,临床、病理及随访记录完整;手术治疗前均未给予放或化疗,术后行病理学检查以及免疫组化检查确诊;排除随访期间失访者、缺乏完整的复诊资料、出现干扰本研究结论的事件或重大疾病者。所有入选者中,男51例,女35例,年龄22~76岁,平均52.17±8.26岁;病变部位:胃49例,十二指肠13例,空肠与回肠19例,结肠与直肠5例;手术方式:开放性手术切除68例,腹腔镜下切除16例,内镜下(胃镜与肠镜)切除2例;肿瘤大小1~27 cm,平均6.74±0.72 cm;切缘阴性者(R0)75例,切源阳性者(R1、R2)11例;本研究经医院伦理委员会批准,患者及家属知情同意。
1.2 治疗及随访 86例均接受手术,其中46例给予甲磺酸伊马替尼(Imatinib mesylate)400 mg/d,6~36个月。手术结束后,86例患者通过门诊、登门、电话等方式进行随访,本研究最后一次随访日为2017年1月31日。生存时间定义为从术后第1日至失访、死亡或最后随访日[2]。
1.3 病理学检查 所有86例手术标准常规送病理检查,制作常规病理切片。观察并记录标本最大直径、切除是否完整、肿瘤有无破裂、组织学形态、是否存在转移以及核分裂等。
1.4 免疫组化检测 采用S-P法,检测GIST组织中DOG1、CD34 、CD117和Ki-67的表达。经过脱蜡、水化、PBS反复冲洗、阻断、抗原修复、封闭和滴加抗体等步骤,于400倍显微镜下观察。
阳性细胞判定标准:以胞浆或胞膜内出现黄色至深褐色颗粒为阳性细胞标准。结果判断:每张切片阳性细胞数量<5%为阴性(-);5%~10%为弱阳性(+);10%~50%为阳性(++);>50%为强阳性(+++)。Ki-67(%)指数按5进行分层统计。
1.5 GIST良恶性危险度评估 所有标本的病理切片均于50倍光学显微镜下进行细胞核分裂像计数。按照2008年改良的美国国立卫生研究所(National Institutes of Health,NIH)标准进行GIST良恶性危险度评估分级,分为极低危、低危、中危和高危4个级别[3]。
1.6 统计学方法 采用SPSS19.0软件进行统计处理。计数资料组间比较采用χ2检验;间质瘤预后的独立因素采用Logistic回归分析;P<0.05为差异具有统计学意义。
2 结果
2.1 间质瘤患者 各种临床、病理因素与5年生存率的单因素分析 分析结果显示,性别、年龄、肿瘤部位、肿瘤直径、肿瘤的组织学形态以及各免疫组化指标的表达(DOG1、CD34、CD117)均与5年生存率无关,差异无统计学意义(均P>0.05);肿瘤完整切除与否、切缘情况、破裂与否、转移与否、细胞核分裂像计数、Ki-67指数(5%)、NIH评估分级以及术后是否服用甲磺酸伊马替尼与5年生存率关系密切,差异具有统计学意义(均P<0.05)。见表1。

表1 86例间质瘤患者各种临床、病理因素与5年生存率的单因素分析
◆核分裂数:个/50HP;★IM:甲磺酸伊马替尼。
2.2 影响间质瘤患者预后独立危险因素的Logistic回归分析 以单因素分析结果中与5年生存率相关的因素为自变量,5年生存率为因变量,通过Logistic回归分析,结果显示:肿瘤完整切除与否、切缘情况、破裂与否、转移与否、Ki-67指数(5%)、细胞核分裂像计数、NIH评估分级以及术后是否服用甲磺酸伊马替尼均为影响患者预后的独立危险因素(均P<0.05)。见表2。
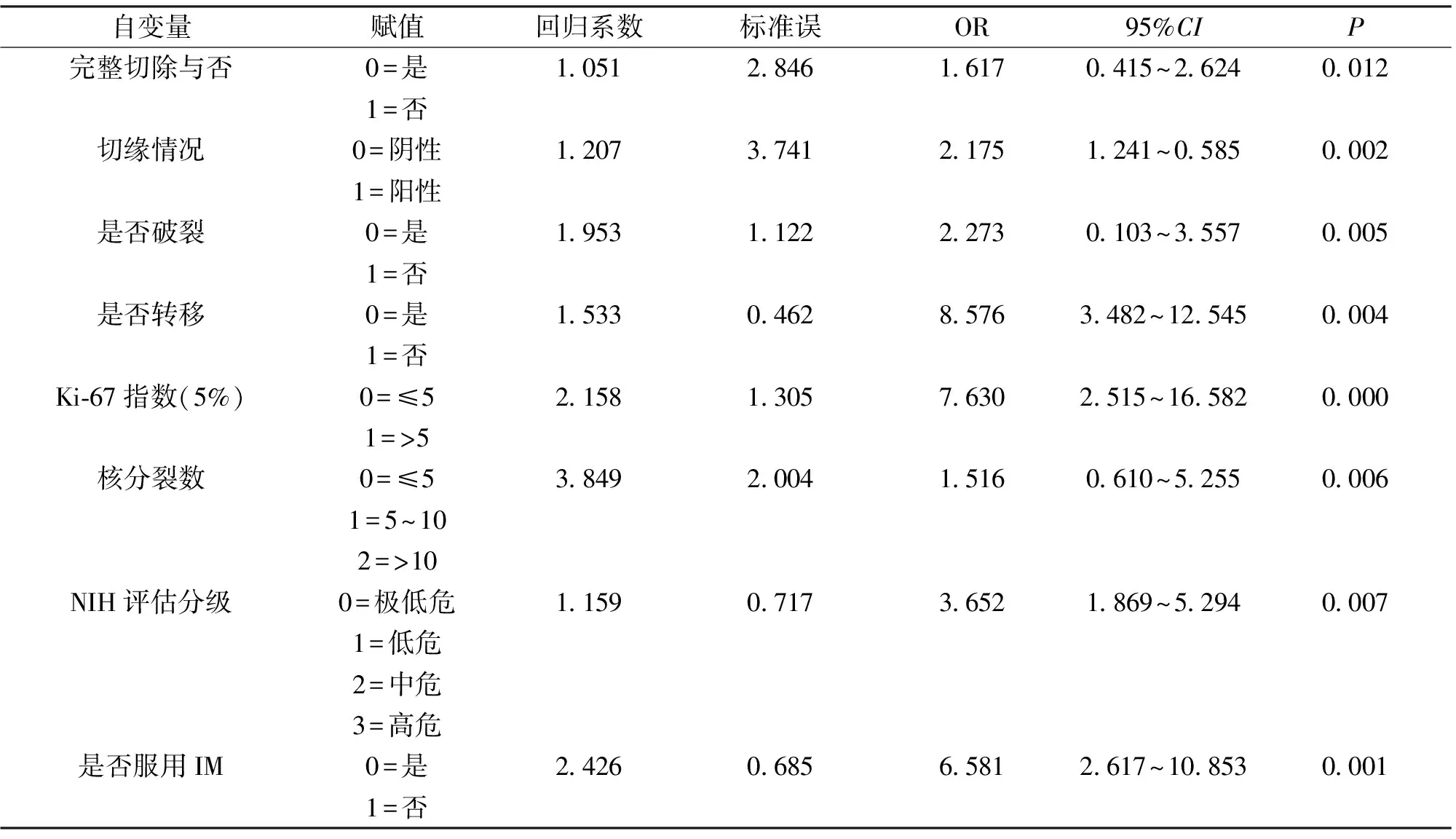
表2 影响间质瘤患者预后独立危险因素的Logistic回归分析
3 讨论
文献报道[4],GIST可见于不同年龄段,学龄前儿童和青少年少见,在西方国家,男女发病比例为1.27∶1,但均未显示年龄、性别与预后相关,与本文结论相同。GIST好发部位依次是胃、小肠、大肠、食管以及大网膜等,资料显示[5],肿瘤部位与肿瘤大小对于临床症状具有重要影响,但也不能作为评判预后的独立危险因素,也与本文结论一致。
GIST的确诊需结合病理与免疫组化的检测。按细胞学类型[6],GIST分为梭形、上皮形和混合型,其中以梭形居多;文献显示[7],单靠病理学检测无法对GIST作出明确诊断也无法判断预后,故免疫组化的检测必不可少。CD117是c-kit原癌基因的蛋白产物,CD34是骨髓造血前体细胞抗原,由于其在GIST的诊断上存在阴性的可能,而DOG1(Discovered on GIST-1)作为GIST新近标志物,较CD117和CD34具有更高的敏感性、特异性以及阳性表达,自2013年起,中国胃肠间质瘤诊断治疗共识把DOG-1与CD117作为共同诊断GIST的指标,但并未指出这些肿瘤标记物可用于推测预后[1]。同样,本文的统计结果也没有发现GIST的病理学和免疫组化的检测可用于预后判断。
肿瘤的良恶性划分对于预后的判断具有重大意义。恶性程度越高,肿瘤细胞的核分裂越旺盛,预后越差,这一点于本文再次得到验证。Ki-67作为一种与恶性肿瘤细胞增殖相关的核蛋白,越来越多地被病理医师所关注。国外文献报道[8],在手术后对GIST标本进行Ki-67蛋白免疫组化检测,发现其表达与核分裂像与高复发风险相关,故推荐Ki-67作为GIST预后判断的参考因素。国内也有学者[9]在对GIST进行研究后得出,Ki-67的表达和核分裂像具有良好的一致性,且Ki-67指数可作为对NIH复发风险评估的有效补充。本文显示,Ki-67指数以5%进行分层,5年生存率具有明显差异,并且可作为GIST的独立预后因子,这与文献报道基本吻合。2008年Joensuu[3]以肿瘤部位、直径、核分裂数及肿瘤破裂完善了GIST的NIH恶性评估分级,并将其分为极低危、低危、中危和高危4级,大宗研究表明这种划分较准确地反映了GIST的生物学特性及预后[10],本文显示,这4级的5年生存率依次为100.00%、86.96%、69.44%和56.25%,NIH恶性分级可以作为GIST预后判断的独立危险因素。
GIST对放、化疗不敏感,手术是目前最有效的根治手段。手术的基本要求有[11]:⑴完整切除肿瘤确保切缘阴性;⑵保证包膜的完整性;⑶遵循无瘤原则;⑷若术中发现淋巴结肿大或转移需行淋巴结清扫。一般而言,GIST外都存在假包膜,内部血管丰富,结构密度不均,同周围组织界限不清,如若不能完整切除,则有可能造成瘤内出血或肿瘤破裂。在2008年的NIH风险评估中,肿瘤破裂被认为是高危的复发因素,对预后具有重要影响。参照本研究的结果,完整切除者、切缘阴性者、肿瘤未破裂者及术中未见淋巴结转移者均较其对应患者有较高的5年生存率,同时Logistic回归分析显示其均可作为影响预后的独立危险因素,与手术的基本要求相符合。
临床数据发现[12],即便完整切除GIST,仍有40~70%的患者在术后2年内发生复发与转移。2013年的中国胃肠间质瘤诊断治疗共识建议,中危者术后给予1年的靶向药物辅助治疗,高危者需给予3年,肿瘤破裂者时间更长。国外研究显示[13],高危患者术后口服3年甲磺酸伊马替尼后,其总生存期(overall survival,OS)与无复发生存期(recurrence-free survival,RFS)明显高于口服1年的患者。国内的一项前瞻性研究也显示[14],中、高危患者术后服药3年伊马替尼,其OS与RFS较单纯手术者均有显著改善。由此可见,术后服药伊马替尼对于改善患者预后具有重要意义。本研究显示,术后服用伊马替尼患者的5年生存率明显高于未服用者(P<0.05),Logistic回归分析显示其可以影响预后,与文献结果相符。
综上所述,Ki-67指数(5%)、核分裂数和NIH评估分级等有关GIST良恶性划分的指标可以判断预后,肿瘤完整切除与否、切缘情况、肿瘤是否破裂与是否转移等手术相关事项对于预后有很大影响,而术后服药伊马替尼的患者将受益更多,以上均为影响GIST患者预后的独立危险因素。
[1]沈琳. 中国胃肠间质瘤诊断治疗共识(2013年版)更新要点解读[J]. 中华胃肠外科杂志, 2014,17(4):305-308.
[2]杨扬, 董燕萍. 生存分析在临床随访研究中的正确应用[J]. 中国医药指南, 2012, 10(23):447-448.
[3]Joensuu H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor.[J]. Human Pathology, 2008, 39(10):1411-1419.
[4]Roggin KK, Posner MC. Modern treatment of gastric gastrointestinal stromal tumors[J]. World Journal of Gastroenterology, 2012, 18(46):6720-6728.
[5]Colombo C,Ronellenfitsch U,Yuxin Z,etal.Clinical, Pathological and Surgical Characteristics of Duodenal Gastrointestinal Stromal Tumor and Their Influence on Survival: A Multi-Center Study[J]. Annals of Surgical Oncology, 2012, 19(11):3361-3367.
[6]Lazar AJ, Foo WC, Liegl-Atzwanger B. Pathology of Gastrointestinal Stromal Tumors[J]. Clinical Medicine Insights: Pathology, 2012, 5(3):23-33.
[7]Demir L, Ekinci N, Erten C,etal. Does immunohistochemistry provide additional prognostic data in gastrointestinal stromal tumors?[J]. Asian Pacific Journal of Cancer Prevention,2013, 14(8):4751-4758.
[9] 艾力·赛丁, 克力木·阿不都热依木, 张成,等. CD117、CD34、SMA、S-100和Ki-67在胃间质瘤中的表达及意义[J]. 现代肿瘤医学, 2015, 23(14):2004-2008.
[10]陈卉娇, 张波, 张红英. 胃肠间质瘤危险度评估系统比较—从NIH共识标准到预后等高热线图[J]. 中国普外基础与临床杂志, 2017(2):163-168.
[11]梁寒. 胃肠间质瘤规范化手术原则及注意要点[J]. 中国实用外科杂志, 2015, 35(4):391-394.
[12]刘秀峰, 秦叔逵, 王琳,等. 甲磺酸伊马替尼一线治疗复发/转移胃肠间质瘤患者的临床分析[J]. 临床肿瘤学杂志, 2013, 18(1):45-49.
[13]Joensuu H, Eriksson M, Sundby HK,etal. One vs Three Years of Adjuvant Imatinib for Operable Gastrointestinal Stromal Tumor[J]. Jama, 2012, 307(12):1265-1272.
[14]Li J, Gong JF, Wu AW,etal. Post-operative imatinib in patients with intermediate or high risk gastrointestinal stromal tumor[J]. European Journal of Surgical Oncology the Journal of the European Society of Surgical Oncology & the British Association of Surgical Oncology, 2011, 37(4):319-324.
Ananalysisoftheclinicalandpathologicalfactorsinducinggastrointestinalstromaltumorsaswellasthefactorsaffectingprognosis
CHEN Gun1,ZHANG Shi-ling2
(1.DepartmentofPathology,YinzhouPeople'sHospitalofNingbo,Ningbo315040; 2.DepartmentofExperimentPathology,CenterforClinicalPathologyofNingbo,Ningbo315000,China)
ObjectiveTo analyze the clinical and pathological factors that induce gastrointestinal stromal tumors (GIST) and find out the independent risk factors that affect the prognosis.Methods86 patients diagnosed by pathology and immunohistochemistry after surgery as cases of GIST were firstly chosen as the subjects of study. the clinical data retrospectively analyzed. The clinical and pathological factors inducing GIST and 5-years survival rate were secondly analyzed by univariate analysis. Logistic regression analysis was then performed to identify the independent risk factors that affected the prognosis.FindingsUnivariate analysis showed that complete resection of the tumor, resection margin, rupture, metastasis, nucleus splitting count, Ki-67 index (5%), NIH evaluation grade, and in-take of Imatinib mesylate was closely correlated to 5-years survival (allP<0.05),which were statistically significant. Logistic regression analysis showed that complete resection of the tumor, margin of the situation, rupture, metastasis, Ki-67 index (5%), nuclear mitotic count, NIH assessment grade and in-take of Imatinib mesylate were independent risk factors for prognosis (allP<0.05).ConclusionWhether the complete resection of the tumor, the margin, rupture, metastasis, Ki-67 index (5%), nucleus splitting count, NIH assessment grade, and in-take of imatinib mesylate are independent risk factors for prognosis of patients.
gastrointestinal stromal tumor; clinical factors; pathological; prognosis
2017-03-20
陈鲧(1979 - ),男,浙江宁波人,本科,主治医师。
10.3969/j.issn.1674-6449.2017.06.016
R573
A
1674-6449(2017)06-0651-05
