环糊精包合物脂质体的制备及其在药剂学上的应用
2018-01-02张新忠沈奇英
张新忠,唐 婷,沈奇英
(1.杭州师范大学 医学院,浙江 杭州 310036;2. 昆明理工大学 生命科学与技术学院,云南 昆明 650540)
健康科学基础研究
环糊精包合物脂质体的制备及其在药剂学上的应用
张新忠1, 2,唐 婷1,沈奇英1
(1.杭州师范大学 医学院,浙江 杭州 310036;2. 昆明理工大学 生命科学与技术学院,云南 昆明 650540)
传统脂质体作为药物载体在药剂学上已显示出较好的发展前景,但在稳定性、载药量、生物利用度、药效等方面存在不足,环糊精包合物脂质体改善了上述不足,现已引起一定的关注。本文就环糊精包合物脂质体的制备及药剂学应用优势作简要概述,为其进一步的研究开发提供一定的理论基础。
环糊精包合物脂质体;研究概述;制备;应用
脂质体在肿瘤耐药性治疗、克服生物屏障、装载生物药物等领域显示出较好的发展前景,但传统脂质体作为药物载体也存在一些不足,如稳定性等。环糊精包合物脂质体是将环糊精包合物载入脂质体中形成的新型脂质体,改善了传统脂质体在稳定性、载药量、生物利用度、药效等方面的不足。本文就环糊精包合物脂质体的制备及其在药剂学上的应用作简要概述,为其进一步的研究开发提供一定的理论基础。
1 概述
脂质体是由一种排列有序的脂质双分子层组成的球形囊状物,具有类似生物膜的结构。脂质体具有良好的生物相容性和靶向性,使其在肿瘤耐药性治疗、克服生物屏障、装载生物药物等领域显示出较好的发展前景。但是,传统脂质体作为药物载体也存在一些不足,如脂溶性药物被包封于脂质双分子层中,而脂质双分子层同时受到药物分子的干扰,影响了脂质体的稳定性和药脂比,从而影响其应用[1-2]。
1994年,McCormack和Gregoriadis 发现可以将环糊精包合物载入脂质体中,形成新型的脂质体即环糊精包合物脂质体。脂溶性药物通过环糊精包合后,再将其载入脂质体的内水相,从而避免磷脂双分子层对药物的影响[2]。此外,环糊精包合物脂质体在提高药物生物利用度、改善脂质体的载药量、延长药物的作用时间等方面表现出环糊精包合物和脂质体的协同优势[2-4]。环糊精包合物脂质体的制备目前主要分为两步法和一步法两种,不同的制备方法可能导致制备的环糊精包合物脂质体的某些性质如粒径、稳定性等不一样[5]。传统脂质体和环糊精包合物脂质体的示意图如图1所示。
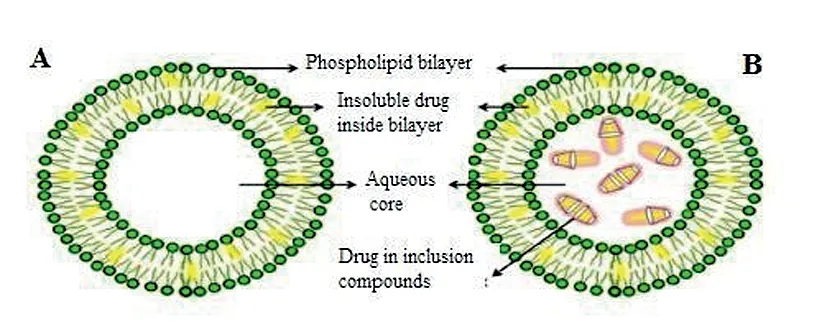
图1 传统脂质体(A)和环糊精包合物脂质体(B)的示意图
2 环糊精包合物脂质体的制备方法
2.1 两步法
2.1.1 薄膜水化法 先将药物溶解于具有环糊精的溶液中,按照一定比例的磷脂和胆固醇溶解于有机溶剂(无水乙醇,氯仿等),旋转蒸发去除有机溶剂,加入药物-环糊精包合物溶液进行水化,可放于适当温度下一段时间充分包封,用超声波细胞粉碎机调整环糊精包合物脂质体粒径,过膜后得到脂质体。
2.1.2 主动载药法 对于一些弱碱和弱酸性药物用pH梯度法进行主动载药具有良好的效果。pH梯度法原理是由于脂质双分子层对离子型药物和分子型药物的透过性不同。脂质体的内水相与外水相的pH不同,药物在外水相中以分子的形式存在,在透过脂质双分子层进入内水相后,由于pH的不同在内水相中主要是以离子形式存在,而离子形式不易透过脂质双分子层,从而达到了主动载药的效果,极大的提高了药物的包封率。但由于某些药物的水溶性特别低,导致在外水相中的溶度特别低,无法达到主动载药的效果。可以添加环糊精,使药物制成环糊精包合物后进行主动载药,可极大提高包封率。
2.1.3 逆向蒸发法 将环糊精包合物作为水相,大豆磷脂和胆固醇溶解在氯仿中作为油相,在超声探头下超声成乳状,在减压蒸发除去氯仿形成凝胶,加葡萄糖水溶液,得到环糊精包合物脂质体。实验结果表明这种方法制备的环糊精包合物的载药量和包封率最高[6]。
2.2 一步法
2.2.1 喷雾干燥法 主要用于制备悬浮的环糊精脂质体。将药物溶液,环糊精溶液,磷脂制备的喷雾干燥的溶液混合超声,进行喷雾干燥,得到的溶液与PBS溶液进行混合得到环糊精包合物脂质体。
2.2.2 乙醇注入法 此法对于油类药物较适用,将一定比例大豆磷脂和胆固醇溶解于无水乙醇中,用注射器缓慢的注射到含有环糊精包合物的溶液中,去除残留的乙醇,得到环糊精包合物脂质体。用这种方法能显著地提高精油类药物的载药量。在保存过程中,环糊精包合物脂质体能够减少药物的释放,延长药物的有效期[6]。本法较为简单快捷。
3 环糊精包合物脂质体的药剂学应用优势
3.1 提高脂质体的载药量 某些药物本身能很稳定地存在于脂质体中,并且稳定性也很好。但在脂质体中的溶解度较低,不能达到有效的载药量。Jun Chen等[7]用环糊精包裹一部分的利培酮并将这部分包裹于脂质体的内水相中,作为稳定的后续释放的药物,另将一部分利培酮包裹于脂质双分子层中,这样就可以充分利用脂质体的亲水内水相和亲脂双分子层,达到有效的载药量,从而解决传统利培酮脂质体载药量不理想的问题。
3.2 改善脂质体的稳定性 研究表明[3],将不同方法制备环糊精包合物脂质体和传统脂质体在4 ℃下,检测16天内包封率的情况。可以看出环糊精包合物脂质体的包封率保持在一定的水平,而传统脂质体显示出了明显的包封率的下降。
某些脂溶性药物包封于脂质体的脂质双分子层中,会干扰脂质体自身的稳定性,使包封的药物释放出来,不能有效地承载药物[8]。而环糊精包合物脂质体能避免这样的问题,将药物包封于环糊精中,并将环糊精包裹在脂质体的内水层,不会干扰脂质体自身的稳定性,对于不能直接应用脂质体作为载体的药物,可以用环糊精包合物脂质体进行载药,提高药物的稳定性。
3.3 提高脂质体的体内生物利用度 Lina Zhang等[9]以氟比洛芬为模型药物,Wistar大鼠药动学研究结果表明,氟比洛芬环糊精包合物脂质体相比于氟比洛芬溶液、氟比洛芬环糊精包合物、传统氟比洛芬脂质体在最大血药浓度、达峰时间等差异不大,但相对生物利用度是其他三种制剂的2~4倍,分别是420%, 201% 和 402%,可见环糊精包合物脂质体提高生物利用度的优势。
3.4 增强脂质体的透皮吸收 2008年,Jain等[10]第一次使用美洛昔康环糊精包合物脂质体制剂透皮给药,结果表明具有增强皮肤渗透性。皮肤的渗透和沉积的研究结果显示,异维甲酸环糊精包合物脂质体不但能显著增加皮肤弹性脂质沉积,而且还能增加体外的透皮吸收。但就增强药物的透皮吸收而言,某一些药物的环糊精包合物脂质体并不适用。
3.5 提高脂质体的稳定性和药效 据文献报道,由于药物包埋于脂质双分子层,它的释药速度较恒定且迅速,不能起到缓释的效果。而环糊精包合物脂质体需要将环糊精包合物从内层水相运输到脂质双分子层,在从脂质双分子层中释放出来,这需要一定的时间,环糊精包合物释放到介质中时还无法发挥药效,药物还要从环糊精中释放出来,才能发挥作用。相比于传统脂质体,环糊精包合物脂质体释药有很多中间环节可以用于制备长效缓释脂质体,甚至是长效靶向缓释制剂。因此环糊精包合物脂质体具有良好的制备长效制剂的前景。
4 结论
自环糊精和脂质体发现以来,人们运用环糊精和脂质体解决了一些药物本身疗效很好,却由于其自身的溶解度、易氧化或副作用较大等问题的药物,但仍然存在一些无法单独使用环糊精和脂质体就能解决的问题。目前,利用环糊精包合物脂质体的特殊性,改善了传统脂质体在包封率、稳定性、生物利用度、透皮吸收等方面的不足,还调节了药物的释放。可见,环糊精包合物脂质体在药剂学上有广阔的应用前景,值得进一步的深入研究。
[1]G'eraldine P, Marie P, Valery B,etal. Betamethasone-in-cyclodextrin-in-liposome: The effect of cyclodextrins on encapsulation efficiency and release kinetics[J].International Journal of Pharmaceutics,2006,312 :75-82.
[2]Wang WX,Feng SS,Zheng CH. A comparison between conventional liposome and drug-cyclodextrin complex in liposome system[J]. International Journal of Pharmaceutics,2016,513: 387-392.
[3]Chunying Z, Fanglin Y, Yang Y,etal. Preparation and Evaluation of Oxaliplatin Thermosensitive Liposomes with Rapid Release and High Stability[J]. PLOS ONE,11(7): e0158517.
[4]Riham G, Hélène G, Sophie F,etal. Liposomes incorporating cyclodextrin-drug inclusion complexes: Current state of knowledge[J]. Carbohydrate Polymers,2015, 129: 175-186.
[5]Riham G, Lizette A, Catherine C,etal. Drug-in-cyclodextrin-in-liposomes as a carrier system for volatile essential oil components: Application to anethole[J]. Food Chemistry,2017, 218:365-371.
[6]Carine S, Catherine C, Serge S,etal. Clove essential oil-in-cyclodextrin-in-liposomes in the aqueous and lyophilized states: From laboratory to large scale using a membrane contactor[J]. Carbohydrate Polymers,2016, 138: 75-85.
[7]Jun C, Wen-Li L, Wei G,etal. Drug-incyclodextrin- in-liposomes: a promising delivery system for hydrophobic drugs[J]. Expert Opinion on Drug Delivery,2014, 11 (4):565-577.
[8]Alomrani AH, Shazly GA, Amara AA,etal. Itraconazolehydroxypropyl-β-cyclodextrin loaded deformable liposomes: in vitro skin penetration studies and antifungal efficacy using Candida albicans as model[J]. Colloids and Surfaces B: Biointerfaces,2014, 121: 74-81.
[9]Lina Z, Qi Z, Xin W,etal. Drug-in-cyclodextrin-in-liposomes: A novel drug delivery system for flurbiprofen[J]. International Journal of Pharmaceutics,2015, 492: 40-45.
[10]Kaur N, Puri R, Jain SK. Drug-cyclodextrin-vesicles dual carrier approach for skin targeting of anti-acne agent[J]. AAPS Pharm Sci Tech, 2010, 11(2): 528-537.
Drug-in-cyclodextrin-in-liposomes:preparationandpharmaceuticaluse
ZHANG Xin-zhong1, 2, TANG Ting1, SHEN Qi-ying1
(1.HangzhouNormalUniversity,Hangzhou310036; 2.FacultyofLifeScienceandTechnology,KunmingUniversityofScienceandTechnology,Kunming650540,China)
While the traditional liposomes have been regarded as a desirable drug carrier in phar-maceutics, they are still problematic in stability, drug loading, bioavailability, efficacy and so on. Drug-in-cyclodextrin-in-liposomes (DCL), in contrast, can more effectively address the above problems, and has therefore caught more and more attention. This paper presents a review of the preparation and application of DCL with a view to informing further studies into DCL.
drug-in-cyclodextrin-in-liposomes;literature review;preparation;application
2017-03-10
张新忠(1993 - ),男,福建宁德人,硕士研究生。
沈奇英(1981 - ),女,浙江桐乡人,硕士,讲师。
10.3969/j.issn.1674-6449.2017.06.011
R94
A
1674-6449(2017)06-0635-03
