大豆黄素纳米乳球的制备及表征
2018-01-02夏秀华
夏秀华
无锡商业职业技术学院 (无锡 214153)
大豆黄素纳米乳球的制备及表征
夏秀华
无锡商业职业技术学院 (无锡 214153)
为了提高大豆黄素在机体的吸收和生物利用率,将大豆黄素制成大豆黄素纳米乳球。通过试验探索投料比、pH值、NaCl浓度、加热四因素对大豆蛋白-大豆多糖纳米乳球制备及稳定性的影响。结果表明:最佳的制备条件为:在投料比1∶5,8.5×107Pa均质3次,均质后80 ℃加热1 h,pH值3.25的条件下粒径变化最小,此时粒径为270 nm;盐浓度的增加会导致纳米乳球的粒径增大。根据此最佳条件制备大豆黄素纳米乳球,考察不同pH值的影响,并使用电镜进行表征,结果表明:大豆黄素纳米乳球在pH值3.25时粒径达到最小值,此时最稳定,通过电镜可以证实相互之间的结构为多糖的亲水链延伸出去,互相交联,形成稳定的网状结构。
大豆黄素;纳米乳球;投料比;PH值
大豆黄素是大豆异黄酮中的一种重要组成成分,具有广泛的应用前景。广泛存在于谷物、豆类、牧草、蔬果中,是一种异黄酮类化合物。分子式为C15H10O4,分子量为254.23。纯品为白色粉末状,分解点315 ℃~323 ℃。经药理研究证实,大豆黄素可以提高动物的生殖性能和繁殖能力,同时可以提高动物机体的免疫机能[1]。通过动物实验可以得知,大豆黄素可以明显提高下丘脑、垂体和乳腺等雌二醇受体的数目及亲和力,并影响乳腺的发育及泌乳能力[2-3]。但大豆黄素水溶性较差,极大地限制了其生物活性的发挥。研究发现,将此类水溶性较差或不溶于水的生物活性物质采用纳米技术制成纳米级分散体系,能有效提高该物质在机体内的吸收和生物利用率[4-5]。实验室先前研究了大豆黄素及大豆卵磷脂在不同溶剂中的溶解度,并根据溶解度制备了大豆黄素磷脂复合物[6-9]。在此基础上考虑使用大豆蛋白和大豆多糖通过因素实验制成稳定的纳米乳球,并使用该纳米乳球封装制得的大豆黄素磷脂复合物制备大豆黄素纳米乳球,并进行表征。
1 材料与方法
1.1 主要原料与试剂
大豆黄素(Daizein,上海纯优生物科技有限公司;大豆卵磷脂,国药集团化学试剂有限公司 ;脱脂豆粕,市售;大豆多糖,不二富吉(北京)科技有限公司;金龙鱼精炼一级大豆油,益海(泰州)粮油工业有限公司;大豆黄素磷脂复合物, 实验室制备;正己烷(分析纯),国药集团化学试剂有限公司;四氢呋喃(分析纯),国药集团化学试剂有限公司;三羟甲基氨基甲烷 (分析纯),国药集团化学试剂有限公司;醋酸钠(分析纯),国药集团化学试剂有限公司;叠氮化钠(分析纯),国药集团化学试剂有限公司。
1.2 主要仪器与设备
智能恒温磁力搅拌器,型号ZNCLS ,河南省巩义市英峪仪器厂;智能恒温水浴搅拌器 ,上海百申仪器设备有限公司;台式高速离心机,型号5804R 德国 Eppendorf公司;紫外分光光度计,型号UV18 北京莱贝赛威科技有限公司;傅立叶变换红外光谱仪,型号Nicolet iS10,美国赛默飞公司;高效液相色谱仪,型号waters1525,美国沃特世公司;高压均质机,型号APV 1000,APV 公司;高速剪切机 ,型号T18,IKA公司;纳米粒度及ZETA电位仪,型号Zetasizer nano ZS,英国马尔文公司。
1.3 实验方法
1.3.1大豆蛋白的提取方法[10]
50 g豆粕粉→搅拌溶解1.5 h (500 mL,0.1 mol/L Tris-HCl,20 ℃,pH值8.0) →1 000 r/min,10 ℃离心30 min→收集上清,2 mol/L HCL调pH值至4.8, 4 ℃静置2 h→1 000 r/min的转速在10 ℃下离心30 min取沉淀得大豆蛋白→pH值4.8的醋酸钠溶液充分洗涤→离心10 min两次(1 000 r/min,10 ℃)→收集沉淀→0.1 mol/L Tris-HCl(pH值8.0)溶液过夜搅拌溶解,调pH值至3.25(加0.02%的叠氮化钠)
1.3.2纳米乳球的预制备[11-13]
40 g大豆多糖粉末→用800 mL去离子水搅拌溶解,37 ℃磁力搅拌过夜→使用2 mol/L盐酸溶液调pH值至3.25→得表面浓度为50 mg/mL的大豆多糖溶液。
pH值3.25的去离子水稀释多糖溶液→搅拌30 min,加入适量蛋白溶液,使蛋白表面浓度为5 mg/mL → 搅拌3.5 h使其混合充分。
大豆蛋白/大豆多糖的投料比及用量如表1所示。

表1 大豆蛋白与大豆多糖投料比
加入大豆油至占混合溶液体积分数10%,磁力搅拌混合均匀,使用高剪切分散机以1 000 r/min的速度剪切混合溶液,每次剪切1 min,共剪切3次,以使溶液整体分布均匀。然后使用高压均质机以8.5×107Pa的压力均质3次。使大豆蛋白与大豆多糖充分结合,形成大豆蛋白-大豆多糖纳米乳球,将其在80 ℃下加热1 h或不做热处理,处理后4 ℃过夜,添加NaCl、pH值值等其他因素来考察不同条件对纳米乳球粒径的影响。
1.3.3大豆黄素纳米乳球的制备
将实验室制得的大豆黄素磷脂复合物置于大豆油中,搅拌,超声溶解,将溶解了磷脂复合物的大豆油加入大豆蛋白-大豆多糖混合溶液中至占总体积分数的10%,搅拌均匀后,使用高剪切分散机以13 500 r/min的转速剪切3次,每次1 min。使其整体分布均匀。然后使用高压均质机以8.5×107Pa的压力均质3次,使大豆蛋白与大豆多糖充分结合,同时包裹大豆黄素磷脂复合物,形成大豆黄素纳米乳球[14-15]。
1.3.4紫外可见分光光度法[16-17]
5 mg大豆黄素磷脂复合物 →溶于甲醇中,定容至50 mL→以1∶3的比例称取总质量为5 mg的大豆黄素及大豆卵磷脂→溶于甲醇中,定容至50 mL,作为大豆黄素磷脂物理混合物辅助检测。
使用紫外分光光度仪进行全波段扫描,观察吸收峰,以对产物定性。
1.3.5傅里叶红外光谱法
取4 mg样品与200~300 mg KBr晶体在玛瑙研钵中混匀,用不锈钢勺取70~90 mg粉末用压片机在25 kPa压力下压1 min制成约1 mm厚的透明薄片测定,空白样品则直接采用充分研细后的KBr粉末即可[8]。
所需样品:样品1,4 mg大豆黄素磷脂复合物;样品2,1 mg大豆黄素、3 mg大豆卵磷脂(物理混合);样品3,4 mg大豆黄素标准品;样品4,4 mg大豆卵磷脂;空白样,不加任何样品,用来扣除背景。
1.3.6可溶性蛋白浓度测定
使用改良型Bradford试剂盒制作蛋白标曲并通过标曲定量制得蛋白溶液中大豆蛋白浓度。制作蛋白浓度标曲:y=0.001 8x,R2=0.996 9
将制得的大豆蛋白溶液(1.3.1)用去离子水稀释300倍后测得吸光值为0.384,根据标准曲线求得蛋白溶液浓度为64.1 mg/mL。
1.3.7纳米颗粒的粒径及ζ电势测定
ζ电势及粒径测量是使用纳米粒度及ZETA电位仪,激光散射仪在在90°散射角,25 ℃下进行的,ζ电势通过系统提供的软件根据亨利公式:UE =(2εζ/3η)F(KA)测得,ε,η,和f(KA)分别是溶剂的介电常数,该溶液中蛋白质的黏度和亨利常数。样品在测定前需用去离子水稀释至20倍[18]。
1.3.8高效液相色谱法
使用GB/T 23788—2009《保健食品中大豆异黄酮的测定方法 高效液相色谱法》来测定大豆黄素的浓度。样品制备、提取及过滤后,经高效液相色谱仪分析(使用C18柱分离),根据保留时间定性,使用外标法定量[19]。
外标法需要制作大豆异黄酮混合标准使用溶液。准确称取大豆黄素(纯度为98%以上)4 mg,放置于10 mL容量瓶中,加入二甲基亚砜(色谱纯)至接近刻度,使用超声处理30 min后,添加二甲基亚砜至刻度。这样制得的标准储备液浓度即为400 mg/L。然后稀释配置8.0 mg/L标准溶液、16.0 mg/L标准溶液、24.0 mg/L标准溶液、40.0 mg/L标准溶液。
色谱条件:色谱柱,C18,粒度5 μm不锈钢色谱柱;流动相:流动相A,乙腈(色谱纯);流动相B,磷酸水溶液(pH值值3.0,0.45 μm滤膜过滤);流速1.0 mL/min;波长260 nm;进样量20 μL;柱温30 ℃。
将大豆黄素标准使用溶液在上述色谱条件下进行测定,色谱图见图1。

图1 大豆黄素标准溶液色谱图
由图1可定性得知大豆黄素保留时间为34 min,绘制以峰面积为横坐标、标准液浓度为纵坐标的标准曲线,如图2所示。
根据下式可以算得样品浓度:
X=ci×V/m×1 000/1 000
(1-1)
式中:X为样品中大豆黄素的含量,mg/kg或mg/L;ci为根据标准曲线得出的大豆黄素的浓度, mg/L;V为样品稀释液总体积的数值,g;m为固体半固体样品质量的数值,g。
1.3.9透射电镜
将制得的大豆黄素纳米乳球用去离子水稀释100倍,混合均匀。取20 μL滴加在铜网上,等到溶液稍干再滴加20 μL样品溶液,重复4~5次,保证铜网上残留有足够的样品,常温下放置至干燥彻底,即为待测样品[12]。
将透射电镜加压至120 kV,将待测样品装入样品杆,插入试样台进行预抽真空。等待绿灯亮后10 min,完全插入试样台,过2 min后加灯丝电流。
准备工作结束后,对待测样品进行观察分析,并聚焦拍照供分析使用。
观察完毕后,将放大倍数设定在40 K,束流聚焦在观察屏中心,关掉灯丝电源,样品杆复位,随后取出样品杆。实验完毕后,高压降至20 kV,接着关掉高压。置ACD模式,加热去除冷阱中剩余的液氮。完成后检查空调和除湿机的情况,离开。
2 结果与讨论
2.1 纳米乳球的研究
2.1.1投料比及温度对纳米乳球粒径及ζ电势的影响
制备投料比分别为2∶1、1∶1、1∶2、1∶3、1∶4、1∶5、1∶7及纯蛋白(SPI)、纯多糖(SPSS)的纳米乳球,均质完成后各取100 mL至80 ℃水浴中加热1小时及直接常温放置1 min。4 ℃下储存过夜。取出后放置至室温,将纳米乳球用蒸馏水稀释20倍后使用纳米粒度及ZETA电位仪测量不同条件下的纳米乳球粒径及ζ电势。测得结果如图3,表2所示(H为均质后加热组,U为均质后不加热组)。

图3 不同投料比下纳米乳球的粒径分布

投料比电势(H)电势(U)2∶111.9512.71∶13.52.421∶2-23.4-12.41∶3-8.07-8.91∶4-8.185-7.621∶5-17.1-17.851∶7-6.44-7.85SPI 19.45 19.9SPSS-15.3-13.05
由图3中的粒径分布可知,在投料比为1∶3、1∶5及SPI时,纳米乳球的颗粒粒径较小,可以初步判断为这三者为较合适的投料比,同时可以看出SPSS的粒径过大。从表2分析可以发现,当多糖与蛋白的投料比大于1∶1时,制得的纳米乳球的ζ电势与多糖接近,初步证明纳米凝胶具有多糖表面。从粒径及ζ电势分布看,加热与不加热的影响不明显,不能直接判断出哪种条件对纳米乳球粒径的影响更大。
2.1.2pH值值对纳米乳球粒径的影响
选择投料比为1∶3、1∶5及纯SPI,均质完成后取100 mL至80 ℃水浴中加热1 h及直接常温放置1 h。4 ℃下储存过夜后放置至室温,调节pH值值为2.0、3.0、3.25、4.0、5.0、6.0、7.0、8.0、9.0,4 ℃下储存24 h,将纳米乳球用蒸馏水稀释20倍后使用纳米粒度及ZETA电位仪测量不同条件下的纳米乳球粒径。测定结果如表3,图4~图7所示(H为均质后加热组,U为均质后不加热组)。
由表3可看出,纯SPI制备纳米乳球时,从粒径分布上看,加热时整体粒径较小,当pH值在2.0至3.25时,粒径分布较小,但显著大于投料比1∶3和1∶5时测得的粒径,pH值大于3.25时(pH值4.0以上),粒径出现飞跃,达到了微米级,初步分析可能是由于该体系中没有大豆多糖来形成稳定联结,均质后不能形成纳米乳球,仅仅是大豆蛋白分散于溶液中。当pH值小于3.25时,大豆蛋白带正电荷,分子静电排斥,测得的样品的粒径较小。pH值从3.25到5,处于SPI等电点附近,大豆蛋白聚集,产生絮凝,颗粒粒径增大,证明纯大豆蛋白不适合用于制备纳米乳球。
由于大豆蛋白与大豆多糖在均质前的pH值为3.25,在该pH值值下,大豆蛋白和大豆多糖携带相反的电荷,并且蛋白质加热前是分散的,有利于大豆蛋白/大豆多糖纳米乳球的形成。由此可见,后续pH值的调整影响的是制备得到的纳米乳球在不同pH值条件下的粒径变化。由图4中的粒径分布可知,投料比为1∶3的情况下,pH值在2.0至4.0时,粒径小幅变化,在这个pH值范围内,大豆蛋白与大豆多糖纳米乳球处在一个较稳定的状态。同时,在pH值为6.0时,纳米乳球的粒径与相邻的pH值比较粒径增大较明显,因为多糖链在较高的pH值下携带更多的负电荷,这使得凝胶表面的多糖链更加扩展。当整体环境pH值呈碱性时,大豆蛋白和大豆多糖均携带负电荷,凝胶化后的蛋白质和多糖之间存在的静电斥力使纳米乳球不分离,使纳米乳球具有稳定的结构,从粒径整体分布上看,加热后的纳米乳球变化要稍小于未加热的纳米乳球。

表3 不同pH值下纳米乳球的粒径分布(纯SPI体系)(Dh/nm)
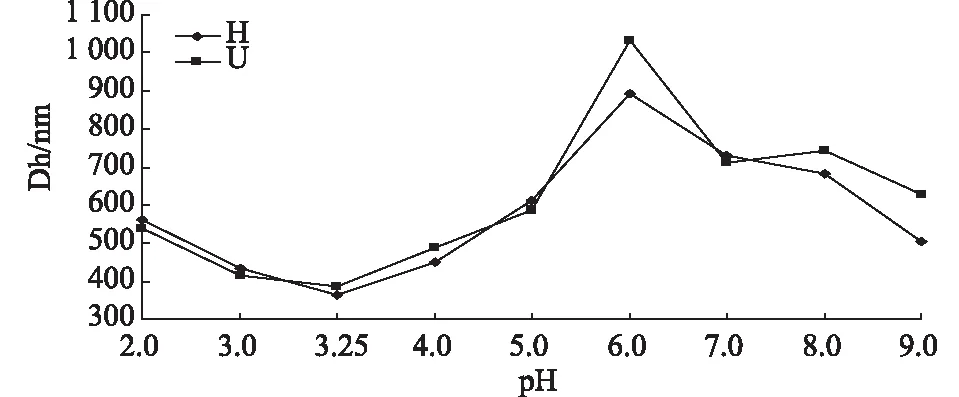
图4 不同pH值下纳米乳球的粒径分布(投料比1∶3)

图5 不同pH值下纳米乳球的粒径分布(投料比1∶5)
由图5中的粒径分布可知,投料比为1∶5的情况下,当纳米乳球pH值小于5.0时,粒径大小明显要小于pH值大于5.0时的纳米乳球,证明pH值2.0至4.0为较合适的pH值范围,同时与1∶3的情况相似,当pH值为6.0时,未加热的粒径增大明显。从粒径整体分布上看,加热后的纳米乳球稳定性要明显优于未加热的纳米乳球。8.5*107Pa下均质3分钟也许不能使大豆蛋白与大豆多糖产生足够的联结,较高的加热温度和加热时间会诱导蛋白质变性及强凝胶化,从而增加纳米乳球的稳定性。
图4,图5数据比较,从粒径整体分布看,1∶3H的稳定性不如1∶5H,证明1∶5为最好的投料比,从1∶5H的整体粒径分布上可以看出,pH值为3.25时,粒径最小,证明在该pH值下,纳米乳球最稳定。
2.1.3NaCl浓度对纳米乳球粒径和电势的影响
选择投料比为1∶3、1∶5及纯SPI,均质完成后分别取100 mL至80 ℃水浴中加热1 h及直接常温放置1 h。4 ℃下储存过夜后放置至室温,分别添加NaCl至浓度为0.05、0.10、0.20 mol/L,混匀至溶解后将纳米乳球用蒸馏水稀释20倍后使用纳米粒度及ZETA电位仪测量不同条件下的纳米乳球粒径及ζ电势。20 d后复测考察其稳定性。设置该因素主要是为了模拟纳米乳球在人体内的释放与吸收,故选择pH值值5.0与6.0,同时考虑生理盐水的浓度为0.9%,即0.153 8 mol/L,设置3个盐浓度梯度观察,为了提供对比性,故投料比选择1∶3及1∶5两组。

表4 不同pH值值下纳米乳球粒径随NaCl浓度的变化情况(Dh/nm)

表5 不同pH值值下纳米乳球电势随NaCl浓度的变化情况(Dh/nm)
由表4中不同pH值的粒径分布可以看出,pH值5.0的粒径要小于pH值6.0,这也与上步得出的结论相符。pH值6.0时纳米乳球粒径增大明显。从加热与不加热的粒径对比情况看,加热组要优于不加热组。综上,可以看出最合适的条件为pH值5.0,均质后加热。同时,随着NaCl浓度的增高,纳米乳球的粒径增大明显,到0.2 mol/L时即使是粒径最小的pH值5.0加热粒径也超过了600 nm,未加热的则达到了微米级。由投料比为1∶3的粒径的整体分布与投料1∶5的粒径的整体对比可知,投料比为1∶3时的纳米乳球粒径大于1∶5。
为了考察其存储稳定性,在4 ℃下储存20 d后,用肉眼观察发现投料比为1∶3H及1∶3U的纳米乳球均已出现絮凝、分层现象,证实其结构已被破坏,不再对其粒径及电势复测;投料比为1∶5的纳米乳球依旧均一,对其进行复测,从表5可以看出,ζ电势的变化不明显,同时发现投料比为1∶5H时,NaCl浓度为0.05 mol/L时,乳球粒径减小,浓度为0.10 mol/L时,乳球粒径基本不变,NaCl浓度为0.2 mol/L时,乳球粒径增大。证明NaCl浓度为0.2 mol/L时不利于其的储存。
2.1.4pH值对大豆黄素纳米乳球粒径的影响
为了试验大豆黄素纳米乳球在不同pH值下的稳定性,调节pH值值为2.0、3.25、5.0、7.0、9.0。4 ℃下储存24 h,将纳米乳球用蒸馏水稀释20倍后使用纳米粒度及ZETA电位仪测量不同条件下的纳米乳球粒径。测量结果如图6所示。

图6 不同pH值下大豆黄素纳米乳球的粒径分布
由上图的粒径分布可以看出,pH值3.25依旧是大豆黄素纳米乳球最稳定的pH值,并且在pH值趋于中性时粒径增大明显。证明大豆黄素纳米乳球的储存参考pH值应为pH值3.25左右。
2.1.5大豆黄素纳米乳球的透射电镜分析
将制得的大豆黄素纳米乳球稀释100倍后,用透射电镜在120 kv下观察颗粒结构,如图7所示。

图7 大豆黄素纳米乳球在透射电镜下的成像图
由图7可以看出,大豆黄素纳米乳球的结构为大豆蛋白被包裹在大豆多糖中,大豆多糖的亲水链延伸出去,互相联结形成网状结构,同时稀释100倍后结构也未被破坏,证明其能稳定的在水相中存在。透射电镜测得纳米乳球粒径大概在200 nm左右,与纳米粒度及ZETA电位仪上测定的粒径结果差异较大,原因为在纳米粒度及ZETA电位仪上测定时,多糖链之间的空间位组作用导致整体粒径变大,而电镜的图中深色部分只为大豆蛋白,因此两者结果有一定差异。
3 结论
3.1 大豆蛋白-大豆多糖纳米乳球
对制得的大豆蛋白-大豆多糖纳米乳球进行单因素实验后,可以得知:大豆蛋白-大豆多糖纳米乳球制备的最佳投料比为1∶5,剪切均质后80 ℃加热1 h可以有效减小粒径,增加纳米乳球的稳定性。pH值值对粒径的影响为:pH值3.25粒径最小,为最合适的环境pH值,pH值接近中性时,纳米乳球增大。由于其在酸性条件下较稳定,证明其能被应用于大部分食品及饮料中。
纳米乳球的稳定性随NaCl浓度的增加而降低,pH值5.0的乳液情况要优于pH值6.0的乳液,当NaCl浓度达到0.2 mol/L时,4 ℃下储存20 d乳液出现絮凝分层现象,从粒径可知,pH值5.0时粒径增大幅度较pH值6.0时小,证明pH值5.0时更稳定。证明NaCl对纳米乳球的稳定性影响较明显。
3.2 大豆黄素纳米乳球
大豆黄素纳米乳球的制备条件选择上步分析出的投料比1∶5,均质后加热。从不同pH值的粒径分布看,pH值3.25时的粒径最小,证明加入大豆黄素磷脂复合物后,pH值3.25依旧为纳米乳球储存过程中最合适的环境pH值[20]。与上步得出的结论一致。其他pH值时的粒径比未载药时的粒径略大,可能是由于纳米乳球对大豆黄素磷脂复合物的包裹造成的。
[1] 梁晓芳. 6种大豆异黄酮单体的分离、纯化及稳定性研究[D].北京:中国农业科学院,2014.
[2] 高荣海,张春红,赵秀红,等.大豆异黄酮研究进展[J].粮食与油脂,2009(5):1-4.
[3] 王 燕,王艳春,范红艳,等.大豆异黄酮药理作用的研究进展[J].吉林医药学院学报,2013,34(3):225-228.
[4] Yu Z L, Tang Y N, Hu D S, et al. Inhibitory effect of genistein on mouse colon cancer MC-26 cells involved TGF- b1/Smad pathway [J]. Biochem BiopHys Res Commun, 2005,333 (3): 827-832.
[5] Kaibori M, Yanagida H, Yokoigawa N, et al. Effect of Pirfenidone on Induction of Chemokines in Rat Hepatocytes [J]. Transplant Proc,2004, 36 (7): 1980-1984.
[6] 刘梦喜,符华林,费文波.氟苯尼考磷脂复合物的制备及表征[J].中国抗生素杂志,2015,40(2):103-107.
[7] 赵安权,王倩倩,李 佳,等.绿原酸磷脂复合物制备工艺的研究[J].华西药学杂志,2015,30(2):155-157.
[8] 罗娅君,张 琦,张新申,等.大豆黄素磷脂复合物的制备及光谱学分析[J].深圳大学学报:理工版,2010,27(2):224-229.
[9] J M Gutiérrez, González, A Maestro, et al. Nolla, Nano-emulsions: New applications and optimization of their preparation[J].Curr Opin Colloid Interface Sci, 2008 (13): 245.
[10] 杨叶波;蔡培培;何文森. 大豆蛋白质的提取技术的研究进展[J].广州化工,2015,43(9):26-27.
[11] Yin Baoru, Deng Wei, Xu Keke, et al. Stable nano-sized emulsions produced from soy protein and soy polysaccharide complexes [J]. Journal of Colloid and Interface Science, 2012,380:51-59.
[12] 杨 城,管 骁.水溶性大豆多糖理化及黏度性质研究[J].食品安全质量检测学报,2014(10):3331-3336.
[13] Ding Xuzhe, Yao Ping. Soy Protein/Soy polysaccharide complex nanogels: Folic acid loading, protection, and controlled delivery [J]. Transplant Proc,2004, 33 (9): 1916-1925.
[14] D Guzey, D J Mc Clements. Formation, stability and properties of multilayer emulsions for application in the food industry [J]. Adv Colloid Interface Sci, 2006,128: 227.
[15] 齐军茹,翁静宜,康燕辉,等.大豆酸溶蛋白/大豆多糖纳米乳液制备及表征[J].现代食品科技,2015,3(6):24-29.
[16] 冯 东,李雪梅,王丙莲.紫外-可见分光光度法在食品检测及食品安全分析中的应用[J].食品工业,2013(6):190-192.
[17] 王海军,宁新霞.紫外可见分光光度技术的应用进展[J]. 理化检验:化学分册,2012,48(6):740-745.
[18] 吴新民,范茂松,潘兮.纳米颗粒的粒径测定[J]. 电子测量与仪器学报,2004 (z1):69-77.
[19] 权 静,卢定强,张 筱,等.高效液相色谱法检测大豆粕大豆黄素及染料木素含量[J]. 粮食与油脂,2004(5):49-51.
[20] 史亚军,吴品江,许润春,等.黄芩苷磷脂复合物基本性质研究[J].中草药,2012,43(1):78-82.
Preparationandcharacterizationofdaidzeinnano-sizedemulsions
Xia Xiuhua
Wuxi Institute of Commerce (Wuxi 214122)
In order to improve the absorption and bioavailability of daidzein in body, daidzein was made into daidzin nano-sized emulsion. The effect of the feeding ratio, pH, NaCl concentration, heating conditions to the preparation and stablility of soybean protein-soybean polysaccharides nano-sized emulsions were reasearched. The results show the optimal preparation conditions are: feeding ratio of 1∶5, homogenized three times under 8.5×107Pa, then heated 1 h at 80 ℃, the minimum diameter at pH 3.25 is 270 nm, and nano-sized emulsion diameter increases with the change of concentration of NaCl. Then daidzein nano-sized emulsion was prepared according to the optimum condition, and the effect of different pH value was studied, and electron microscopy (sem) was used to characterize. The results show that: the particle size is minimum at pH 3.25 and the structure is stable. The stable network structure is polysaccharides extending hydro pH ilic structure out, cross-linked with each other is proved by electron microscopy.
daidzein; nano-sized emulsions;feeding ratio; pH
2017-10-20
夏秀华,女,1980年出生,研究方向为食品安全与保健食品。
TS210
A
1672-5026(2017)06-060-07
