门静脉及股静脉注射对导入基因在肝脏表达影响的比较
2018-01-02吴媛俞豪董凌月王欣李紫薇安威
吴媛,俞豪,董凌月,王欣,李紫薇,安威
(1首都医科大学基础医学院细胞生物学系, 2肝脏保护与再生调节北京市重点实验室,北京 100069)
门静脉及股静脉注射对导入基因在肝脏表达影响的比较
吴媛1,2,俞豪1,2,董凌月1,2,王欣1,2,李紫薇1,2,安威1,2*
(1首都医科大学基础医学院细胞生物学系,2肝脏保护与再生调节北京市重点实验室,北京 100069)
目的研究外源基因的门静脉途径和股静脉途径注射对导入基因在肝脏内表达和分布的影响。方法分别采用门静脉和股静脉的注射方法将包装好的连有目的基因的腺病毒载体导入小鼠体内。在注射后不同时间处死小鼠,分离肝脏,通过血清生化指标和HE 染色检测评价两种方法对肝脏的损伤,利用免疫组织化学、Real-time PCR 和Western blot 等方法测定目的基因和载体标签蛋白在肝脏内的表达及分布情况。结果注射3d 后,血清生化指标检测结果显示门静脉注射组丙氨酸转氨酶(alanine aminotransferase, ALT) 和天冬氨酸转氨酶(aspartate aminotransferase, AST)水平明显高于股静脉注射组;HE染色结果同样表明门静脉注射组肝组织内出现炎性细胞浸润,较股静脉注射组更明显;Real-time PCR、Western blot 及免疫组织化学检测均显示门静脉注射后,目的基因在肝脏内的表达明显早于股静脉注射组,但至注射后7d 时两组目的基因的表达水平已无明显差异。结论 与门静脉注射相比,股静脉注射外源基因对肝脏基本没有损伤,目的基因的表达虽然较晚,但也能达到门静脉注射水平。
基因治疗;门静脉注射;股静脉注射
基因治疗是将外源性遗传物质导入目的组织器官中发挥其生物学效应,从而达到治疗疾病的目的[1]。近年来,基因治疗的方法有了快速的发展和广泛的应用。病毒载体在目前的基因治疗中仍然是最有效的基因导入方法[2]。腺病毒是一种通过受体介导的内吞作用进入细胞内的双链无包膜DNA病毒,具有二十面体病毒壳体的形态特征。进入细胞后,腺病毒基因组转移至细胞核内,保持在染色体外,不整合进入宿主细胞基因组中,仅瞬间表达,安全性高。无论靶细胞是否为分裂细胞,腺病毒载体对于不同类型的人组织细胞都可进行感染,感染效率高,体外实验通常可达到接近100%的感染效率,同时其载体容量大、包装周期短、滴度高,因此腺病毒载体在基础科研和基因治疗临床试验方面有了越来越多的应用,是目前最具有发展前景和广泛应用的病毒载体。
肝脏作为人体最大的消化和代谢器官,可同时接受门静脉和肝动脉的双重血液供应,而且由于肝脏特殊的解剖学结构,使得小于100nm的物质可以从血管进入肝细胞,因此是基因治疗很好的靶器官。目前众多肝脏疾病发生的分子机制已经获知,基因治疗将成为这些疾病治疗的重要手段。安全地将带有治疗基因的载体导入肝细胞,并使其高效的表达是目前肝脏疾病基因治疗面临的重大问题。因此本研究探讨分别通过门静脉和股静脉注射的方法,将带有目的基因的腺病毒导入小鼠肝脏内,评价不同注射方式对目的基因在肝脏内分布及表达的影响,及对肝脏的损伤情况,以为后续基因治疗的研究奠定基础。
材料和方法
1 动物
C57BL/6J小鼠,鼠龄6-8w,SPF级,雄性,体重18~20g,购买于军事医学科学动物部。饲养条件为室温16~25℃,相对湿度50%~70%,分笼饲养,环境保持清洁安静。将小鼠随机分成4组,分别为门静脉注射对照载体组(Portal vein/Ad-Null)、门静脉注射目的基因组(Portal vein/Ad-HSS)、股静脉注射对照载体组(Femoral vein /Ad-Null)、股静脉注射目的基因组(Femoral vein /Ad-HSS),每组4只。
2 主要试剂
pAdxsi-Flag-hHSS腺病毒载体由北京诺赛生物技术公司合成;BCA蛋白定量检测试剂盒购于美国 Pierce公 司;ImProm-II™ Reverse Transcription System 购于美国Promega公司;Trizol(RNA抽提试剂)购于美国Invitrogen公司;SYBR Green PCR Master Mix购自德国QIAGEN公司;抗ALR多克隆抗体购于美国Proteintech公司(人肝刺激因子(hepatic stimulator substance, HSS)又名肝再生增强因子(augmenter of liver regeneration, ALR));抗Flag单克隆抗体购于美国Sigma公司;带有辣根过氧化物酶标记的羊抗兔抗体购于美国Proteintech公司(用于Western blot);带有辣根过氧化物酶的羊抗鼠抗体购于美国Proteintech公司;辣根过氧化物酶标记的抗GAPDH抗体购于上海康成生物工程有限公司;化学发光试剂盒购于美国Bio-Rad公司;苏木素伊红(HE)染色试剂盒购于碧云天生物技术有限公司;辣根过氧化物酶标记的羊抗兔抗体购于美国Abbkine公司(用于免疫组织化学);DAB显色液购于北京中杉金桥生物技术有限公司。
3 pAdxsi-Flag-hHSS腺病毒载体的构建
本实验选择人肝刺激因子(HSS)作为目的基因,pAdxsi-Flag-hHSS腺病毒载体由北京诺赛生物技术公司合成。通过载体构建、HEK293包装细胞扩增、滴度测定,最终获得滴度为2 × 1011pfu的hHSS重组腺病毒表达载体(pAdxsi-Flag-hHSS),简称Ad-HSS(图1)。

图1 pAdxsi-Flag-hHSS载体图谱Fig. 1 pAdxsi-Flag-hHSS vector map
4 小鼠门静脉注射
小鼠实验前饥饿6~8h后称重。4%水合氯醛溶液腹腔注射麻醉生效后,将小鼠腹面朝上、四肢固定于蜡盘上。用电动剃刀剪去腹部正中的毛发,并用碘伏对腹部进行大面积消毒,覆盖无菌纱布,暴露下腹部。在下腹部正中剪开皮肤约1.5cm,切口边缘局部钝性游离皮肤,剪开腹白线。切口两侧各缝合固定一根缝线,牵拉后充分暴露腹腔,轻柔拉出盲肠,置于生理盐水润湿的纱布上,展开肠系膜,使肠系膜静脉平行于小鼠长轴。用胰岛素注射器吸取1U的腺病毒(Ad-HSS或Ad-Null,109pfu),完全排空气泡后,小心刺入门静脉约0.5cm,避免抖动。缓慢注射完毕后暂不抽出,首先在静脉刺入口处放置少量的明胶海绵,大小以能在局部包裹住血管的量为宜,然后用血管夹在此处轻柔地夹住血管,内垫明胶海绵,一边抽出注射器一边使血管夹完全夹紧血管,使血管裂口完全闭合。确认无出血后,静置5min,期间静脉注射部位应保持干燥。缓慢松开血管夹,确认无出血后,将肠管小心缓慢地送入腹腔,此过程中注意勿使血管注射部位发生折叠,复位后腹腔内避免滴入液体。再次确认无出血后,逐层缝合腹膜、肌肉和皮肤。术后轻柔搬动小鼠,将其仰面放置待其自然苏醒。分别于注射后3d、5d和7d处死小鼠,并留取相应标本。
5 小鼠股静脉注射
小鼠实验前饥饿6~8h后称重。4%水合氯醛溶液腹腔注射麻醉生效后,将小鼠腹面朝上、四肢固定于蜡盘上。后肢大腿腹侧面用碘伏消毒,垂直于腹股沟在其正中部位剪开皮肤约1.5cm,切口边缘局部钝性游离皮肤,用两把眼科镊子钝性撕开皮下脂肪层,暴露股静脉,简单游离血管。用胰岛素注射器吸取1U的腺病毒(Ad-HSS或Ad-Null,109pfu),完全排空气泡后,小心刺入股静脉约0.5cm,缓慢注射完毕后暂不抽出,首先在静脉刺入处放置少量的明胶海绵,体积约黄豆粒大小,食指按压后抽出注射器。按压3min确认无出血后,缝合皮肤。术后轻柔搬动小鼠,将其仰面放置待其自然苏醒。注射后正常喂养3d、5d和7d处死小鼠,留取相应标本。
6 血清丙氨酸转氨酶和天冬氨酸转氨酶水平检测
本实验采取眼球取血的方法获得小鼠全血,该方法采集得到的血液为眶静脉和眶动脉的混合血。小鼠全血室温静置1 h 以上,4℃ ,6,000 g离心 30 min, 取上清,并置于-80℃保存。采用全自动生物化学分析仪检测血清丙氨酸转氨酶(alanine aminotransferase, ALT) 和天冬氨酸转氨酶(aspartate aminotransferase, AST)(血清样本均送至首都医科大学临床检验中心检测)。
7 HE染色
将取血后的小鼠处死,分离肝脏,取一小块肝组织浸入10%多聚甲醛4℃固定24h;取出组织块,自来水冲洗3次,每次10min;双蒸水再次冲洗组织3次,每次10min;之后将组织块置于50%乙醇浸泡3h,再放入70%乙醇浸泡过夜;取出后置于二甲苯中浸泡;组织块适当修剪后,放入自动浸蜡机浸蜡、包埋,取出后修块、切片、37℃烤箱烘干;石蜡切片脱蜡入水,双蒸水冲洗切片3次,每次5 min,苏木精染液中浸泡10min,冲洗,1%伊红染液中浸泡10min,冲洗,脱水,中性树胶封片,光学显微镜下观察拍照。
8 免疫组织化学
将石蜡包埋的肝组织进行5~7μm切片,60℃烤箱烤片1~2h,常规脱蜡入水;置于3%过氧化氢溶液室温避光30 min;蒸馏水冲洗3次,每次2 min;再将切片置于枸橼酸盐缓冲液中进行微波修复13 min(冷却与小火之间),室温冷却至常温,PBS洗3次,每次2min;TBST漂洗3次,每次5min;置于5% BSA-PBS中室温封闭30min;抗ALR第一抗体(1:200)4°C孵育过夜;PBS漂洗3次,每次5min;采用5% BSA的抗体稀释液稀释辣根过氧化物酶标记的第二抗体(1:200)室温孵育30 min;PBS漂洗3次,每次5min;DAB显色液中进行显示,自来水终止显色后,苏木素染色30s后脱水、透明、中性树胶封片,光学显微镜下观察拍照。
9 Real-time PCR
取50mg~100 mg肝组织块,置于1ml Trizol中,冰上迅速匀浆,静置5min。加入0.2ml氯仿/1ml Trizol,剧烈震荡15s,室温静置10min,4℃、10,000r/min离心15min;将上层水相移入新离心管中,加入0.5ml异丙醇/1ml Trizol,混匀,室温静置10min,4℃、10,000r/min离心10min,弃上清;加入1ml 75%乙醇/1ml Trizol,涡旋充分洗涤,室温静置3min,离心,充分弃上清,加入20ml DEPC水溶解,定量。
按照反转录试剂盒ImProm-II™ Reverse Transcription System说明书操作将提取到的组织RNA反转录为cDNA。根据相对应基因的cDNA序列,利用引物设计软件Primer Express(Applied Biosystems)分别设计上、下游引物,引物序列见表1。采用20ml反应体系,PCR反应扩增条件为50℃ 2min,95℃10min,然后95℃ 15sec,60℃ 1min,共40个循环。结果用β-actin进行校正。用DCt法计算相对基因表达,确定目的基因的相对浓度。

表1定量PCR引物序列Tab.1 Primer sequences used for Real-time PCR
10 Western blot
将肝组织用小容量的玻璃匀浆器匀浆裂解,采用BCA法进行组织蛋白定量,之后将提取的肝组织蛋白进行SDS-聚丙烯酰胺凝胶电泳、转印、杂交(抗ALR多克隆抗体浓度为1:1000用于检测HSS,抗Flag单克隆抗体浓度为1:1000),之后进行化学显色发光,用Image J凝胶成像系统计算单位光密度值和条带面积,将各实验组的总光密度值与内参照(GAPDH)比较,获得相对表达量。实验重复3次,最终结果以均值±标准差表示。
11 统计学处理
结 果
1 外源基因门静脉注射引起明显肝损伤
为了观察不同注射方法对小鼠肝功能的影响,我们首先分离门静脉和股静脉注射Ad-Null或Ad-HSS不同天数小鼠的血清,利用生化分析仪检测ALT、AST的变化。如图2A所示,门静脉注射Ad-Null或Ad-HSS3 d、5d和7d,血清中ALT含量均明显高于股静脉注射组;与上述结果类似,门静脉注射Ad-Null或Ad-HSS后血清中AST的水平也显著高于股静脉注射组(图2B)。
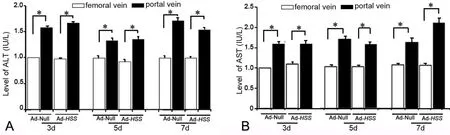
图2不同注射方法对各组小鼠血清中ALT(A)和AST(B)含量的影响。*,0.01<P<0.05 (n=4)Fig. 2 The effect of different gene delivery routes on serum ALT(A) and AST(B) levels. *, 0.01<P<0.05 (n=4)
为进一步验证血清的结果,分离门静脉和股静脉注射Ad-Null或Ad-HSS不同天数小鼠的肝组织,利用HE染色观察肝组织结构的变化。结果显示,股静脉注射Ad-Null或Ad-HSS后肝索排列整齐,肝窦清晰可见,肝小叶结构清晰,肝细胞大小均匀,仅有少量炎性细胞浸润,无变性坏死。而门静脉注射后,可见明显的炎性细胞浸润,说明门静脉注射方法使肝脏损伤更为明显(图3)。

图3 HE染色检测不同注射方法对小鼠肝脏组织结构的影响。比例尺,100μmFig. 3 HE staining was used to evaluate the effects of different gene delivery routes on liver histology. Scale bar, 100μm
2 门静脉和股静脉注射的外源基因在肝内表达无明显差异
为研究不同注射方法对外源基因在肝内表达的影响,首先利用免疫组织化学技术检测HSS在肝中的表达及定位。门静脉注射和股静脉注射Ad-HSS3d后肝组织均有HSS表达,而且表达多集中在血管周围;随着注射后天数的延长,HSS的表达愈加明显,在注射后7d表达最高,同时在远离血管的肝细胞内也有表达。但在门静脉注射后5d时,HSS在肝中的 表达均显著高于股静脉注射组(图4)。

图4 两种注射方法对小鼠肝脏中HSS免疫组织化学表达的影响。比例尺,100μmFig. 4 The time course of liver HSS expression determined by immunohistochemistry in different injection routes. Scale bar, 100μm
为进一步验证免疫组织化学结果,提取股静脉和门静脉注射Ad-HSS后肝内总mRNA,反转录为cDNA后,应用Real-time PCR检测HSSmRNA水平。结果显示,两种方法注射后HSS的表达均随着注射后天数的延长逐渐升高,门静脉注射组HSS的表达在注射后5d达到高峰,而股静脉注射组在7d达到高峰。在注射后3d和5d时,门静脉注射Ad-HSS后的肝组织内HSSmRNA的表达明显高于股静脉注射组(图5)。

图5 Real-time PCR检测两种注射方法对小鼠肝组织中HSS mRNA表达的影响。*,0.01<P<0.05 (n=4)Fig. 5 Real-time PCR analysis for effect of different gene delivery routes on liver HSS expression at mRNA level. *, 0.01<P<0.05 (n=4)
最后,我们提取股静脉和门静脉注射Ad-HSS后肝脏总蛋白,分别利用HSS抗体和载体标签蛋白Flag抗体,通过Western blot方法检测HSS的表达情况。两种方法注射后HSS的表达随着时间延长而增强,注射后5d时门静脉注射组HSS的表达显著高于股静脉组,但至注射后7d时两组HSS的表达接近,无显著差异(图6A)。由于我们选用的载体带有Flag标签蛋白,表达的外源基因均为HSS-Flag融合蛋白,所以利用Flag抗体也可以反应HSS在肝脏内的表达。与上述结果类似,不同方法注射后HSSFlag融合蛋白的表达均随时间增加而升高,注射后5d时门静脉注射组融合蛋白的表达明显高于股静脉组,7d时两组无明显差异(图6B)。

图6 两种注射方法对小鼠肝组织中HSS蛋白表达的影响。A,HSS蛋白的表达;B,Flag-HSS标签蛋白的表达;*,0.01<P<0.05(n=4)Fig. 6 Western blot analysis was used to evaluate the effect of different gene delivery routes on liver HSS expression at protein level. A, the expression level of HSS protein; B, the expression level of Flag -HSS fusion protein; *, 0.01<P<0.05 (n=4)
讨 论
在肝脏疾病的基因治疗中,常采用肝内注射、胆管内注射、静脉注射等方法导入目的基因,这些方法使得肝脏创伤大、危险性较高[3-5]。与上述方法相比,通过门静脉注射和股静脉注射导入外源基因对肝脏创伤小、危险性低,但这两种方法哪种更适于肝脏疾病的基因治疗,目前尚不清楚。因此本研究采用门静脉注射和股静脉注的方法将HSS重组腺病毒表达载体导入肝脏中使其表达,并比较两种方法对肝脏损伤及HSS表达和分布的影响。
门静脉注射是将小鼠开腹后寻找到肠系膜将目的基因经门静脉注射入体内。本研究发现通过门静脉注射和股静脉注射的方法将Ad-HSS导入肝脏中后,经HE染色显示门静脉注射目的基因后肝脏组织内有明显的炎细胞浸润,而且血清中ALT和AST水平明显升高。由于ALT与AST的分布主要位于在肝脏的肝细胞内,当肝细胞坏死时两者在血清中含量升高;细胞损伤越严重ALT和AST升高越明显,因此目前ALT和AST被认为是评价肝功能的指标。上述结果说明与股静脉组相比,门静脉注射对肝脏损伤更为严重。而且在实验操作中,我们发现门静脉注射操作复杂、手术时间长,动物易出血发生死亡,实验中死亡率接近1/3,因此对实验操作技术要求更高。与既往报道类似[7-8],我们同样发现股静脉注射方法更容易掌握、可重复率高,且动物不会受外科手术技巧和感染等因素影响,实验操作中基本没有死亡。
免疫组织化学结果显示两种方法注射后HSS的表达均有时间依赖性,但门静脉组表达更早,在第5 d达到高峰,股静脉组表达相对较晚,在第7 d达到高峰,上述结果与报道一致,门静脉注射使目的基因表达速度更快[6]。而后,我们应用实时荧光定量PCR技术(real-time PCR)和Western blot方法分别从转录和翻译两个不同水平检测肝脏组织中HSS的表达,结果显示外源注射的HSS在两组动物的肝脏中均可以被有效的转录和翻译,同样表达具有时间依赖性,门静脉组在注射Ad-HSS后5d达到高峰,而股静脉组高峰延迟到注射后7d。无论免疫组织化学,real-time PCR,还是Western blot结果均显示注射后5d时门静脉组HSS的表达均高于股静脉组,具有统计学差异,但是至注射后7d两组HSS的表达已无明显差异。由于我们利用的是含有Flag标签蛋白的真核表达载体,因此应用抗Flag标签的单克隆抗体可以检测组织中表达的HSS-Flag融合蛋白,结果类似,即注射Ad-HSS后7d门静脉组和股静脉组肝脏中融合蛋白的表达无明显差异。这些结果说明,虽然门静脉注射的方法使得目的基因表达更早,但随着时间的延长,股静脉注射也能使目的基因在肝脏内的表达达到门静脉注射的高水平。
综上所述,门静脉注射的方法使目的基因在肝脏中表达快速,但其注射过程复杂,对于手术技巧要求高,吗柠檬实验动物死亡率高;股静脉注射方法对于实验动物耐受性好、死亡率低,操作时间短且实用性强,虽然使目的基因在肝脏中的表达较晚,但仍能达到峰值,因此更适用于肝脏疾病的基因治疗。
[1] Anderson WF. Human gene therapy. Science, 1992,256(5058): 808-813.
[2] Castell JV, Hernandez D, Gomez-Foix AM, et al. Adenovirus-mediated gene transfer into human hepatocytes: analysis of the biochemical functionality of transduced cells. Gene Ther, 1997, 4(5): 455-464.
[3] Malone RW, Hickman MA, Lehmann-Bruinsma K, et al.Dexamethasone enhancement of gene expression after direct hepatic DNA injection. J Biol Chem, 1994, 269(47):29903-29907.
[4] Sullivan DE, Dash S, Du H, et.al. Liver-directed gene transfer in non-human primates. Hum Gene Ther, 1997, 8(10):1195-1206.
[5] Hara T, Aramaki Y, Takada S, et al. Receptor-mediated transfer of pSV2CAT DNA to mouse liver cells using asialofetuin-labeled liposomes. Gene Ther, 1995, 2(10): 784-788.
[6] Schiffer WK, Mirrione MM, Dewey SL. Optimizing experimental protocolsfor quantitative behavioral imaging with 18F-FDG in rodents. J Nucl Med, 2007, 48(2): 277-287.
[7] Liu F, Song Y, Liu D. Hydrodynamics-based transfection in animalsby systemic administration of plasmid DNA. Gene Ther, 1999, 6(7): 1258-1266.
[8] Zhang G, Budker V, Wolff JA.High levels of foreign gene expressionin hepatocytes after tail vein injections of naked plasmid DNA. Hum Gene Ther, 1999, 10(10) : 1735-1737.
A comparative study on the expression of hepatic stimulator substance in liver via different gene delivery routes
Wu Yuan1,2, Yu Hao1,2, Dong Lingyue1,2, Wang Xin1,2, Li Ziwei1,2, An Wei1,2*(1Department of Cell Biology, Capital Medical University, 2Municipal Laboratory for Liver Protection and Regulation of Regeneration,Beijing 100069, China)
ObjectiveTo evaluate the influences of different gene delivery routes on exogenous gene expression in liver.MethodsAdenoviral vectors carrying genes of hepatic stimulator substance (HSS)-Flag fusion protein were injected into mice through portal or femoral vein. The mice were sacrificed 3 to 7 days after injection and their livers were isolated. Liver injury was evaluated by HE staining as well as the serum levels of alanine aminotransferase (ALT) and aspartate aminotransferase (AST). The expression levels and patterns of HSS-Flag were determined by immunohistochemistry, real-time PCR and western blotting.ResultsThree days after viral vector injection, compared to femoral vein route, there were marked increases of serum ALT and AST activities in mice administered through portal vein. HE staining revealed mice in portal vein injection group had more inflammatory cell infiltration in liver tissues.Resultsfrom immunohistochemistry, real-time PCR and Western blotting indicated that the expression levels of HSS-Flag fusion protein were higher in mice injected through portal vein compared to those through femoral vein 3 and 5 days after injection.However, this difference diminished 7 days after injection.ConclusionCompared to portal vein route, viral vector injection through femoral vein caused less liver damage, slower but similar gene expression level at peak.
Gene therapy; portal vein injection; femoral vein injection
Q503
A
10.16705/ j. cnki. 1004-1850. 2017. 06. 006
2017-07-04
2017-11-17
国家自然科学基金资助项目(31371169),首都医科大学科研基金—校基金(技术类)(2016JS18)
吴媛,女(1980年),汉族,主管技师
*通讯作者(To whom correspondence should be addressed):anwei@ccmu.edu.cn
