USP10在弥漫大B细胞淋巴瘤中的表达及生物信息学分析
2018-01-02曾智任家材阎红琳黄亚冰叶柏新古丽娟袁静萍
曾智,任家材,阎红琳,黄亚冰,叶柏新,古丽娟,袁静萍*
(武汉大学人民医院1病理科,2血液科,3中心实验室,武汉 430060)
USP10在弥漫大B细胞淋巴瘤中的表达及生物信息学分析
曾智1,任家材1,阎红琳1,黄亚冰1,叶柏新2,古丽娟3,袁静萍1*
(武汉大学人民医院1病理科,2血液科,3中心实验室,武汉 430060)
目的探讨泛素特异性蛋白酶10(ubiquitin-specific protease 10, USP10)蛋白及其mRNA在人弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)与淋巴结反应性增生(reactive lymph node hyperplasia,RLH)中的表达及其临床意义。方法选取70例人DLBCL及70例RLH组织,采用组织芯片和免疫组织化学染色检测USP10的蛋白表达,分析其与DLBCL分子亚型及DLBCL预后相关分子之间的关系,并采用GEO数据库分析USP10 mRNA表达水平。结果USP10在DLBCL组织中的阳性表达率显著高于RLH组织的B淋巴细胞,在非生发中心亚型(non-germinal center B-cell-like type, non-GCB)DLBCL组织中的阳性表达率明显高于生发中心亚型(germinal center B-cell-like type, GCB)DLBCL组织;Spearman等级相关分析显示,USP10与DLBCL预后相关分子中的CD5、Bcl-2蛋白表达呈正相关,而与p53,c-Myc及Ki67蛋白表达无相关性;USP10 mRNA在DLBCL组织及RLH组织中的表达差异。结论USP10在DLBCL组织中的表达明显增加,尤其是在预后较差的non-GCB亚型或CD5阳性或无Bcl-2阳性的DLBCL中,表明该蛋白是DLBCL患者预后不良的分子标记物之一。
泛素特异性蛋白酶10;弥漫大B细胞淋巴瘤;淋巴结反应性增生;生发中心型;预后分子
泛素特异性蛋白酶10(ubiquitin-specific protease 10, USP10)是一种重要的去泛素化酶,其分子功能为半胱氨酸型内肽酶和泛素巯基酯酶,该酶主要参与泛素依赖的蛋白分解代谢、泛素周期等生命过程[1],并在多种肿瘤的发生、发展过程中起重要作用[2]。最近研究发现USP10通过去泛素化作用,稳定T-bet蛋白,进而参与Th1细胞的免疫应答过程[3]。此外还发现USP10全身敲除的小鼠,全血细胞减少,造血干细胞重建功能受到抑制,并最终因骨髓衰竭而死亡,表明USP10在造血干细胞的分化过程中也起着重要作用[4]。然而该蛋白在造血系统肿瘤中的研究目前罕见报道[5]。
弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)为弥漫性增生的大B细胞恶性肿瘤,是非霍奇金淋巴瘤(non-Hodgkin`s lymphoma,NHL)中最为常见的一类,约占NHL的30%~40%,是一组在临床表现、形态学、免疫表型及遗传学上都具有异质性的造血系统恶性肿瘤。近年来,随着泛素化与DLBCL之间的关系越来越明确,其反向调控过程(去泛素化)逐渐成为新的研究热点[6],发现多种去泛素化酶在DLBCL中起重要作用[7]。本研究采用组织芯片结合免疫组织化学染色方法在DLBCL及淋巴结反应性增生(reactive lymph node hyperplasia,RLH)组织中检测USP10的表达情况,旨在通过对临床样本的检测,进一步阐明USP10在人DLBCL组织中的表达情况及其临床意义。此外,还通过基因芯片数据库分析结合生物信息学的方法,试图探讨该蛋白在DLBCL中表达失调的原因。
材料与方法
1 标本来源
人DLBCL组织芯片购自武汉爱威尔生物科技有限责任公司,组织芯片编号为IWLT-N-70C41,共包含35例人DLBCL及35例RLH组织样本,并附带相应的临床病理参数(性别、年龄、部位、Hans法分型)及免疫组织化学资料(CD5、Bcl-2、p53、Ki67、c-Myc、CD10、MUM1及Bcl-6蛋白表达情况)。另外,收集武汉大学人民医院2013年12月至2016年8月间的DLBCL及RLH组织样本各35例,并附带相应的临床病理参数和免疫组织化学资料。所有70例DLBCL样本均为原发,取材前未行放、化疗。
2 免疫组织化学染色
采用SP法进行免疫组织化学染色,即用型免疫组织化学Ultra Sensitive TM S-P超敏试剂盒(鼠/兔,KIT-9710)和DAB显色试剂盒均购自福州迈新生物技术开发有限公司,一抗为USP10兔抗人单克隆抗体(ab109219; Abcam, Cambridge, MA, USA),工作浓度为1:250。石蜡组织芯片常规脱蜡、水化,其余操作按试剂盒说明书进行,其中一抗为4℃孵育过夜,修复方式为微波抗原热修复。用人肾上腺组织作为内对照,其中肾上腺皮质成分为阳性对照,髓质成分为阴性对照[8]。
3 免疫组织化学染色结果判读
免疫组织化学染色结果由两位病理专家独立阅片,阅片前事先不知晓结果。识别组织芯片上每一芯点中的组织及每一例普通切片上的组织,意见分歧时协商以双方最后达成一致者为准。在本研究中,USP10表达结果采用阳性强度4分法,即着色强度呈浅黄色=1,黄色=2,黄褐色=3,未着色=0。在本研究中将阳性强度≤1分定义为USP10阴性组(USP10 negative),>1分定义为USP10阳性组(USP10 positive)。
4 基因芯片数据分析
从美国国立生物技术信息中心(NCBI)的肿瘤公共数据库GEO Datasets (https://www.ncbi.nlm.nih.gov/gds)中下载人DLBCL样本基因表达谱数据集(GSE56315、GSE64555、GSE66770)[9-11], 并 通过NCBI 自带的 GEO2R 分析软件进行数据分析。其中GSE56315包含33例RLH、44例生发中心B细胞(GCB)型DLBCL和40例非生发中心B细胞(non-GCB)型DLBCL,探针号为209137_s_at ;GSE64555包含20例GCB型DLBCL和20例non-GCB型DLBCL,探针号为209137_s_at;GSE66770包含33例CD5阳性DLBCL和57例CD5阴性DLBCL,探针号为14676。
5 统计学分析
采用SPSS15.0统计软件包(SPSS, Inc., Chicago,IL, USA)进行统计分析,对计数资料用率表示,采取卡方检验、Fisher’ s精确检验、Spearman等级相关分析;以单样本K-S检验方法验证基因表达谱数据是否符合正态分布,对符合正态分布的数据采用t检验,对不符合正态分布的行两独立样本非参数检验(Mann-Whitney Test)。P<0.05为差异具有统计学意义。
结 果
1 USP10在RLH组织中的表达
在RLH组织中, USP10表达于生发中心的巨噬细胞,而在生发中心的B细胞中偶见表达;在副皮质区及滤泡间区中,USP10表达于T淋巴细胞的胞质;在髓质区中,USP10仅表达于髓窦中巨噬细胞的胞质中,而在髓索中的淋巴细胞未见表达(图1)。对生发中心中的B细胞进行统计分析,发现在70例RLH组织中,USP10的阳性表达率仅为2.86%(2/70)。
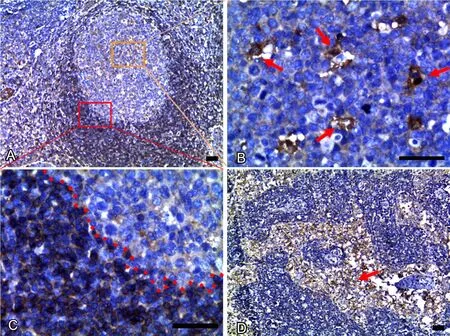
图1 USP10在RLH中的表达。A,淋巴结皮质及副皮质区;B,生发中心,箭头所指为巨噬细胞;C,副皮质区(右上方为生发中心中的B细胞区,左下方为副皮质中的T细胞区);D,髓质(箭头所指为髓窦中的巨噬细胞);比例尺,100μmFig. 1 The expression of USP10 in RLH. A, lymphatic cortex and paracortex; B, germinal center (yellow boxed area from A). Arrows point at macrophages; C, paracortex (red boxed area from A); the top right were B cells in germinal center and the lower left were T cells in paracortex; D, medulla;arrow points at sinus macrophages; scale bar, 100μm
2 USP10在DLBCL组织中的表达
在DLBCL组织中,USP10主要表达定位在瘤细胞的胞质中。70例DLBCL组织中USP10的阳性表达率为37.14%(26/70),明显高于RLH组织(B细胞)的2.86%(2/70)(图2,图3)。

图2 USP10在DLBCL中表达评分代表图。比例尺,50μmFig. 2 Representative images of USP10 expression in DLBCL with scores scaling from 0-3. Scale bar, 50μm

图3 USP10在DLBCL及RLH中的阳性表达率。*,P<0.001 (χ2=25.714)Fig. 3 The comparison of USP10 positive rate between DLBCL and RLH.*, P<0.001 (χ2=25.714)
3 USP10在生发中心亚型和非生发中心亚型DLBCL组织中的表达差异
在非生发中心亚型(non-germinal center B-celllike type,non-GCB)DLBCL组 织 中,USP10的阳性表达率为50.00%(24/48);在生发中心亚型(germinal center B-cell-like type,GCB)DLBCL组织中,USP10的阳性表达率为10.00%(2/20);卡方检验显示,USP10在两种亚型的DLBCL组织中的阳性表达率具有极显著性差异(图4)。

图4 USP10在non-GCB和GCB亚型DLBCL中的阳性表达率。*,0.01<P<0.05 (χ2=10.814)Fig. 4 The comparison of USP10 positive rate between non-GCB and GCB subtypes of DLBCL. *, 0.01<P<0.05( χ2=10.814)
4 USP10蛋白与DLBCL患者预后分子标记物之间的关系
Spearman等级相关分析显示,USP10蛋白的表达与CD5(r=2.587,P=0.012)及 Bcl-2(r=2.848,P=0.006)蛋白的表达呈正相关,而与p53、c-Myc及Ki67蛋白的表达无明显相关(表1)。
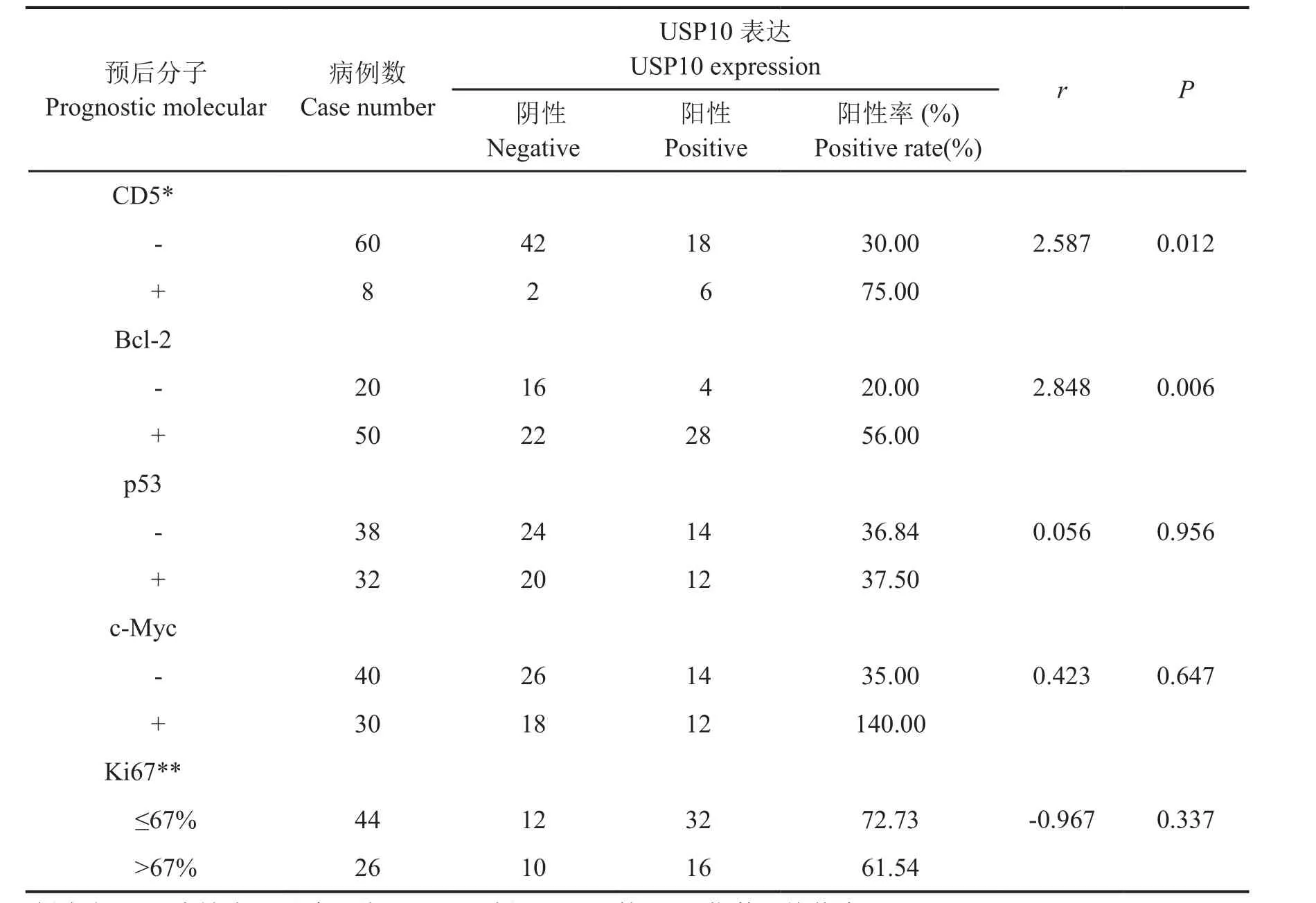
表1 USP10蛋白表达与DLBCL预后分子之间的相关性Tab.1 The correlation between USP10 expression and prognostic molecules of DLBCL
5 DLBCL及RLH组织中USP10 mRNA表达分析
GEO Datasets表达谱数据显示,USP10 mRNA在DLBCL及RLH组织中的表达差异无统计学意义(图5A);USP10 mRNA在non-GCB亚型及GCB亚型的DLBCL组织中的表达差异无统计学意义(图5B);此外,在CD5阳性及阴性的DLBCL组织中的表达差异也不具有统计学意义(图5C)。
讨 论
USP10,又名UBPO,位于16号染色体长臂24.1上,是泛素特异性蛋白酶家族中重要成员之一。该基因编码的蛋白由798个氨基酸构成,能特异性地将泛素分子从泛素结合的蛋白底物中切割出来[2]。目前研究表明USP10与p53、PCNA、MSH2、AMPK及EIF4G1等蛋白的去泛素化密切相关,进而参与到细胞增殖、分化等生物学过程中[3,12-15]。此外,还发现在不同类型的肿瘤中,USP10通过去泛素化不同的蛋白质底物,进而分别起到原癌基因和抑癌基因的作用。如Grunda JM等[16]报道USP10在胶质母细胞瘤中表达增加,并与胶质母细胞瘤患者预后呈正相关,从而发挥原癌基因作用。我们前期研究报道USP10作为一种抑癌基因,参与了胃癌的发生、发展过程,是胃癌患者预后的独立预测指标之一[2,17]。此外,还报道USP10蛋白可以作为一种分子标记物,在肾上腺皮质区及髓质区中存在全或无的表达模式,这一表达特点可以用作免疫组织化学染色中USP10蛋白表达的内对照[8]。
在本研究中,我们首先观察了USP10蛋白在RLH中的表达分布,发现该蛋白主要表达于淋巴结皮质区生发中心中的巨噬细胞、副皮质区及滤泡间区中的T淋巴细胞以及髓窦中的组织细胞,而在B淋巴细胞分布区偶见表达,表明USP10蛋白在RLH中虽有表达,但在正常的B淋巴细胞中表达率较低。目前认为DLBCL中的瘤细胞主要起源于生发中心细胞或生发中心后的B细胞,因此我们将RLH中的B细胞区作为DLBCL中瘤细胞的对照细胞。通过临床样本及统计学分析,发现USP10在DLBCL组织中的阳性表达率明显高于RLH组织中的B细胞,表明该蛋白在DLBCL发生过程中可能起着原癌基因的作用。
DLBCL免疫组织化学分型中应用最为广泛的是GCB型和non-GCB型,在临床上这种划分主要采用免疫组织化学染色的方法检测CD10、Bcl-6和MUM-1三种抗体,本研究中我们采用的是Hans法,即CD10+或CD10-/BCL-6+/MUM1-定义为GCB型,而其他任何组合划分为non-GCB型。目前多数学者认为GCB型DLBCL预后要明显好于non-GCB型,是一个独立的预后因素[18]。在本研究中,我们发现USP10蛋白表达率在non-GCB中要明显高于GCB型,表明USP10的过表达多出现于预后较差的non-GCB型患者中,即在DLBCL恶性进程中,USP10也发挥着重要作用。
CD5是一种相对分子质量为67kD的跨膜糖蛋白,最早被发现表达于恶性B细胞淋巴瘤白血病中,CD5阳性的B细胞在发育中出现较早,具有许多原始细胞的功能。研究显示,CD5阳性的DLBCL占所有DLBCL的5%~10%,多有结外受累,是DLBCL的不良预后因素之一[19]。Bcl-2基因位于18q21上,是一种抗凋亡基因,主要抑制线粒体的凋亡。在DLBCL中常常可见该基因的染色体易位,研究发现约70%的具有Bcl-2基因染色体易位的患者高表达Bcl-2,而Bcl-2阳性表达的患者,预后较差[20]。在本研究中,我们发现USP10分别与CD5或Bcl-2的表达水平呈正相关,提示USP10表达阳性的DLBCL患者,预后可能更差。
MYC基因位于8q24,是一种原癌基因,在多种肿瘤的转录、增殖、分化、凋亡等过程中发挥重要作用。在DLBCL中,约10%的患者有MYC基因易位, c-Myc蛋白的过表达被认为是DLBCL预后不良的因素之一[21]。Lin Z等通过细胞学实验发现USP10可以通过去泛素化作用,稳定SIRT6蛋白,从而拮抗c-Myc的转录激活,最终抑制结直肠癌的发生[22]。因此,在DLBCL中,USP10是否也能通过调控c-Myc蛋白发挥作用有待实验证明。 Mayo Clinic肿瘤研究分部的学者报道USP10能与p53结合,并通过去泛素化作用调节p53的稳定性,从而逆转泛素连接酶Mdm2诱导的p53转运和泛素化降解过程。进一步研究发现USP10不仅可以稳定野生型p53,而且还可以稳定突变型p53,从而在不同类型的肾癌中分别发挥原癌基因和抑癌基因的作用[1]。而在DLBCL中,p53的阳性表达被认为是预后不良的指标之一,那么,在DLBCL中USP10与p53表达之间是否也存在一定的相关性。此外,目前多数学者认为DLBCL中瘤细胞Ki67表达率越高,即肿瘤细胞增殖率越高,则患者预后越差。故我们进一步分析了USP10蛋白与c-Myc、p53及 Ki67表达之间的关系。遗憾的是,在DLBCL中USP10蛋白与上述三种蛋白表达之间并未检测出相关性,表明USP10作为一种去泛素化酶,可能并非通过调控上述三种蛋白的稳定性,参与到DLBCL的恶性进展过程中。
此外,我们还通过GEO Datasets分析了USP10 mRNA在三组样本中的表达差异,分别是:RLH组与DLBCL组,GCB亚型与non-GCB亚型的DLBCL组,CD5阳性与CD5阴性的DLBCL组;结果在这三组样本中均未观察到USP10 mRNA明显的表达差异,表明在DLBCL中,USP10的表达增加,并非由于USP10 mRNA表达变化所致,即该蛋白的表达增加并非发生在转录水平,而是发生在转录后的调控水平。
综上所述,USP10蛋白在RLH的B细胞区基本不表达,但在DLBCL组织中的表达明显增加,尤其是在预后较差的non-GCB亚型或CD5阳性或Bcl-2阳性的DLBCL中,表明该蛋白参与了DLBCL的发生过程,可能是DLBCL患者预后不良的分子标记物之一。此外,USP10在DLBCL组织中的表达增加并非发生在转录水平。
[1] Yuan J, Luo K, Zhang L, et al. USP10 regulates p53 localization and stability by deubiquitinating p53. Cell,2010, 140(3): 384-396.
[2] Zeng Z, Wu HX, Zhan N, et al. Prognostic significance of USP10 as a tumor-associated marker in gastric carcinoma.Tumour Biol, 2014, 35(4): 3845-3853.
[3] Pan L, Chen Z, Wang L, et al. Deubiquitination and stabilization of T-bet by USP10. Biochem Biophys Res Commun,2014, 449(3): 289-294.
[4] Higuchi M, Kawamura H, Matsuki H, et al. USP10 is an essential deubiquitinase for hematopoiesis and inhibits apoptosis of long-term hematopoietic stem cells. Stem Cell Reports, 2016, 7(6): 1116-1129.
[5] Takahashi M, Higuchi M, Makokha GN, et al. HTLV-1 Tax oncoprotein stimulates ROS production and apoptosis in T cells by interacting with USP10. Blood, 2013, 122(5): 715-725.
[6] Yang Y, Staudt LM. Protein ubiquitination in lymphoid malignancies. Immunol Rev, 2015, 263(1): 240-256.
[7] Kato M, Sanada M, Kato I, et al. Frequent inactivation of A20 in B-cell lymphomas. Nature, 2009, 459(7247): 712-716.
[8] Zeng Z, Zhou Z, Zhan N, et al. USP10 Expression in Normal Adrenal Gland and Various Adrenal Tumors. Endocr Pathol,2015, 26(4): 302-308.
[9] Sanz-Pamplona R, Berenguer A, Cordero D, et al. Aberrant gene expression in mucosa adjacent to tumor reveals a molecular crosstalk in colon cancer. Mol Cancer, 2014, 13: 46.
[10] Khamas A, Ishikawa T, Shimokawa K, et al. Screening for epigenetically masked genes in colorectal cancer Using 5-Aza-2’-deoxycytidine, microarray and gene expression pro file. Cancer Genom Proteom, 2012, 9(2): 67-75.
[11] Valcz G, Patai AV, Kalmar A, et al. Myofibroblast-derived SFRP1 as potential inhibitor of colorectal carcinoma field effect. PLoS One, 2014, 9(11): e106143.
[12] Yang Q, Ou C, Liu M, et al. NRAGE promotes cell proliferation by stabilizing PCNA in a ubiquitin-proteasome pathway in esophageal carcinomas. Carcinogenesis, 2014, 35(7):1643-1651.
[13] Deng M, Yang X, Qin B, et al. Deubiquitination and Activation of AMPK by USP10. Mol Cell, 2016, 61(4): 614-624.
[14] Zhang M, Hu C, Tong D, et al. Ubiquitin-specific peptidase 10 (USP10) deubiquitinates and stabilizes MutS Homolog 2 (MSH2) to regulate cellular sensitivity to DNA damage. J Biol Chem, 2016, 291(20): 10783-10791.
[15] Cao Y, Wei M, Li B, et al. Functional role of eukaryotic translation initiation factor 4 gamma 1 (EIF4G1) in NSCLC.Oncotarget, 2016, 7(17): 24242-24251.
[16] Grunda JM, Nabors LB, Palmer CA, et al. Increased expression of thymidylate synthetase (TS), ubiquitin specific protease 10 (USP10) and survivin is associated with poor survival in glioblastoma multiforme (GBM). J Neurooncol,2006, 80(3): 261-274.
[17] Li D, Zeng Z, Yu T, et al. Expression and clinical implication of S100A12 in gastric carcinoma. Tumour Biol, 2016, 37(5):6551-6559.
[18] Hans CP, Weisenburger DD, Greiner TC, et al. Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray.Blood, 2004, 103(1): 275-282.
[19] Yamaguchi M, Seto M, Okamoto M, et al. De novo CD5+diffuse large B-cell lymphoma: a clinicopathologic study of 109 patients. Blood, 2002, 99(3): 815-821.
[20] Johnson NA, Savage KJ, Ludkovski O, et al. Lymphomas with concurrent BCL2 and MYC translocations: the critical factors associated with survival. Blood, 2009, 114(11):2273-2279.
[21] Savage KJ, Johnson NA, Ben-Neriah S, et al. MYC gene rearrangements are associated with a poor prognosis in diffuse large B-cell lymphoma patients treated with R-CHOP chemotherapy. Blood, 2009, 114(17): 3533-3537.
[22] Lin Z, Yang H, Tan C, et al. USP10 antagonizes c-Myc transcriptional activation through SIRT6 stabilization to suppress tumor formation. Cell Rep, 2013, 5(6): 1639-1649.
USP10 expression in diffuse large B-cell lymphoma and its bioinformatics analysis
Zeng Zhi1, Ren Jiacai1, Yan Honglin1, Huang Yabing1, Ye Baixin2, Gu Lijuan3, Yuan Jingping1*
(1Department of Pathology, 2Department of hematology, 3Central Laboratory, Renmin Hospital of Wuhan University, Wuhan 430060,China)
ObjectiveTo investigate USP10 expression in diffuse large B-cell lymphoma (DLBCL) and reactive lymph node hyperplasia (RLH) as well as its clinical significance.MethodsThe tissue expression of USP10 was determined at protein level using tissue microarray and immunohistochemistry in 70 cases of DLBCL and RLH each. The mRNA was analyzed using GEO Datasets.The relationships between USP10 expression and DLBCL molecular subtypes as well as prognostic molecules were investigated.ResultsThe USP10 positive rate was significantly higher in DLBCL than in RLH tissues. It was also significantly higher in non-GCB(non-germinal center B-cell-like, non-GCB) than in GCB (germinal center B-cell-like, GCB) type of DLBCL. However, the difference between DLBCL and RLH was not statistically significant at mRNA level. There was a positive correlation between USP10 and prognostic molecules CD5 and Bcl-2, but not p53, c-Myc, and Ki67.ConclusionThe USP10 expression increased significantly in DLBCL tissues, especially in non-GCB subtype, CD5 and/or Bcl-2 positive tissues which often associate with poor prognosis. The results suggested that USP10 may be used as a predictor for the prognosis of DLBCL patients.
Ubiquitin-specific protease 10; diffuse large B-cell lymphoma; reactive lymph node hyperplasia; germinal center B-cell-like type; prognostic molecules
R733.4
A
10.16705/ j. cnki. 1004-1850. 2017. 06. 007
2017-05-02
2017-11-17
国家自然科学基金(81602535);湖北省自然科学基金面上项目(2016CFB249)
曾智,男(1982年),汉族,主治医师
*通讯作者(To whom correspondence should be addressed):yuanjingping2003@aliyun.com
