肝癌组织中HBV感染与甲基化转移酶表达的相关性研究*
2018-01-02张海涛赵晓飞孙力波
张海涛 赵晓飞 李 宁 孙力波
首都医科大学附属北京佑安医院肝胆外科暨肝移植中心 (北京, 100069)
肝癌组织中HBV感染与甲基化转移酶表达的相关性研究*
张海涛 赵晓飞 李 宁 孙力波△
首都医科大学附属北京佑安医院肝胆外科暨肝移植中心 (北京, 100069)
目的:探讨肝癌组织中乙型肝炎病毒感染与甲基化转移酶表达的相关性。方法以2012年1月到2017年2月在我院诊治的原发性肝癌患者178例作为研究对象,根据乙型肝炎病毒感染检出情况分为感染组78例与非感染组100例,两组患者都进行甲基化转移酶MGMT的活性检测与基因型分布PCR检测,同时进行临床资料的调查与相关性分析。结果感染组患者 MGMT活性为(3.45±1.46)U/ml,对照组患者为(5.14±1.89)U/ml,观察组明显低于对照组(t=8.341,P<0.05)。178例肝癌患者中MGMT(+)基因型65例,MGMT(-)基因型113例,两组患者MGMT型分布频率比较差异有统计学意义(χ2=4.985,P<0.05)。单因素分析显示肝癌患者合并乙型肝炎病毒感染主要与吸烟、MGMT活性、MGMT(+)基因型、糖尿病史等明显相关(P<0.05);多因素Logistic回归分析显示吸烟、MGMT活性、MGMT(+)基因型、糖尿病史为肝癌患者合并乙型肝炎病毒感染发生的独立危险因素(P<0.05)。结论肝癌组织中乙型肝炎病毒感染比较常见,多伴随有甲基化转移酶MGMT表达活性下降,MGMT(+)基因型减少,吸烟、MGMT活性、MGMT(+)基因型、糖尿病史为肝癌患者合并乙型肝炎病毒感染发生的独立危险因素。
肝癌;乙型肝炎病毒;甲基化转移酶;相关性
原发性肝癌(PHC)简称肝癌,是指原发于肝脏或肝内胆管系统的恶性肿瘤,也是当前我国比较常见的恶性肿瘤[1]。肝癌在临床上主要表现为发展迅速、起病隐匿,多数患者确诊时已属晚期,生存期短,预后很差[2,3]。手术切除是目前治疗肝癌的首选方法,但由于多发病灶、肿块过大等因素,使得术后复发率比较高,为此加强早期预防意义重大[4]。肝癌的发病因素比较多,其中乙型肝炎病毒(HBV)与丙型肝炎病毒(HCV)被认为是肝癌发生的重要危险因素,但是具体的机制还不太明确[5]。DNA修复酶-甲基鸟嘌呤DNA甲基转移酶(MGMT)是近些年来发现的比较确定的造成烷化剂类化疗药物失敏或失效的一种酶,能在肿瘤细胞中呈现高表达状况,在肝癌中也广泛表达,其可以造成肝癌组织与细胞对烷化剂类药的耐药,从而直接影响到治疗效果与预后状况[6,7]。分子遗传学研究显示,单核苷酸多态性(SNP)是较常见的一类遗传多态性指标,SNPs是基因序列中单个碱基变异引起编码氨基酸发生改变,从而影响基因表达蛋白质功能的改变,这些改变将导致个体间复杂疾病的易感性差异[8~10]。本研究旨在探讨肝癌组织中HBV感染与MGMT多态性的相关性,为肝癌组织中HBV感染提供科学依据,现报道如下。
1 资料与方法
1.1 一般资料 2012年1月到2017年2月选择在我院诊治的原发性肝癌患者178例作为研究对象,纳入标准:符合原发性肝癌的病理学诊断标准;临床与病理学资料完整;甲胎蛋白(AFP)>400μg/L;研究得到医院伦理委员会的批准。排除标准:临床与病理资料不完整者;严重心、肾功能不全患者,伴有出血性疾病、出血倾向者;妊娠与哺乳期患者;精神系统疾病或长期心理压力过大者。根据HBV感染检出情况分为感染组78例与非感染组100例,两组患者的性别、年龄、体重指数、肝功能分级、肿瘤直径、病理分级等比较差异无统计学意义(P>0.05)。见表1。
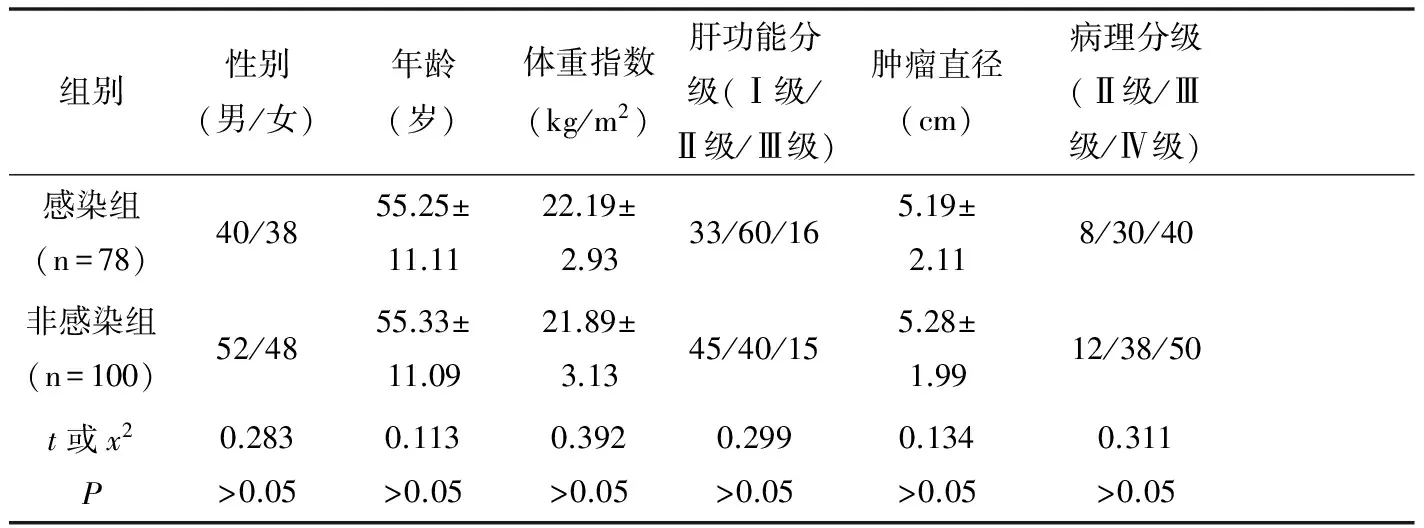
表1 两组患者一般资料比较
1.2 MGMT表达检测 采集两组患者的空腹外周静脉血3~5ml,3000r/min离心10min(离心半径为10cm),分离上层血清在-80℃冰箱保存。采用比色法测定血清 MGMT活性,严格按照试剂盒说明书进行操作。采用聚合酶链反应(PCR)法测定 MGMT表达情况,选择上海生工公司的血液基因组DNA提取试剂盒提取血液标本中的DNA,采用PCR扩增目的基因进行基因型分析,其中MGMT引物序列为:上游5’-CTGCCCTACTTATGGATGGG-3’,下游5’-CTGGATTGTAGCAGATCATGC-3’。将β-actin(519 bp)做内参证明PCR扩增有效,引物也由上海生工生物工程技术服务有限公司合成,MGMT扩增片段为271bp。
PCR扩增:94℃预变性5min,94℃变性1min,55℃退火25s,72℃延伸30s,循环40次,72℃延伸10min,4℃保存,将PCR扩增产物进行琼脂糖凝胶电泳分析。
1.3 临床资料调查 调查所有患者的临床与病理资料,包括年龄、性别、体重指数、乙型肝炎病毒感染、吸烟史、饮酒史、高血压病史、冠心病史、糖尿病史、高脂血症史,记录肿瘤直径、病理分级、肝功能分级、甲胎蛋白等指标。
2 结果
2.1 MGMT活性对比 感染组患者 MGMT活性为(3.45±1.46)U/ml,非感染组为(5.14±1.89)U/ml,感染组明显低于非感染组(t=8.341,P<0.05)。
2.2 MGMT多态性分析 在178例患者中,琼脂糖凝胶电泳显示 MGMT(+)基因型均得到一条与预期目的片段大小一致的271bp特异带,MGMT(-)基因型无特异性条带出现,见图1。
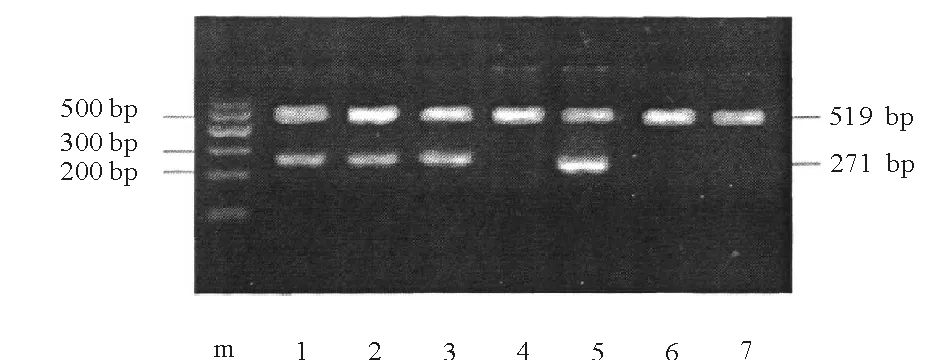
注:M为maker,1、2、3、5为MGMT(+),4、6、7为MGMT(-)
图1 MGMT多态位点电泳图
2.3 两组患者MGMT型分布频率 见表2。

表2 两组患者MGMT型分布频率比较 [n(%)]
2.4 相关性分析 单因素分析显示,肝癌患者合并HBV感染主要与吸烟、MGMT活性、MGMT(+)基因型、糖尿病史等明显相关(P<0.05),见表3。
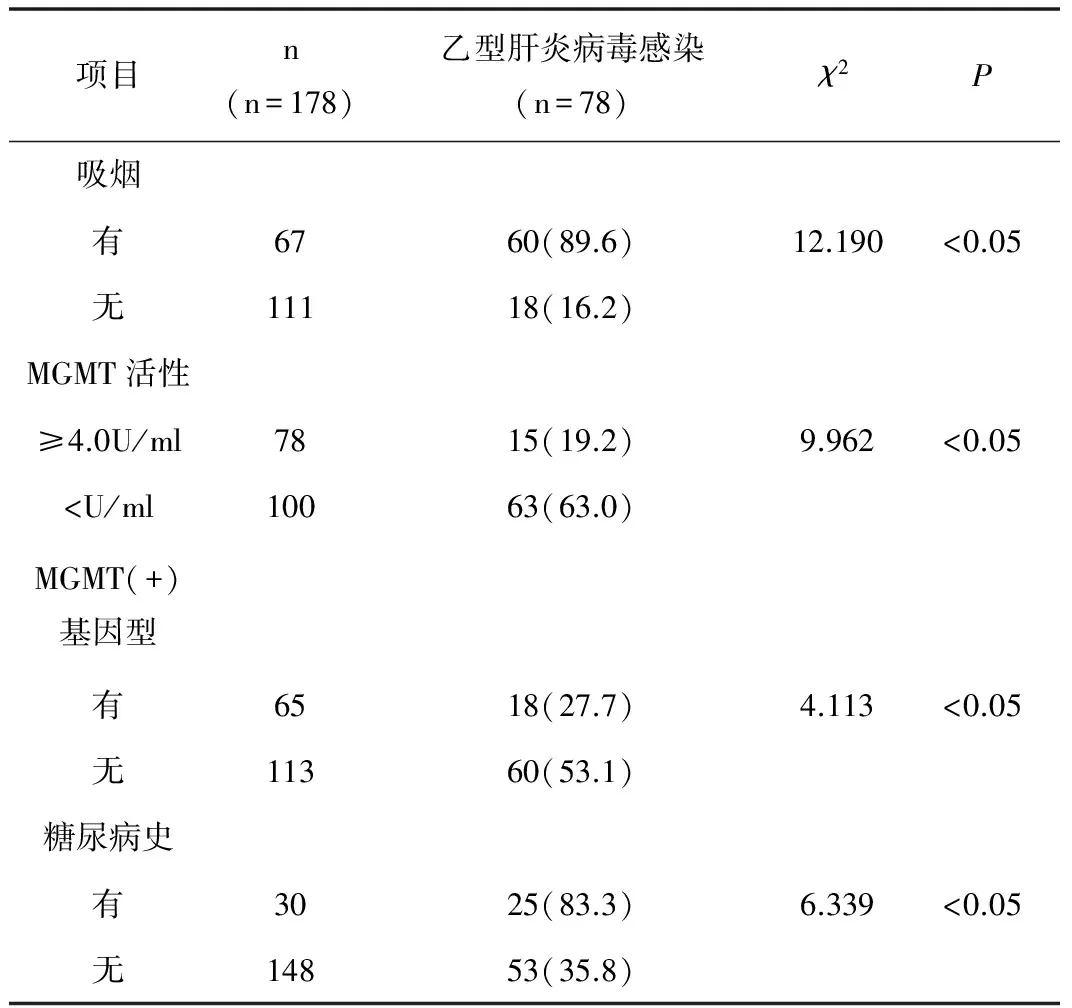
表3 肝癌组织中HBV感染单因素分析 [n(%)]
将上述指标纳入多因素Logistic回归分析,最终筛选出吸烟、MGMT活性、MGMT(+)基因型、糖尿病史为肝癌患者合并HBV感染发生的独立危险因素(P<0.05),见表4。

表4 肝癌组织中HBV感染的多因素分析
3 讨论
肝癌致病相关因素可大致分为外源性因素与内源性因素两种,外源性因素主要与自然环境和生存环境相关,内源性因素则包括机体的遗传背景、DNA损伤修复能力、免疫状态等,其中肝炎病毒感染可能是其中最重要的因素之一[11]。相关研究表明HBV感染后,可造成肝细胞损伤,引起病程慢性化,最后导致肝组织纤维化、肝硬化,诱发肝癌形成[12]。当前已证实肝组织内存在肝炎病毒特异性细胞毒性T淋巴细胞,可攻击肝炎病毒感染的肝细胞;且肝炎病毒高水平复制可通过与肝癌细胞结合,使肝癌细胞合成甲胎蛋白的能力增强,释放增加,从而导致血清甲胎蛋白升高[13,14]。
MGMT是分子量为22KDa的酶蛋白,能与DNA鸟瞟呤六号氧上的烷基化合物结合,使DNA上烷基化的鸟嘌呤被还原,而MGMT则成为失活的烷基化MGMT[15]。在肿瘤细胞中,MGMT分子上有两个烷基受体,可接受烷基化损伤的细胞DNA上6-烷基鸟嘌呤上的烷基,修复被烷基化的鸟嘌呤,因而可阻止DNA交联的形成,从而降低化疗药物的细胞毒作用[16]。本研究显示感染组患者 MGMT活性明显低于非感染组,表明乙型肝炎病毒感染可导致 MGMT活性降低。 SNP是在人类基因组中分布频率超过1%的单碱基改变,是基因序列中单个碱基的变异,碱基的变异可引起编码的氨基酸发生改变,从而影响相关蛋白质的功能。MGMT具有缺陷型(-)和功能型(+)两种基因型,变异基因型可能引起MGMT活性发生改变[17,18]。本研究显示178例肝癌患者中MGMT(+)基因型65例,MGMT(-)基因型113例,两组患者MGMT型分布频率比较差异有统计学意义。主要在于MGMT(-)基因型可产生大量无活性酶,导致机体解毒能力下降。
多因素Logistic回归分析显示吸烟、MGMT活性、MGMT(+)基因型、糖尿病史为肝癌患者合并乙型肝炎病毒感染发生的独立危险因素。2型糖尿病能加重肝功能的损害,促进肝硬化进程,也加速肝硬化向原发性肝癌的转化[19]。吸烟可使HBV感染者免疫力下降,进展为原发性肝癌的危险性明显增高[20]。MGMT在抗诱变和抗肿瘤过程中具有重要作用,且可以通过酶促和非酶促反应解除促癌剂和脂质毒性,免除促癌因素对正常细胞的影响[21]。病毒感染患者血浆中脂质过氧化产物增加,外周血单核细胞超氧化物歧化酶活性增高,促进肝纤维化进展,也会增加发展为原发性肝癌的危险性[22]。
[1] 凌宇,冯悦静.原发性肝癌与HBV感染关系的临床分析[J].中国实用医刊,2014,19(3):36-38.
[2] Jueliger S, Lyons J, Cannito S,etal. Efficacy and epigenetic interactions of novel DNA hypomethylating agent guadecitabine (SGI-110) in preclinical models of hepatocellular carcinoma[J].Epigenetics,2016,8(11):1-12.
[3] Yang XJ, Huang CQ, Peng CW,etal. Long noncoding RNA HULC promotes colorectal carcinoma progression through epigenetically repressing NKD2 expression[J].Gene,2016,592(1):172-178.
[4] 陈雪莉,杨宏强,季榕.乙型肝炎病毒感染与肝癌相关性的多因素分析[J].中华医院感染学杂志,2014,17(4):4288-4289.
[5] Sipos A, Iván J, Bécsi B,etal. Myosin phosphatase and RhoA-activated kinase modulate arginine methylation by the regulation of protein arginine methyltransferase 5 in hepatocellular carcinoma cells[J].Sci Rep,2017,11(7):40590.
[6] Zhou M, Zhang XY, Yu X. Overexpression of the long non-coding RNA SPRY4-IT1 promotes tumor cell proliferation and invasion by activating EZH2 in hepatocellular carcinoma[J].Biomed Pharmacother,2017,85(2):348-354.
[7] 王万鹏,宋德霸,赵龙栓.DNA-PKcs蛋白和MGMT蛋白在肝癌组织中的表达及意义[J].山东医药,2010,50(7):70-71.
[8] Shimizu D, Kanda M, Sugimoto H,etal. The protein arginine methyltransferase 5 promotes malignant phenotype of hepatocellular carcinoma cells and is associated with adverse patient outcomes after curative hepatectomy[J].Int J Oncol,2017,50(2):381-386.
[9] Zhang JJ, Chen JT, Hua L,etal. miR-98 inhibits hepatocellular carcinoma cell proliferation via targeting EZH2 and suppressing Wnt/β-catenin signaling pathway[J].Biomed Pharmacother,2017,85(2):472-478.
[10] Kavoosi F, Dastjerdi MN, Valiani A,etal. Genistein potentiates the effect of 17-beta estradiol on human hepatocellular carcinoma cell line[J].Adv Biomed Res,2016,30(5):133-139.
[11] 高春芳,吴孟超.重视乙型病毒性肝炎病毒基因变异的研究和转化应用[J].中华检验医学杂志,2014,37(2):90-92.
[12] Xu H, Zhu X, Xu Z,etal. Non-invasive Analysis of Genomic Copy Number Variation in Patients with Hepatocellular Carcinoma by Next Generation DNA Sequencing[J].J Cancer,2015,6(3):247-253.
[13] 林万松,林洁,林巧燕,等.乙型肝炎病毒X蛋白通过DNMT3A诱导肝癌细胞RUNX3基因高甲基化[J].中国人兽共患病学报,2016,32(8):717-721.
[14] Omran DA, Awad AH, Mabrouk MA,etal. Application of Data Mining Techniques to Explore Predictors of HCC in Egyptian Patients with HCV-related Chronic Liver Disease[J].Asian Pac J Cancer Prev,2015,16(1):381-385.
[15] 康艳红,李威,占伟丽,等.HBV X蛋白对抑癌基因p16的表达和启动子甲基化的影响[J].临床肝胆病杂志,2016,32(3):484-487.
[16] Lin S, Lin B, Wang X,etal. Silencing of ATP4B of ATPase H(+)/K(+) Transporting Beta Subunit by Intragenic Epigenetic Alteration in Human Gastric Cancer Cells[J].Oncol Res,2017,25(3):317-329.
[17] Huang L, Xu AM. SET and MYND domain containing protein 3 in cancer[J].Am J Transl Res,2017,9(1):1-14.
[18] 吴万庆,孙培春,傅聿铭,等.蛋白质精氨酸甲基转移酶7对肝癌细胞上皮-间充质转化及侵袭转移能力的影响[J].中华实验外科杂志,2015,32(2):306-309.
[19] 梁彤彤,郑志杰,乔永霞.糖尿病与原发性肝癌关系及作用机制的研究进展[J].中华预防医学杂志,2014,48(10):921-924.
[20] Hashimoto R, Kanda M, Takami H,etal. Aberrant expression of melanoma-associated antigen-D2 serves as a prognostic indicator of hepatocellular carcinoma outcome following curative hepatectomy[J].Oncol Lett,2015,9(3):1201-1206.
[21] Hwang SY, Yu SJ, Lee JH,etal. Reduction of oxidative stress attenuates lipoapoptosis exacerbated by hypoxia in human hepatocytes[J].Int J Mol Sci,2015,16(2):3323-3334.
[22] Cheng XS, Sun SB, Zhong F,etal. Knockdown of Histone Methyltransferase hSETD1A Inhibits Progression, Migration, and Invasion in Human Hepatocellular Carcinoma[J].Oncol Res,2016,24(4):239-245.
ClinicalstudyonthecorrelationbetweenhepatitisBvirusinfectionandtheexpressionofmethyltransferaseinhepatocellularcarcinoma
ZHANGHai-tao,ZHAOXiao-fei,LINing,SUNLi-bo△.DepartmentofHepatobiliarySurgeryandLiverTransplantationCenter,BeijingYou-AnHospital,CapitalMedicalUniversity(Beijing,100069)China
Objective:To investigate the relationship between hepatitis B virus infection and the expression of methyltransferase in patients with hepatocellular carcinoma.MethodsFrom January 2012 to February 2017, 178 cases of primary liver cancer patients in our hospital were selected as the research object, all the cases were divided into infection group of 78 cases and non infection group of 100 cases according to the hepatitis B virus infection, two groups of MGMT methyltransferase activity and genotype distribution were given PCR detection, and the clinical data were given the investigation correlation analysis.ResultsThe MGMT activity in the infection group was (3.45±1.46) U/ml, and the control group was (5.14±1.89) U/ml, the observation group was significantly lower than the control group (t=8.341,P<0.05). In the 178 cases, there were 65 cases of MGMT (+) genotype, 113 cases of MGMT (-) genotype, there were significant differences compared between the two groups of patients with MGMT genotype distribution(χ2=4.985,P<0.05). Univariate analysis showed that patients with hepatocellular carcinoma with hepatitis B virus infection were related to the smoking, MGMT activity, MGMT (-) genotype anddiabetes(P<0.05); Logistic regression analysis showed that the smoking,MGMT activity, MGMT (-) genotype and diabetes were independent risk factors for the occurrence of hepatitis B virus infection in the hepatocellular carcinoma patients.ConclusionHepatocellular carcinoma with hepatitis B virus infection is common, it accompanied by methyltransferase activity decreased the expression of MGMT .MGMT (+) genotype decreased, smoking,MGMT activity, MGMT (-) genotype and diabetes are the independent risk factors in patients with hepatocellular carcinoma with hepatitis B virus infection.
Hepatocellular carcinoma; hepatitis B virus; methyltransfer-ase; correlation
10.3969/j.issn.1005-0264.2017.04.004
北京市医院管理局临床技术创新项目(No.XMLX201711);△通讯作者
2017-03-28 编辑:陈盛铎)
