金黄色葡萄球菌CCT融合蛋白的表达及免疫活性研究
2017-12-29马金柱张少铎程欣然叶玉婷何溪雨徐乐宋佰芬于立权于永忠朱战波崔玉东
马金柱,张少铎,程欣然,叶玉婷,何溪雨,徐乐,宋佰芬,于立权,于永忠,朱战波,崔玉东
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
金黄色葡萄球菌CCT融合蛋白的表达及免疫活性研究
马金柱,张少铎,程欣然,叶玉婷,何溪雨,徐乐,宋佰芬,于立权,于永忠,朱战波,崔玉东
(黑龙江八一农垦大学生命科学技术学院,大庆 163319)
利用前期筛选的具有良好免疫原性的S.aureus表面Clfa蛋白免疫优势片段Clfais和TraP蛋白的融合重组蛋白,加入CTB分子内佐剂,以表达CTB-Clfais-TraP(CCT)蛋白和研究CCT免疫活性。实验采用重叠PCR方法将分子内佐剂CTB与Clfais-TraP基因串联,并将CTB-Clfais-TraP插入到表达载体pET32-a(+)上,构建pET32-a(+)-CTB-Clfais-TraP重组质粒,经鉴定后,重组质粒转化到大肠埃希菌BL21中表达目的蛋白,利用Western blot方法对其鉴定,以ELISA方法检测CCT蛋白的免疫活性。实验结果表明表达的CCT蛋白大小为87.6 ku,CCT能与Clfais、TraP免疫小鼠血清发生反应,表明CCT具有免疫活性,不受CTB分子影响,这为进一步研究CTB提高Clfais-TraP蛋白的免疫活性奠定了良好基础。
金黄色葡萄球菌;CTB-Clfais-TraP;蛋白表达;免疫活性
金黄色葡萄球菌(Staphylococcus aureus,S.aureus)是引起人和动物感染的重要病原菌,可引起多种疾病,尤其以奶牛乳房炎最为重要[1-3]。近些年,抗生素广泛使用引起金黄色葡萄球菌的耐药菌株不断出现,导致抗生素无法有效治疗S.aureus感染[4-6]。研究表明疫苗是解决S.aureus感染的有效方法,但现有的传统疫苗免疫原性不高,达不到人们预期结果,需要人们研制新型有效疫苗预防S.aureus感染。最近,研究表明S.aureus表面蛋白具有较强的免疫原性,有望成为S.aureus新型疫苗[7-9],并且,我们前期研究表明S.aureus的表面Clfa蛋白免疫优势片段Clfais和TraP蛋白的融合重组蛋白Clfais-TraP具有良好的免疫原性,有望成为新型候选疫苗的潜力,但还需提高其免疫保护作用。因此,研究将分子内佐剂CTB与Clfais-TraP蛋白联合表达,以进一步提高Clfais-TraP免疫效应,为今后S.aureus新型疫苗研究提供重要参考。
1 材料与方法
1.1 菌株、质粒
大肠杆菌(E.coli)BL21和原核表达载体pET32-a(+)均来自黑龙江八一农垦大学生物工程实验室保存。
1.2 主要试剂及酶
核酸内切酶SalⅠ与NotⅠ,质粒提取试剂盒,DNA聚合酶,蛋白Marker,DNA连接酶,HRP标记的羊抗鼠IgG等均购自宝生物工程(大连)有限公司。
1.3 表达载体构建
1.3.1 引物设计 根据Genbank中的CTB基因序列和Clfais-TraP碱基序列,利用DNAStar软件设计一对扩增CTB编码基因的特异性引物,并且上游引物(P1)5′端加上酶切位点SalⅠ(标有下滑线碱基),下游引物(P2)5′端加上linker碱基序列,另外,扩增Clfais-TraP碱基序列上下游引物(分别为P3和P4)5′端分别加上linker碱基序列和NotⅠ的碱基序列,经分析后以上引物均有很好的特异性。引物序列如下(标有下划线碱基代表酶切位点或linker碱基序列):P1:5′-GTCGACAAACACCTCAAAATATTACTGATTTGT-3′;P2:5′-AGATCCACCACCTGAACCTCCACCAATTTGCCATACTAATTGCG-3′;P3:5′-GGT GGAGG-TTCAGGTGGTGGATCTGTAGCTGCAGATG CACCGG-3′;P4:5′ATAGCGGCCGCCTATTCTTTTATTGG-GTATAGATATCTTT-3′。将以上引物邮寄上海生工生物工程技术服务有限公司合成。
1.3.2 目的基因扩增 采用CTB基因和Clfais-TraP基因片段作为模板,并以p1和p4作为引物,扩增CTB-Clfais-TraP基因片段。扩增的串联基因片段大小为1 848 bp片段。PCR反应体系组成如下:去离子水 13.8 μL,上游引物 1 μL(25 μmol·L-1)和下游引物1 μL(25 μmol·L-1),CTB 模板 0.5 μL,Clfais-TraP 模板 0.5 μL,2.5 mmol·L-1dNTP 1 μL,10×PCR 缓冲液2 μL,10 U·μL-1LA Taq DNA 聚合酶 0.2 μL,总反应体系为20 μL。反应热循环参数为:95℃预热3 min,95 ℃ 30 s,57 ℃ 40 s,72 ℃ 2 min,30个循环,最后72℃延伸10 min。
1.3.3 酶切与连接及转化 将纯化的CTB-Clfais-TraPPCR产物和pET32-a(+)载体酶切,酶切体系包括:10×NEB 缓冲溶液 5 μl,DNA 12 μL,SalⅠ 1 μL,NotⅠ 1 μL,ddH2O 31 μL,混匀后,37 ℃水浴中酶切1 h。再将纯化的酶切产物进行连接,连接体系为:SolutionI 5 μL(含 T4 连接酶),DNA 5 μL,载体10 μL,最后,16 ℃过夜连接。
将上述连接产物与感受态细胞(E.coli BL21)混匀后按常规方法进行转化:主要是连接产物冰浴45 min,42 ℃ 60 s,再冰浴 2 min,加入 1 mL LB 培养基37℃震荡培养1 h后,取100 μL培养物涂氨苄青霉素抗性的培养皿中,过夜培养,次日挑选单菌落培养后,提取质粒,采用SalⅠ与NotⅠ酶切和测序方法对其鉴定正确后,获得原核表达载体,命名为pET32-a(+)-CTB-Clfais-TraP(CCT)。
1.4 蛋白表达
获得的重组菌在含100 μg·mL-1氨苄青霉素的LB培养基中,37℃培养至OD600为0.4时,采用异丙基-β-D-硫代半乳糖苷(IPTG)诱导表达 3、4、5和6 h,然后,收集的细菌加入SDS凝胶上样缓冲液中,100℃煮沸6 min,冰浴2 min,室温下离心(12 000 rpm)10 min,取15 μL上清液用于SDS-PAGE电泳,分析CTB-Clfais-TraP(CCT)蛋白表达[8]。
1.5 蛋白表达检测
将重组菌(pET32-a(+)-CCT)、E.coli BL21 和重组菌 pET32-a(+)诱导之后,煮沸 6 min,离心后,上清液用于SDS-PAGE电泳。在Western blot过程中,以E.coli BL21和重组菌pET32-a(+)的上清液作为对照组,重组菌(pET32-a(+)-CCT)上清液作为实验组,电转后的膜用5%脱脂奶粉室温封闭2 h,TBST洗涤后,加入 His-Tag抗体(1∶1 000)4 ℃孵育过夜,洗涤后,加入HRP标记的羊抗鼠IgG(1∶5 000)室温反应1 h,最后,分析目的蛋白表达。
1.6 蛋白免疫活性分析
采用ELISA方法检测CTB是否影响Clfais-TraP蛋白免疫活性。实验过程中,以BSA、Clfais、TraP和CTB-Clfais-TraP蛋白作为包被抗原,其中,BSA作为阴性对照和Clfais、TraP蛋白作为阳性对照,包被抗原浓度均为0.01 mg·mL-1,包被时间4℃过夜,之后分别与Clfais和TraP免疫的小鼠血清反应,血清采用1∶1 000倍稀释,反应条件为37℃ 1 h,然后与HRP标记的羊抗鼠抗体(1∶1 000稀释)37℃孵育1 h,最后,PBST洗涤后,加入TMB溶液,避光条件下室温作用 10 min,加 50 μl终止液(2 mol·L-1H2SO4),以450 nm波长检测吸光度(OD450值)。
2 结果与分析
2.1 CTB-Clfais-TraP基因获得
以CTB与Clfais-TraP基因片段作为DNA模板和p1、p4作为引物,经嵌合PCR扩增得到一条1 848 bp的条带,PCR产物选用1%琼脂糖凝胶电泳检测,结果见图1所示。

图1 CTB-Clfais-TraP基因的PCR产物M,Fig.1 PCR product of CTB-Clfais-TraP
2.2 重组质粒的鉴定
SalⅠ与 NotⅠ酶切的 pET32-a(+)-CCT 产物采用琼脂糖电泳分析,紫外光下可见1 800 bp和5 900 bp左右的两条带,表明插入片段与目的片段1 848 bp大小相符,如图2所示。另外,重组质粒pET32-a(+)-CCT基因测序结果与目的基因序列相比,同源性为100%,说明目的基因插入正确(测序序列略去)。
2.3 目的蛋白表达
重组菌被IPTG诱导之后,蛋白表达情况选用SDS-PAGE电泳分析。结果显示在凝胶中90.0 ku左右处出现特异性蛋白条带,与预期蛋白87.6 ku大小相符,而对照菌中未见该蛋白条带,表明重组菌能够表达目的蛋白,并且IPTG诱导6 h,目的蛋白表达量相对较大,见图3。

图2 重组质粒的酶切鉴定Fig.2 Restriction enzyme digestion identification of recombinant plasmid
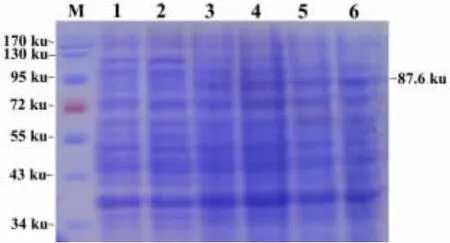
图3 重组菌的诱导表达Fig.3 The inducible expression of recombinant bacteria
2.4 Western Blot检测结果
因为目的蛋白带有His标签,因此,选用His抗体检测目的蛋白表达情况。结果显示在重组菌(pET32-a(+)-CCT)裂解液中出现分子量大小约为90 ku的特异性条带,与预期蛋白87.6 ku大小相符,而E.coli BL21菌裂解液和重组菌pET32-a(+)裂解液中未出现该条带,表明目的蛋白表达正确(见图4)。
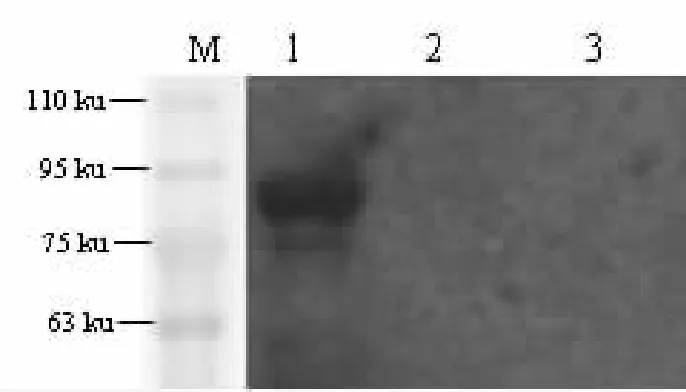
图4 Western blot的检测结果Fig.4 Detection of Western blot
2.5 目的蛋白免疫活性检测
利用ELISA方法分析CTB是否影响Clfais-TraP蛋白免疫活性。图5 ELISA结果表明CCT实验组与Clfais蛋白组的OD值比较无显著差异,而与BSA组OD值相比差异极显著;另外,图6 ELISA结果显示CCT实验组与TraP蛋白组OD值相比无明显差异,而与BSA组OD值比较差异极显著。因此,研究结果说明CCT蛋白分别能与Clfais和TraP蛋白免疫的小鼠血清发生免疫反应,具有良好免疫活性,表明CTB-Clfais-TraP联合表达时,CTB不影响Clfais-TraP蛋白的免疫活性,适合作为Clfais-TraP蛋白的分子内佐剂。
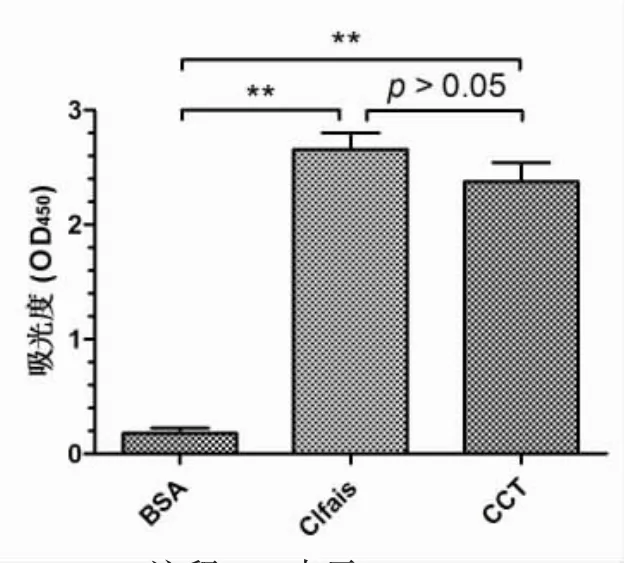
图5 CCT蛋白与Clfais免疫血清反应结果图Fig.5 Reaction between CCT protein and Clfais-immune serum
3 讨论
S.aureus致病机制复杂,能产生和分泌多种毒素和侵袭性酶类而致病,同时,它产生多种免疫逃避因子逃避宿主免疫反应[10-12]。近几年,研究发现S.aureus表面菌体蛋白具有较强的免疫原性,主要包括IsdB、ClfB、和FnBPA等分子[13-15],具有成为新型疫苗的巨大潜力。我们前期研究表明免疫优势片段Clfais和TraP联合表达的Clfais-TraP蛋白要强于二者单独表达的蛋白免疫原性,说明联合表达的蛋白可以一定程度上提高单独表达蛋白的免疫效果,但是,仍需进一步提高Clfais-TraP免疫原性才能达到人们理想需求。
近几年,作为分子内佐剂的霍乱毒素B亚单位(Cholera Toxin B Subunit,CTB)具有很好佐剂效应,且CTB可诱导Th1与Th17细胞活化[16],已引起很多学者重视。另外,人们已证实Th1与Th17细胞可活化CTL细胞和募集中性粒细胞,从而更加有效抵抗S.aureus感染,给S.aureus新型疫苗的研究提供了新思路[17-19]。因此,研究将CTB作为分子内佐剂与Clfais-TraP蛋白联合表达,以高效促进Th1与Th17细胞活化,进一步提高Clfais-TraP蛋白的免疫原性。研究采用原核表达系统表达了CTB-Clfais-TraP蛋白,且利用该蛋白N末端含有6个组氨酸的特点,以有效纯化该蛋白。ELISA研究结果显示CCT蛋白均能与Clfais和TraP蛋白免疫血清产生反应,表明CTB不影响Clfais-TraP蛋白的免疫活性,可以作为Clfais-TraP蛋白的分子内佐剂。研究仅对CCT蛋白免疫原性做了初步研究,还需要今后利用动物实验,进一步评价CCT蛋白的免疫保护作用,从而为S.aureus新型多亚单位疫苗研究提供重要参考。
4 结论
研究将CTB作为分子内佐剂,成功构建了原核表达载体 pET32-a(+)-CTB-Clfais-TraP,表达了目的蛋白CCT,并且CCT具有很好的免疫原性,这为进一步深入研究CCT免疫原性奠定了良好基础。
[1] Krishna S,Miller LS.Innate and adaptive immune responses against Staphylococcus aureus skin infections[J].Seminars in Immunopathology,2012,34:261-280.
[2] Melehani JH,Duncan JA.Inflammasome activation can mediate tissue-specific pathogenesis or protection in staphylococc-us aureus infection [J].Curr Top Microbiol Immunol,2016,397:257-82.
[3] Günther J,Petzl W,Bauer I,et al.Differentiating Staphylococcus aureus from Escherichia coli mastitis:S.aureus triggers unbalanced immune-dampening and host cell invasion immediately after udder infection[J].Sci Rep,2017,7(1):4811.
[4] Abernethy J,Sharland M,Johnson AP,et al.How do the epidemiology of paediatric methicillin-resistant Staphylococcus aureus and methicillin-susceptible Staphylococcus aureus bacteraemia differ[J].J Med Microbiol,2017,66(6):737-743.
[5] Althaqafi AO,Matar MJ,Moghnieh R,et al.Burden of methicillin-resistant Staphylococcus aureus pneumoniaamong hospitalized patients in Lebanon and Saudi Arabia[J].Infect Drug Resist,2017,10:49-55.
[6] Barkema HW,Schukken YH,Zadoks RN.Invited Review:The role of cow,pathogen,and treatment regimen in the therapeutic success of bovine Staphylococcus aureus mastitis[J].J Dairy Sci,2006,89(6):1877-1895.
[7] Foster TJ,H ö ö k M.Surface protein adhesins of Staphylococcus aureus[J].Trends Microbiol,1998,6(12):484-488.
[8] 马金柱,崔玉东,张晶,等.金黄色葡萄球菌isdb基因的克隆表达及其小鼠免疫试验[J].生物工程学报,2011,27(4):566-571.
[9] Josefsson E,Hartford O,O′Brien L,et al.Protection against experimental Staphylococcus aureus arthritis by vaccination with clumping factor A,a novel virulence determinant[J].J Infect Dis,2001,184(12):1572-1580.
[10] Pietrocola G,Nobile G,Rindi S,et al.Staphylococcus aureus Manipulates Innate Immunity through Own and Host-Expressed Proteases[J].Front Cell Infect Microbiol,2017,7:166.
[11] Broughan J,Anderson R,Anderson AS.Strategies for and advances in the development of Staphylococcus aureus prophylactic vaccines[J].Expert Review of Vaccines,2011,10:695-708.
[12] 代健,樊自尧,杨轩,等.定点突变阻止金黄色葡萄球菌α-溶血素溶血活性[J].黑龙江八一农垦大学学报,2014,26(2):44-49.
[13] Kuklin NA,Clark DJ,Secore S,et al.A novel Staphylococcus aureus vaccine:iron surface determinant B induces rapid antibody responses in rhesus macaques and specific increased survival in a murine S.aureus sepsis model[J].Infect Immun,2006,74(4):2215-2223.
[14] Schaffer AC,Solinga RM,Cocchiaro J,et al.Immunization with Staphylococcus aureus clumping factor B,a major determinant in nasal carriage,reduces nasal colonization in a murine model [J].Infect Immun,2006,74(4):2145-2153.
[15] Qian-Fei Zuo,Chang-Zhi Cai,Hong-Lei Ding.Identification of the Immunodominant Regions of Staphylococcus aureus Fibronectin-Binding Protein A [J].PLOS ONE,2014(4):95338.
[16] Meza-Sánchez D,Pérez-Montesinos G,Sánchez-García J,et al.Intradermal immunization in the ear with cholera toxin and its non-toxic β subunit promotes efficient Th1 and Th17 differentiation dependent on migrating DCs[J].Eur J Immunol,2011,41(10):2894-2904.
[17] 杜晓华,黄伶俐,刘会超.植物热激蛋白70(HSP70)研究进展[J].河南科技学院学报,2014,42(3):16-20.
[18] Montgomery CP,Daniels M,Zhao F,et al.Protective immunity against recurrent Staphyloco ccus aureus skin infection requires antibody and interleukin-17A[J].Infect Immun,2014,82(5):2125-2134.
[19] Proctor RA.Is there a future for a Staphylococcus aureus vaccine Vaccine,2012,30(19):2921-2927.
Expression and Immunocompetence of CCT Protein of Staphylococcus aureus
Ma Jinzhu,Zhang Shaoduo,Cheng Xinran,Ye Yuting,He Xiyu,Xu Le,Song Baifen,Yu Liquan,Yu Yongzhong,Zhu Zhanbo,Cui Yudong
(College of Life Science and Biotechnology,Heilongjiang Bayi Agricultural University,Daqing 163319)
According to the recombinant proteins of Clfais as immune superiority fragment of Clfa and TraP protein of Staphylococcus aureus(S.aureus)surface that exhibited good immunogenicity,the CTB intramolecular adjuvant gene was spliced with Clfais-TraP,then CTB-Clfais-TraP (CCT)protein was expressed and its immune activity was evaluated.Initially,CTB was tandem linked with Clfais-TraP by the overlapping PCR method,then,CTB-Clfais-TraP gene was inserted into pET32-a (+)vector to construct recombinant plasmids,pET32-a (+)-CTB-Clfais-TraP.After the pET32-a (+)-CTB-Clfais-TraP recombinant plasmids were identified,they were transformed into Escherichia coli(E.coli)BL21 to express the CCT,and CCT was detected by Western blot,then,immune activity of CCT was estimated by ELISA.These results showed the molecular size of CCT protein was 87.6 ku,and the CCT recombinant protein as ELISA coating antigen,could react with serum from mice immunized with Clfais,TraP,respectively.In conclusion,the pET32-a (+)-CTB-Clfais-TraP recombinant plasmids were successfully constructed,and CCT was correctly expressed in E.coli BL21 with the pET32-a(+)-CTB-Clfais-TraP plasmids,more importantly,CCT had strong immune activity,which would provide the foundation to further explore its immunogenicity.
Staphylococcus aureus;CTB-Clfais-TraP;protein expression;immunocompetence
Q786
A
1002-2090(2017)06-0040-05
10.3969/j.issn.1002-2090.2017.06.010
2016-07-21
黑龙江省自然科学基金项目(C201443);黑龙江省大学生创新创业训练计划项目(201510223001);大庆市指导性科技计划项目(szdfy-2015-44);黑龙江八一农垦大学博士启动基金。
马金柱(1976-),男,副教授,东北农业大学毕业,现主要从事分子免疫学和病原生物学方面的研究。
