葛根纤维渣中黄酮提取工艺优化及中试试验研究
2017-12-28张玉琴王志刚
张玉琴,王志刚
(1.信阳市罗山县工商管理和质量技术监督局 检验测试中心,河南 信阳 464200;2.汉川市公共检验检测中心,湖北 汉川 431600)
葛根纤维渣中黄酮提取工艺优化及中试试验研究
张玉琴1,王志刚2
(1.信阳市罗山县工商管理和质量技术监督局 检验测试中心,河南 信阳 464200;2.汉川市公共检验检测中心,湖北 汉川 431600)
葛根在提取葛粉后形成的纤维渣含有一定量的活性成分黄酮,该研究以葛根纤维渣为原料,采用乙醇提取黄酮,通过单因素试验及响应面试验,考察液料比、乙醇体积分数、提取时间、提取温度对黄酮提取率的影响,得到最优黄酮提取工艺条件为液料比8.3∶1(mL∶g)、乙醇体积分数42%、提取时间3.7 h、提取温度69℃,在此条件下葛根纤维渣黄酮提取率达到7.85%,并通过中试验证可得到黄酮含量达到13.1%的葛根提取物。
葛根纤维渣;黄酮;响应面;提取工艺
葛根是国家卫生部批准的药食两用的植物,素有亚洲人参之美称。野生葛中富含异黄酮类、多糖类、氨基酸、微量元素等物质,具有重要的药理功能和药用价值[1-3]。葛根主要用于提取葛根淀粉用于食品原料或提取葛根黄酮用于生物医药和化工工业的重要原料[4]。国内葛根生产企业在葛根提取完淀粉后多将其丢弃,这样既污染了环境,又浪费了资源。而目前国内、外对提取葛根淀粉后的葛根纤维渣的开发利用主要集中在制备天然葛根纤维[5-8]或制备功能性纤维低聚糖方面[9],而利用其提取葛根黄酮的报道非常少。葛根纤维渣中含有丰富的葛根黄酮,对其的开发利用将有益于提高葛根的附加值[10-13]。本试验拟以乙醇为浸提剂,以野葛根纤维为原料,以黄酮提取率为考察对象,通过单因素试验及响应面试验优化葛根纤维渣的提取工艺条件,为葛根纤维的综合利用提供参考。
1 材料与方法
1.1 材料与试剂
野生葛根纤维渣:由湖北昌禾农业发展有限公司提供;葛根素标准品(纯度≥99%):上海亿思科技公司产品;无水乙醇(分析纯):国药集团化学试剂有限公司产品;体积分数95%乙醇(食品级):河南天冠集团公司产品。
1.2 仪器与设备
Agilent8453紫外可见分光光度计:美国Agilent科学仪器公司;AL204型电子天平:北京赛多利斯天平有限公司;HWS-26电热恒温水浴锅:上海一恒科学仪器有限公司;TDZ5-WS离心机:湖南湘仪集团;RE-5210A旋转蒸发仪:上海亚荣生化仪器厂;SP-1500实验型喷雾干燥机:上海顺仪实验设备有限公司;5 t生物提取罐:温州雨润机械科技有限公司。
1.3 方法
1.3.1 葛根纤维渣黄酮提取工艺
葛根纤维渣→乙醇加热浸提→过滤→滤过液→离心分离→上清液→真空浓缩→喷雾干燥→葛根提取物
操作要点:
1)提取:取干燥的葛根纤维渣20 g,置于500 mL圆底烧瓶中,按不同液料比加入体积分数40%乙醇溶液于70℃水浴提取3 h左右;
2)分离:提取结束后物料用120目不锈钢滤网过滤,滤液再以3 000 r/min离心分离10 min取上清液;
3)浓缩:将上清液放入旋转蒸发仪中真空浓缩至初始体积的1/3,即为浓缩液;
4)干燥:将浓缩液以20 mL/min的速度泵入喷雾干燥机中进行喷雾干燥,控制进风温度185~195℃,出风温度85~90℃,干燥物即为葛根提取物。
1.3.2 葛根提取物中黄酮含量的测定
精密称取0.1 g葛根提取物置于100 mL容量瓶中,用无水乙醇定容至刻度,摇匀,并于波长249 nm处测定吸光度值,根据葛根素标准曲线求得葛根提取物中黄酮的含量。
1.3.3 葛根黄酮提取率[14]
精密称取20 g干燥的葛根纤维渣置于500 mL圆底烧瓶中,用体积分数40%乙醇溶液于70℃提取3 h,过滤,测定提取液中的黄酮含量,黄酮提取率计算公式如下:

1.3.4 葛根纤维渣黄酮提取单因素试验
在葛根纤维渣黄酮提取中,分别称取20 g干燥的葛根纤维渣置于500mL圆底烧瓶中依次分别就液料比(4∶1、6∶1、8∶1、10∶1、12∶1(mL∶g))、乙醇体积分数(20%、30%、40%、50%、60%、70%)、提取时间(1 h、2 h、3 h、4 h、5 h、6 h、7 h、8 h)、提取温度(40℃、50℃、60℃、70℃、80℃、90℃)进行单因素试验,测定各实验中葛根黄酮的提取率,以考察各因素对黄酮提取率的影响。
1.3.5 葛根黄酮提取工艺优化试验

表1 黄酮提取条件优化响应面试验因素与水平Table 1 Factors and levels of response surface methodology for flavonoids extraction conditions optimization
1.3.6 葛根纤维黄酮提取中试试验
向5 t生物提取罐中投入0.5 t干葛根纤维渣,按液料比8.3∶1的比例投入体积分数42%的乙醇溶液4.2 t,在69℃条件下提取3.7 h,提取液经过滤、浓缩,喷雾干燥后得葛根提取物粉。
2 结果与分析
2.1 葛根素标准曲线[14-15]
精密称取干燥的葛根素标准品20 mg于100 mL容量瓶中,用无水乙醇定容至刻度,摇匀放置于4℃冰箱保藏备用。分别吸取上述葛根素标样溶液0.1 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL放置于10 mL容量瓶中,并各加无水乙醇1.0 mL,再加纯水稀释至刻度,摇匀。取1.0 mL无水乙醇,加水稀释至10 mL,作空白对照,在波长249 nm处测吸光度值,以葛根素的质量浓度为横坐标、吸光度值为纵坐标,绘制葛根素标准曲线。

图1 葛根素标准曲线Fig.1 Standard curve of puerarin
2.2 单因素试验
2.2.1 液料比对葛根黄酮提取率的影响
分别按照2∶1、4∶1、6∶1、8∶1、10∶1、12∶1(mL∶g)的液料比加入体积分数50%的乙醇溶液,在70℃条件下提取4 h,测定葛根黄酮提取率,结果见图2。
当年被当代人誉为“最伟大的牛津人”的神学家路易斯在他的著作《痛苦的奥秘》中写道:“刚上大学的时候,我连一个男孩应该具备的起码的道德良知都没有。我只对残忍和吝啬有一点模糊的厌恶,这便是我最大的成就,而我对仁慈、诚实和自我牺牲的认识,就像狒狒对古典音乐的认识一样贫乏。”这样一个多年以后把仁爱变成文字使我们得以洗涤魂魄的天才,他的本然情感同样也是贫乏的,是不断接受着吸吮着来自仁者的教养,才逐渐清洗掉自己的“罪性”,活成了一个尊贵的人。
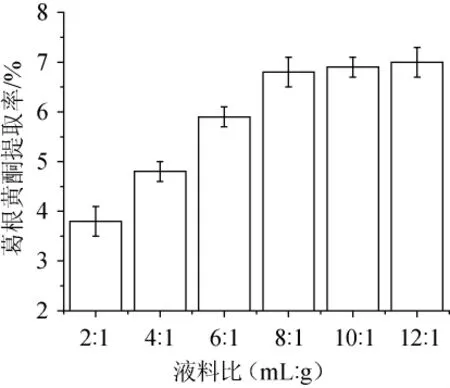
图2 液料比对黄酮提取率的影响Fig.2 Effect of liquid-solid ratio on flavonoids extraction ratio
由图2可知,在液料比小于8∶1(mL∶g)时,葛根黄酮的提取率随着液料比的升高而提高,当液料比达到8∶1(mL∶g)后黄酮的提取率升高缓慢,这是因为在固液提取中,提取速率是一定的,当提取液用量增加时,提取率也随之增加,而在一定提取时间内,当提取达到平衡时,其提取率就不会再提高了。因此,生产中从提取液的回收及成本上考虑,初步确定葛根黄酮提取的液料比为8∶1(mL∶g)。
2.2.2 乙醇体积分数对葛根黄酮得率的影响
以8∶1的液料比加入不同体积分数的乙醇,在70℃水浴提取3 h,测定葛根黄酮提取率,结果见图3。
由图3可知,当乙醇体积分数<40%时,葛根黄酮的提取率随着乙醇体积分数的提高而增大,当乙醇体积分数为40%时葛根黄酮的提取率达到最大,之后以后随着乙醇体积分数的提高提取率又逐步下降,这是葛根黄酮中甙元成分不溶于水,而糖易溶于水,当乙醇与水的比例达到一定值时可获得较高的提取率。从生产的角度考虑初步确定葛根黄酮提取用乙醇体积分数为40%。
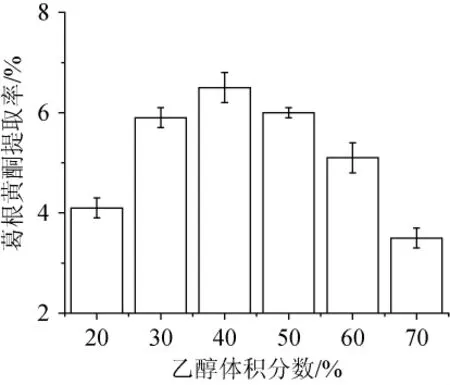
图3 乙醇体积分数对黄酮提取率的影响Fig.3 Effect of ethanol concentration on flavonoids extraction ratio
2.2.3 提取时间对葛根黄酮得率的影响
以8∶1的液料比加入体积分数40%的乙醇溶液,在70℃水浴提取不同的时间,测定葛根黄酮提取率,结果见图4。

图4 提取时间对黄酮提取率的影响Fig.4 Effect of extraction time on flavonoids extraction ratio
由图4可知,葛根黄酮的提取率在4 h之前随着时间的延长而不断增加,在提取时间4 h时达到最大值,4 h后黄酮的提取率基本上维持恒定,其原因可能是黄酮在高温条件下自身易被氧化破坏,使得黄酮提取率有所减少[14]。因此,从生产成本考虑初步确定葛根黄酮提取时间4h较为合适。
2.2.4 提取温度对葛根黄酮得率的影响
以8∶1的液料比加入体积分数40%乙醇溶液,在不同温度条件下水浴提取4 h,测定葛根黄酮提取率,结果见图5。
由图5可知,当提取温度低于70℃时,葛根黄酮的提取率随着温度的升高而升高,当温度达到70℃时葛根黄酮的提取率达到最大值,提取温度高于70℃后,葛根黄酮的提取率则随温度的升高而降低,说明温度的升高对植物组织的浸润和对有效成分的溶解也有促进作用,有利于黄酮的提取,但温度太高也会使黄酮的化学结构发生破坏,使其提取率降低[14]。因此,从生产成本考虑初步确定70℃为葛根黄酮的提取温度。

图5 提取温度对黄酮提取率的影响Fig.5 Effect of extraction temperature on flavonoids extraction ratio
2.3 葛根黄酮提取工艺优化[16-19]
在单因素试验的基础上,以液料比、乙醇体积分数、提取时间、提取温度为评价因素,葛根黄酮提取率为评价指标进行Box-Behnken中心组合试验,结果见表2,方差分析见表3。
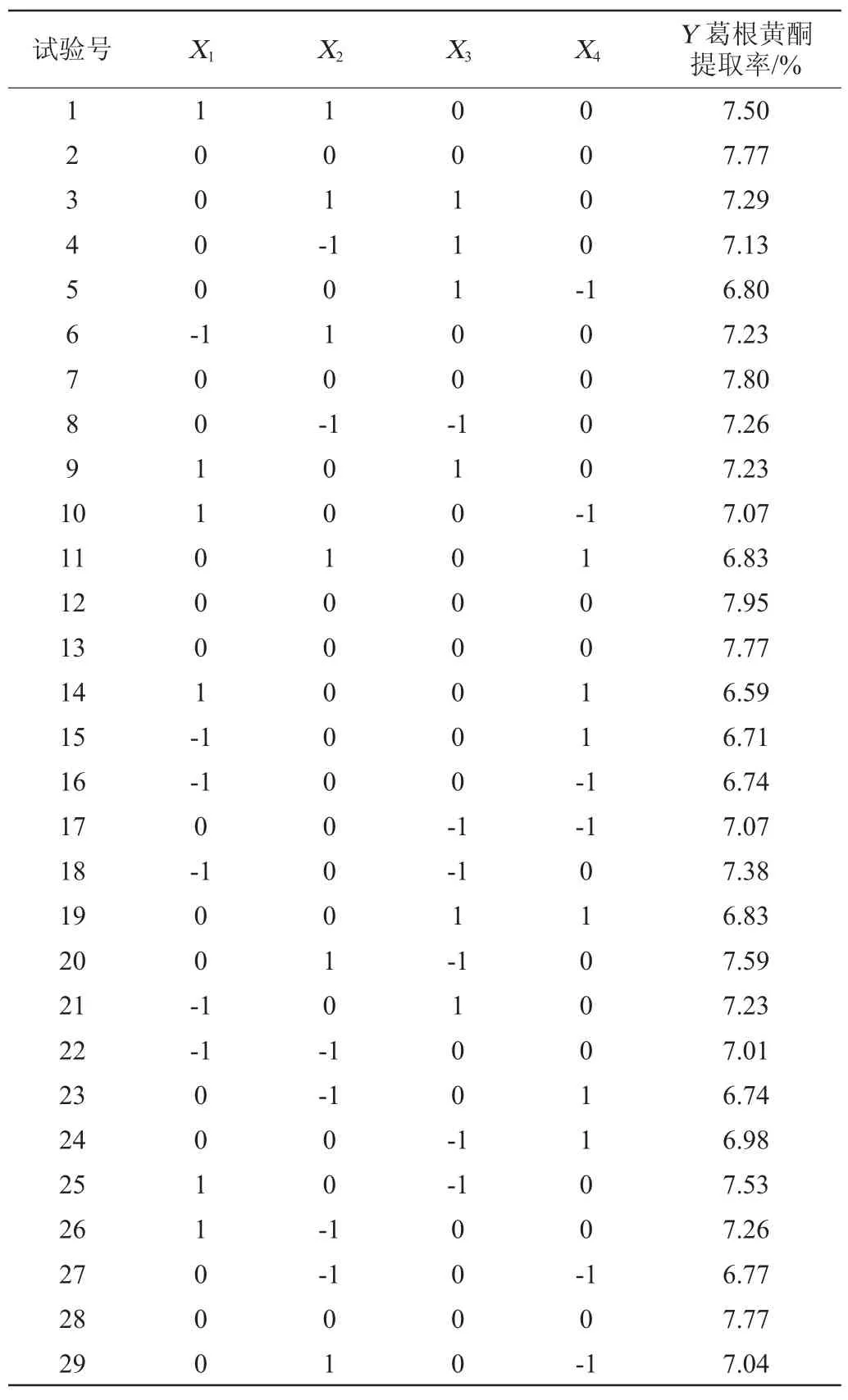
表2 黄酮提取条件优化响应面试验设计与结果Table 2 Design and results of response surface methodology for flavonoids extraction conditions optimization
应用Design Expert7.5软件,对表2中的数据进行多元回归拟合,可得到液料比(X1)、乙醇体积分数(X2)、提取时间(X3)、提取温度(X4)与黄酮的提取率(Y)之间的二次多项回归方程:

对回归方程进行方差分析和显著性检验,结果见表3。
该模型回归显著(P<0.000 1),方程的X1、X2、X3、X4、X1X4、X12、X22、X32、X42都是显著的(P<0.05),该模型的R2=0.980 0、R2Adj=0.960 1,说明该方程与实际情况拟和较好,能够较好反⒊液料比(X1)、乙醇体积分数(X2)、提取时间(X3)、提取温度(X4)等因素与黄酮的提取率(Y)之间的关系,可以用该回归方程对试验结果进行分析预测,各因素交互作用对于响应值的响应面分析见图6。
对回归方程求导数,当响应值Y最大时可得各因素的值:X1=0.16、X2=0.23、X3=-0.33、X4=-0.08,经转换后,得到葛根黄酮提取的最佳工艺条件:液料比8.32∶1(mL∶g)、乙醇体积分数42.3%、浸提时间3.67 h、提取温度69.2℃,预测葛根黄酮提取率为7.85%。
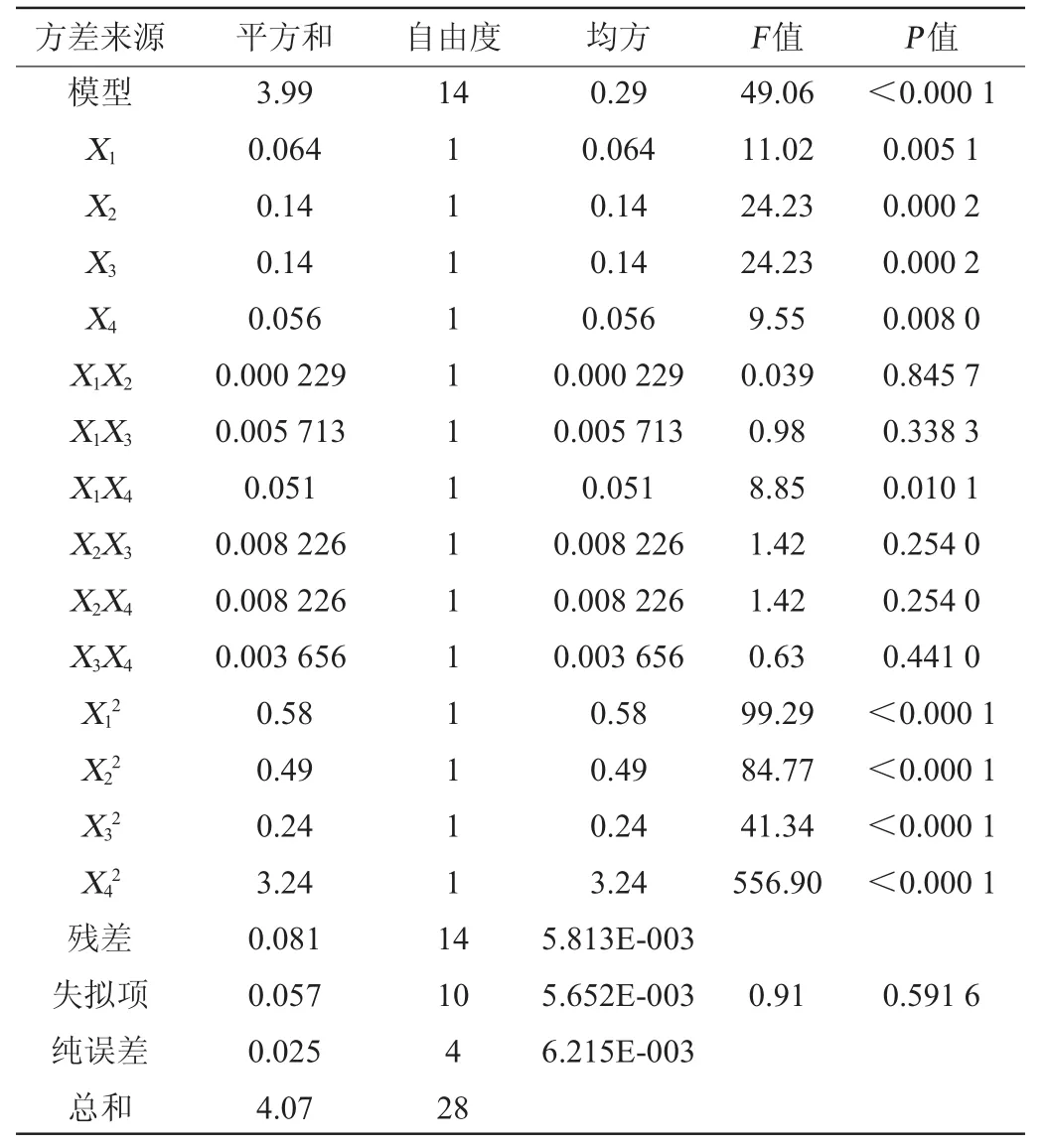
表3 响应面试验结果方差分析Table 3 Variance analysis of response surface experiments results
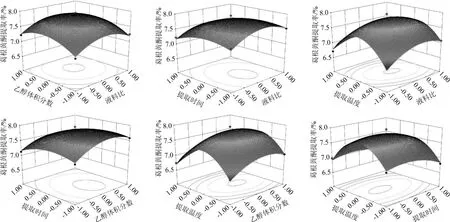
图6 液料比、乙醇体积分数、提取时间、提取温度交互作用对黄酮提取率影响的响应面及等高线Fig.6 Response surface plots and contour line of effects of interaction between liquid-solid ratio,ethanol concentration,extraction time and temperature on the flavonoids extraction ratio
为方便实际操作,在液料比8.3∶1(mL∶g)、乙醇体积分数42%、浸提时间3.7 h、提取温度69℃的条件下进行验证试验,得到葛根黄酮提取率为7.54%,与预测值相符。
2.4 葛根纤维黄酮提取中试试验
在葛根黄酮提取的最佳工艺条件下,0.5 t葛根纤维黄酮提取中试试验结果见表4。
由表4可见,在0.5 t规模的葛根纤维黄酮提取试验中,葛根黄酮的平均提取率为7.44%,基本符合预期,葛根纤维渣中的黄酮得到了较好的回收[11,20]。

表4 0.5 t葛根纤维渣黄酮提取试验结果Table 4 Experimental results of flavonoids extraction from 0.5 t kudzu root fiber residue
3 小结
该研究以葛根纤维为原料,以乙醇为介质提取葛根黄酮,通过单因素试验及响应面试验,对影响黄酮提取率的液料比、乙醇体积分数、提取时间、提取温度等因素进行了优化,并构建了葛根黄酮提取的数学模型,并通过响应面分析,确定了葛根黄酮提取的最佳工艺条件:液料比8.3∶1(mL∶g)、乙醇体积分数42%、浸提时间3.7 h、提取温度69℃,在此条件下,葛根黄酮提取率可达到7.85%。通过0.5 t规模的葛根纤维黄酮提取中试试验,证明在优化条件下葛根黄酮的平均提取率可达7.44%,葛根提取物中黄酮平均含量为13.1%。
[1]陈荔炟.葛根黄酮类成分的提取分离及其质量分析研究[D].武汉:湖北中医学院,2007.
[2]刘杏荣.葛根异黄酮的检测方法与提取纯化工艺研究[D].镇江:江苏大学,2007.
[3]张 静,郝建平,王 峰,等.6种晋产野生葛根中葛根素、大豆苷和总黄酮含量比较[J].天然产物研究与开发,2015,27(1):99-102,133.
[4]黄 靖,罗 健.葛根的开发利用[J].江西食品科技,2002(1):19-21.
[5]刘洋洋,谢光银,吴长春,等.化学和超声波联合提取葛根纤维技术研究初探[J].中国麻业科学,2013,35(3):150-154.
[6]张如全,王成国,吉德裕,等.由葛根废渣制备葛根纤维的研究[J].上海纺织科技,2011,39(2):26-28.
[7]刘洋洋,张如全,吉德裕,等.葛根纤维化学脱胶工艺研究[J].林产化学与工业,2011,31(3):79-83.
[8]MITICH L W.Kudzu (Pueraria lobata (Willd.)Ohwi)[J].Weed Technol,2000,14(1):231-235.
[9]刘胜男,宛晓春,杜先锋.酶法制备葛根纤维低聚糖[J].食品科学,2012,33(4):66-70.
[10]施英英,夏黎明.葛根渣固态发酵产异黄酮的研究[J].林产化学与工业,2007,27(1):57-60.
[11]施英英,薛培俭,夏黎明.酶法提取葛根渣中异黄酮的研究[J].林产化学与工业,2006,26(1):62-64.
[12]施英英.葛根渣异黄酮酶法提取的应用基础研究[D].杭州:浙江大学,2006.
[13]王润东,邵 伟.红茶菌固定化发酵葛根茶饮料工艺研究[J].中国酿造,2015,34(3):158-161.
[14]雷小丹,邱朝坤,刘晓宇,等.葛根黄酮提取工艺条件优化的响应面分析[J].食品科技,2011,36(9):223-226.
[15]任雪琴,陈 新,吴 兵,等.葛根黄酮的提取工艺及三波长-分光光度法测定其含量[J].武汉工业学院学报,2011,30(4):32-36.
[16]诸爱士.葛根黄酮提取工艺优化[J].浙江科技学院学报,2013,25(5):366-372.
[17]朱德艳.乙醇回流法提取葛根黄酮的工艺优化研究[J].中国酿造,2015,34(11):145-148.
[18]肖卫民.葛根总黄酮的微波辅助萃取与大孔树脂纯化[D].重庆:西南农业大学,2004.
[19]王 端,周鸿翔,田娅玲,等.微波辅助提取葛根黄酮的工艺研究[J].中国酿造,2014,33(3):81-86.
[20]李传润,王效山,胡海霞,等.中药葛根综合开发工艺中试研究[J].安徽医药,2007,21(9):774-775.
Extraction process optimization and pilot scale extraction of flavonoids in kudzu root fiber
ZHANG Yuqin1,WANG Zhigang2
(1.Center of Inspection and Testing,Xinyang Luoshan Business Administration and Quality Technical Supervision,Xinyang 464200,China;2.Hanchuan Public Inspection and Testing Center,Hanchuan 431600,China)
There are active ingredients flavonoids in kudzu root fiber residue after kudzu powder extraction.Using kudzu root fiber residue as raw material,flavonoids were extracted by ethanol.The effects of liquid to solid ratio,ethanol concentration,extraction time and temperature on flavnoid extraction ratio were investigated by single factor experiments and response surface experiments.The optimal flavonoid extraction conditions were liquid-solid ratio 8.3∶1 (ml∶g),ethanol concentration 42%,extraction time 3.7 h,temperature 69 ℃.Under the conditions,the flavonoid extraction ratio of kudzu root fiber residue reached 7.85%,and the flavonoid content of kudzu root extracts was 13.1%by pilot scale tests.
kudzu root fiber;flavonoids;response surface methodology;extraction process
TQ461
0254-5071(2017)12-0134-05
10.11882/j.issn.0254-5071.2017.12.028
2017-08-01
张玉琴(1978-),工程师,本科,主要从事检验检测工作。
