RGS4表达上调对人恶性黑素瘤细胞的M14增殖和迁移的影响
2017-12-28薛晓彤张倩倩黄淑红党宁宁
薛晓彤 焦 敬 张倩倩 黄淑红 党宁宁
·论著·
RGS4表达上调对人恶性黑素瘤细胞的M14增殖和迁移的影响
薛晓彤1,2焦 敬3张倩倩3黄淑红1党宁宁2
目的明确体外RGS4基因表达上调对恶性黑素瘤M14细胞中增殖及迁移的影响。方法体外培养M14细胞,分为对照组(转染pcDNA3.1空质粒)和实验组(转染pcDNA3.1-RGS4质粒)。RT-PCR和Western blot检测转染后RGS4 mRNA和RGS4蛋白水平的表达,CCK-8和克隆形成实验检测RGS4上调对恶性黑素瘤M14细胞增殖的影响,划痕实验检测RGS4高表达对M14细胞迁移的影响。结果实验组细胞中RGS4 mRNA表达量是对照组的3.25×103倍(P<0.05),蛋白表达量是对照组的6.73倍(P<0.05)。实验组M14细胞OD值为1.33±0.07,低于对照组的1.61±0.11(P<0.05),实验组M14细胞克隆数为34±5.53,低于对照组的56±7.68(P<0.05)。实验组M14细胞迁移能力低于对照组。结论RGS4高表达能够抑制体外恶性黑素瘤细胞的增殖和迁移,RGS4在恶性黑素瘤的发生、发展中可能发挥重要作用。
G蛋白偶联受体; RGS4基因; 恶性黑素瘤; 增殖和迁移
恶性黑素瘤是一种来源于皮肤黑素细胞的恶性肿瘤,早期可通过血液和淋巴循环转移至全身各器官,是皮肤癌的主要死亡原因之一[1]。G蛋白偶联受体(G protein coupled receptor,GPCR)广泛存在于人体,其异常激活或过度表达与癌细胞的增殖和转移密切相关。G蛋白信号通路调节蛋白(regulator of G-protein signaling,RGS)是一组具有多种功能的蛋白质大家族,在GPCR信号传导中起重要作用。我们对RGS4 基因表达上调后恶性黑素瘤M14细胞增殖及迁移的影响做了初步研究,以探讨RGS4 基因的表达在黑素瘤中的调控机制。
1 材料与方法
1.1 主要材料与仪器 人恶性黑素瘤细胞株M14购自中国医学科学院肿瘤细胞库。培养液DMEM和胎牛血清购自美国Gibco公司,转染试剂LipofectamineTM2000购自美国Invitrogen公司,CCK-8试剂购自北京Solarbio公司,Trizol reagent、qRT-PCR试剂盒、RNA提取试剂盒、质粒提取试剂盒、蛋白抽提试剂盒以及RIPA裂解液购自北京康为世纪生物科技有限公司。兔抗人RGS4单克隆抗体和鼠抗人Tubulin单克隆抗体购自英国Abcam公司,RGS4特异性PCR引物由金唯智(苏州)生物科技有限公司合成,pcDNA3.1-RGS4 vector购自上海吉凯基因化学技术有限公司。7300型荧光定量PCR仪购自美国ABI公司。
1.2 方法
1.2.1 细胞培养 M14细胞培养于含10%胎牛血清的DMEM中,在37℃、5% CO2培养箱中培养,每2天传代1次,取对数生长期的细胞用于实验。
1.2.2 pcDNA3.1-RGS4转染 常规培养M14细胞,将处于对数生长期的M14细胞接种于6孔板中,次日当细胞融合度达70%~80%时进行转染,分为对照组(转染pcDNA3.1)和实验组(转染pcDNA3.1-RGS4)。转染采用Opti-MEM、无血清RMPI DMEM和LipofectamineTM2000,参照转染说明书操作。转染后于37℃、5% CO2培养箱中培养4~6 h,更换新鲜含10%胎牛血清的DMEM培养液继续孵育24 h。
1.2.3 荧光定量PCR检测 RGS4 mRNA的表达转染处理后,用Trizol法提取各组细胞的总RNA并逆转录为cDNA。采用SYBR Green荧光染料,实时荧光定量PCR检测各组RGS4 mRNA的表达水平。PCR的扩增条件为:95℃预变性30 s,95℃变性5 s,60℃退火+延伸31 s,40个循环。RGS4引物:正义5’-CTTTTTACAGGACGCAGGCAT-3’,反义5’-CAGCAGGAAACCTAGCCGAT-3’,产物大小139 bp。内参β-actin引物:正义5'-TGACGTGGACATCCGCAAAG-3’,反义5'-CTGGAAGGTGGACAGCGAGG-3',产物大小205 bp。计算各组RGS4 mRNA的相对表达量:△CT=待测样本(CT目的基因-CTβ-actin),△△CT=△CT转染组-△CT对照组,基因相对表达差异量=2-△△CT。实验重复3次。
1.2.4 Western blot检测RGS4蛋白的表达 转染处理后,提取细胞总蛋白并定量,每组取30 μg总蛋白进行SDS-PAGE电泳,转膜,封闭,分别加入鼠抗人Tubulin单克隆抗体(1∶10000),兔抗人RGS4单克隆抗体(1∶500) 孵育24 h,加入二抗,之后进行ECL显影。应用Image J软件,通过与内参Tubulin灰度的比值,对RGS4蛋白进行定量分析。实验重复3次。
1.2.5 CCK-8实验检测转染前后M14细胞增殖的变化 6孔板培养M14细胞,24 h转染处理后,对照组和实验组分别接种于96孔板中,调整细胞密度为100个/孔(100 μL)。分别在24 h、48 h、72 h、96 h后加入10 μL CCK-8试剂,在37℃、5% CO2条件下孵育2 h后,酶标仪测定450 nm处光密度(OD)值。实验重复3次。
1.2.6 克隆形成实验检测转染前后M14细胞增殖的变化 转染处理后,将细胞以500个/孔的密度接种到6孔板中,并在37℃下孵育10天,每3天更换一次培养液。用甲醇固定菌落,用0.5%结晶紫(甲醇∶水=1∶1)染色。然后计数含有至少50个细胞的菌落数。实验重复3次。
1.2.7 划痕实验检测转染前后M14细胞迁移能力的变化 转染处理后,24 h之后,使用微小吸头的尖端进行划痕,产生无细胞的区域并在显微镜下拍照。将细胞在37℃、5% CO2条件下培养,48 h后,在显微镜下拍照。两次照片进行对比。实验重复3次。
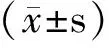
2 结果
2.1 pcDNA3.1-RGS4转染后M14细胞中RGS4 mRNA和蛋白水平的表达 pcDNA3.1-RGS4转染促进M14细胞中RGS4 mRNA和蛋白的表达(图1)。pcDNA3.1-RGS4转染M14细胞24 h后,RT-PCR结果显示,对照组(pcDNA3.1)RGS4 mRNA相对表达量为1,与对照组相比,实验组(pcDNA3.1-RGS4)中RGS4 mRNA 的表达量明显升高(P<0.01)。转染处理24 h后,Western blot结果显示,与对照组相比,实验组的蛋白相对表达量(RGS蛋白量/Tubulin蛋白量)显著升高(P<0.01)。
2.2 pcDNA3.1-RGS4转染后对M14细胞增殖作用的影响 pcDNA3.1-RGS4转染后抑制M14细胞的增殖(图2)。pcDNA3.1-RGS4转染M14细胞24 h后,CCK-8检测结果显示,与对照组相比,实验组可明显抑制恶性黑素瘤M14细胞的增殖(P<0.05)。我们利用克隆形成实验进一步验证实验结果,克隆形成实验检测结果显示,与阳性对照组相比,pcDNA3.1-RGS4转染可明显抑制M14细胞的增殖(P<0.05)。
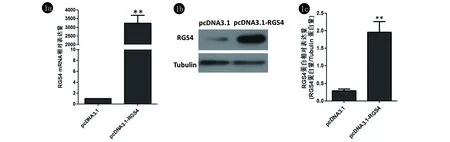
图1 pcDNA3.1-RGS4转染后M14细胞中RGS4 mRNA(1a)和蛋白(1b、1c)水平的相对表达量**vs pcDNA3.1组P<0.01

图2 pcDNA3.1-RGS4转染后抑制M14细胞的增殖。CCK-8实验(2a)和克隆形成实验(2b、2c)被用于检测pcDNA3.1-RGS4转染后对M14细胞增殖能力的影响。*vs pcDNA3.1组P<0.05
2.3 pcDNA3.1-RGS4转染后对M14细胞迁移作用的影响 pcDNA3.1-RGS4转染后抑制M14细胞的迁移见图3。pcDNA3.1-RGS4转染M14细胞24 h后进行处理拍照,再过48 h第二次拍照,两次照片进行对比,结果显示,与转染pcDNA3.1空质粒组相比,转染pcDNA3.1-RGS4能够使恶性黑素瘤M14细胞的迁移能力明显降低。

图3 pcDNA3.1-RGS4转染后抑制M14细胞的迁移。细胞划痕实验被用于检测pcDNA3.1-RGS4转染后对M14细胞迁移的影响
3 讨论
GPCR是一个庞大的七跨膜螺旋受体家族,它是细胞信号传导中的重要蛋白质。RGS作为GTPase激活蛋白,通过加速Gα亚基结合的GTP水解,恢复G蛋白失活状态,从而抑制不同的GPCR信号传导[2]。因此,RGS蛋白是GPCR重要的负性调节因子。近年来,RGS基因在癌症中的表达及其作用的分子生物学机制成为研究热点,包括RGS1-5,8,13,16,18和21在内的R4 RGS蛋白亚家族。RGS2的异常表达与乳腺癌、前列腺癌、急性骨髓性白血病、卵巢癌和淋巴瘤的发生和发展有关[3]。 RGS3的过表达促进白血病HL-60细胞的凋亡[4]。RGS4作为乳腺癌迁移和侵袭的新型抑制因子,对于控制乳腺癌转移具有重要意义[5]。 RGS5可以抑制卵巢癌细胞的增殖和NSCLC细胞的迁移[6,7]。此外,RGS16可通过表皮生长因子(VEGF)介导抑制乳腺癌细胞增殖[8],RGS16也与胰腺癌的淋巴结转移有关,可能是胰腺癌的重要预后指标[9]。由于R4 RGS蛋白亚家族在癌症发展中作用重要,因此加强RGS家族的功能研究可能会在癌症治疗方面产生新的突破。
RGS4是R4 RGS蛋白亚家族的重要成员,除了在中枢神经系统和心血管系统中已得到广泛研究外,RGS4在癌症中的研究也已取得一些成果。研究表明,通过GAP介导,RGS4能够显著抑制乳腺癌细胞侵袭和迁移能力,蛋白酶抑制剂MG132诱导的内源性RGS4蛋白增加有助于抑制乳腺癌细胞的侵袭和迁移[5]。同时,在NSCLC细胞中研究者们观察到类似的结果[10]。恶性黑素瘤发病率逐年上升,其恶性程度高,进展迅速,目前缺乏非常有效的治疗手段,目前对其发病机制的研究主要致力于基因表达及信号通路。因此,我们希望通过对RGS4基因的研究进一步了解恶性黑素瘤的增殖和迁移的发病机制,从而指导其治疗和预防。
本研究在恶性黑素瘤M14细胞中转染pcDNA3.1-RGS4质粒,检测RGS4在mRNA和蛋白水平的表达,结果显示,pcDNA3.1-RGS4转染后可以上调RGS4 mRNA和蛋白水平上的表达。为进一步探讨RGS4基因对恶性黑素瘤细胞增殖的影响,我们应用CCK-8和克隆形成实验,结果表明RGS4基因上调明显抑制恶性黑素瘤细胞的增殖。同时,我们运用细胞划痕实验验证RGS4基因对恶性黑素瘤细胞迁移的影响,结果显示RGS4基因高表达显著抑制恶性黑素瘤细胞的迁移。
综上所述,本研究发现,转染pcDNA3.1-RGS4能够显著促进RGS4基因在恶性黑素瘤M14细胞中的表达,并且上调RGS4基因能够明显抑制恶性黑素瘤细胞的增殖和迁移,这提示RGS4基因在恶性黑素瘤的发生、发展中起重要作用,从而为恶性黑素瘤病因学和靶向治疗研究提供新的依据。
[1] Miller AJ, Mihm MC Jr. Melanoma[J]. N Engl J Med,2006,355(1):51-65.
[2] Ross EM, Wilkie TM. GTPase-activating proteins for heterotrimeric G proteins: regulators of G protein signaling (RGS) and RGS-like proteins[J]. Annu Rev Biochem,2000,69:795-827.
[3] Cao X, Qin J, Xie Y, et al. Regulator of G-protein signaling 2 (RGS2) inhibits androgen- independent activation of androgen receptor in prostate cancer cells[J]. Oncogene,2006,25(26):3719-3734.
[4] Nishiura H, Nonaka H, Revollo IS, et al. Pro- and anti-apoptotic dual functions of the C5a receptor: involvement of regulator of G protein signaling 3 and extracellular signal-regulated kinase[J]. Lab Invest,2009,89(6):676-694.
[5] Xie Y, Wolff DW, Wei T, et al. Breast cancer migration and invasion depend on proteasome degradation of regulator of G-protein signaling 4[J]. Cancer Res,2009,69(14):5743-5751.
[6] Xu Z, Zuo Y, Wang J, et al. Overexpression of the regulator of G-protein signaling 5 reduces the survival rate and enhances the radiation response of human lung cancer cells[J]. Oncol Rep,2015,33(6):2899-2907.
[7] Altman MK, Nguyen DT, Patel SB, et al. Regulator of G-protein signaling 5 reduces heyA8 ovarian cancer cell proliferation and extends survival in a murine tumor model[J]. Biochem Res Int,2012,2012:518437.
[8] Liang G, Bansal G, Xie Z ,et al. RGS16 inhibits breast cancer cell growth by mitigating phosphatid- ylinositol 3-kinase signaling[J]. J Biol Chem,2009,284(32):21719-21727.
[9] Kim JH, Lee JY, Lee KT, et al. RGS16 and FosB underexpressed in pancreatic cancer with lymph node metastasis promote tumor progression[J]. Tumour Biol,2010,31(5):541-548.
[10] Cheng C, Yue W, Li L,et al. Regulator of G-protein signaling 4: A novel tumor suppressor with prognostic significance in non-small cell lung cancer[J]. Biochem Biophys Res Commun,2016,469(3):384-391.
Up-regulationofRGS4inhibitstheproliferationandmigrationofhumanmalignantmelanomacellsinvitro
XUEXiaotong1,2,JIAOjing3,ZHANGqianqian3,HUANGShuhong1,DANGNingning2.
1.SchoolofMedicine,ShandongUniversity,Jinan250012,China;2.DepartmentofDermatology,JinanCentralHospitalaffiliatedtoShandongUniversity,Jinan250013,China;3.DepartmentofDermatology,TheChinesePeople'sLiberationArmy88Hospital,Taian271000,China
DANGNingning,E-mail: 15318816250@163.com
Objective: To determine the influence of pcDNA3.1-RGS4 vector up-regulating RGS4 expression on the proliferation and migration of human malignant melanoma cells in vitro.MethodsThe cells were cultured in vitro, then divided into the control group (pcDNA3.1) and experimental group (pcDNA3.1- RGS4). The expression of RGS4 mRNA and protein in M14 cell was detected by RT-PCR and Western blot. The proliferation of M14 cell was detected by CCK-8 and colon formation assay. The migration of M14 cell was detected by wound healing assay.ResultsThe levels of RGS4 mRNA and protein in the experimental group were 3.25×103and 6.73 times more than that in the control group (Ps<0.05). The OD scores and clone number of M14 cells in the experimental group were 1.33±0.07 and 34±5.53, which was lower than that in the control group (1.61±0.11 and 56±7.68) (Ps<0.05). M14 cellular migration ability in the experimental group was weaker than that in the control group.ConclusionRGS4 up-regulation inhibits the M14 cell proliferation and migration in malignant melanoma. RGS4 may play an important role in the development of malignant melanoma.
GPCR; RGS4 gene; malignant melanoma; proliferation and migration
中国博士后科学基金特别资助(编号:2014M550370,2015T80740)
1山东大学齐鲁医学院,山东济南,250012 2山东大学附属济南市中心医院皮肤科,山东济南,250013 3中国人民解放军第88医院,山东泰安,271000
党宁宁,E-mail:15318816250@163.com
(收稿:2017-08-27 修回:2017-11-15)
