实验性自身免疫性甲状腺炎小鼠外周血Treg、Tfh细胞的检测分析
2017-12-27皖南医学院临床医学院微生物学与免疫学教研室安徽芜湖241002
(皖南医学院 1.临床医学院;2.微生物学与免疫学教研室,安徽 芜湖 241002)
·基础医学·
实验性自身免疫性甲状腺炎小鼠外周血Treg、Tfh细胞的检测分析
王茂林1,孙斌杰1,鲍慧文1,张 鹏1,张浩民1,陶梦颖1,汤兴丽2,刘 辉2
(皖南医学院 1.临床医学院;2.微生物学与免疫学教研室,安徽 芜湖 241002)
目的:探究Treg、Tfh细胞在小鼠实验性自身免疫性甲状腺炎(EAT)发病过程中的作用。方法将ICR雌性小鼠分为模型组和对照组。模型组以猪甲状腺球蛋白(PTg)和弗氏佐剂免疫,合并高碘刺激。酶联免疫吸附法检测小鼠血清甲状腺球蛋白抗体(TGAb)和甲状腺过氧化物酶抗体(TPOAb)水平;病理学分析小鼠甲状腺组织;流式细胞术分析小鼠外周血CD4+CD25+Foxp3+Treg和CD4+CD154+CXCR5+Tfh细胞的比例。结果模型组TGAb水平为(138.10±12.10)U/mL,高于对照组的(2.46±0.56)U/mL(P<0.05);TPOAb水平两组比较差异无统计学意义(P>0.05);病理学分析显示模型组甲状腺组织呈轻度炎症改变;模型组CD4+CD25+Foxp3+Treg细胞比例为(6.20±3.27)%,低于对照组的(11.74±3.52)%(P<0.05);CD4+CD154+CXCR5+Tfh细胞比例两组比较,差异无统计学意义(P>0.05)。结论PTg合并高碘刺激5周时间,可导致小鼠自身免疫发生,甲状腺组织轻度炎症改变;CD4+CD25+FoxP3+Treg细胞参与了早期自身免疫机制。
自身免疫性甲状腺炎;Treg细胞;Tfh细胞;流式细胞术
自身免疫性甲状腺炎(autoimmune thyroiditis,AIT)是一种由遗传、环境及免疫功能紊乱等因素综合作用而引起的自身免疫性疾病,其发病是体液免疫与细胞免疫共同作用的结果,因具体机制尚不明朗,且发病率呈逐年增高的趋势,故成为基础和临床研究热点之一。近年来,人们已认识到调节性T细胞(regulatory T cells,Treg)和滤泡辅助性T细胞(T follicular helper cells,Tfh)与自身免疫性疾病的发生、发展密切相关。其中,Treg可以介导免疫耐受,抑制炎症,是一群具有免疫负调节功能的T细胞亚群;Tfh是近年来新发现的真正辅助B细胞功能的CD4+T细胞亚群,研究证实,其能辅助B细胞产生抗体,发挥体液免疫作用[1]。本实验采用猪甲状腺球蛋白(porcine thyroglobulin,PTg)和弗氏佐剂免疫,合并高碘刺激ICR雌性小鼠,为期5周的时间,建立小鼠实验性自身免疫性甲状腺炎(experimental autoimmune thyroiditis,EAT)早期炎症模型,应用流式细胞术分析EAT小鼠外周血中Treg细胞和Tfh细胞比例变化,并探究这两种细胞在EAT发病早期阶段自身免疫机制中的意义。
1 材料与方法
1.1 动物 SPF级ICR雌性小鼠20只;体质量(25±2)g,购自常州卡文斯实验动物有限公司。
1.2 主要试剂 猪甲状腺球蛋白(PTg)、完全弗氏佐剂(CFA)与不完全弗氏佐剂(IFA),均为sigma公司产品;小鼠抗甲状腺球蛋白抗体ELISA试剂盒与小鼠抗甲状腺过氧化物酶抗体ELISA试剂盒,分别购自武汉华美生物工程有限公司和上海江莱生物科技有限公司;碘化钠购自北京华迈科生物技术有限责任公司。红细胞裂解液、荧光标记抗体(CD4-FITC、CD25-APC、Foxp3-PE、CD154-PE和CXCR5-PerCP-cy5.5)、固定/破核膜试剂盒均为BD公司产品。
1.3 主要仪器 Bio Tek全波长酶标仪(型号:Von)、BD流式细胞仪(型号:Accuri C6)、BECKMAN高速冷冻离心机(型号:Allegra X-15R)、高压蒸汽灭菌锅、电子天平。
1.4 方法
1.4.1 分组 所有小鼠适应性饲养1周后,随机分为两组,即模型组与正常对照组。
1.4.2 模型建立 用PBS将PTg充分溶解,采用双注射器乳化法将抗原溶液与等体积弗氏佐剂充分乳化后对模型组小鼠行皮下注射(50 μg/只),每周1次,连续5周[2](其中第1、2周采用CFA乳化抗原,第3、4、5周采用IFA乳化抗原,注射部位依次为颈部皮下、背部皮下、颈部皮下、背部皮下、腹腔);对照组则每次于相同部位注射等剂量生理盐水。建模期间,模型组饮用高碘水(配置方法为0.64 g碘化钠溶于1 L自来水[3],避光储存,避光给饮),正常对照组饮用自来水。所有小鼠均于第6周行眼球采血后颈椎脱臼处死,迅速开腹分离出脾脏并称重。所采血液一部分用于流式细胞术分析细胞,一部分分离血清用于检测甲状腺自身抗体。
1.4.3 甲状腺自身抗体的检测 小鼠采血后分离血清,采用酶联免疫吸附法检测小鼠甲状腺球蛋白抗体(thyroglobulin antibody,TGAb)和小鼠甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)水平。
1.4.4 甲状腺组织病理学检查 小鼠采血后颈椎脱臼处死,解剖分离附有甲状腺组织的气管节段,立即固定于10%中性福尔马林中,后经石蜡包埋、切片、HE染色,显微镜下观察甲状腺组织病理变化。
1.4.5 CD4+CD154+CXCR5+Tfh细胞比例检测 小鼠新鲜抗凝血取100 μL于各管中经裂解红细胞处理后(注意红细胞裂解液与血液充分混匀),除空白管外,其余各管细胞表面依次用荧光抗体CD4-FITC、CD154-PE、CXCR5-PerCP-cy5.5进行荧光染色(注意加入荧光抗体时避免交叉污染和沾在管壁),涡旋振荡,4℃孵育30 min(注意避光,以免造成荧光淬灭)。用PBS 1 mL洗涤两遍后,每管加入PBS300 μL重悬细胞,立即上机检测。
1.4.6 CD4+CD25+Foxp3+Treg细胞比例检测 处理方法与注意事项同Tfh检测,细胞表面抗原依次用CD4-FITC与CD25-APC荧光染色,涡旋振荡,4℃避光孵育30 min,PBS洗涤,弃上清,加入1 mL新鲜配制的1×Fix/Permbuffer,涡旋振荡后避光孵育50 min,再加入1×Perm/Wash buffer 1 mL洗涤两次,弃上清。经破膜处理后,用荧光抗体Foxp3-PE进行胞内染色,涡旋振荡,4℃避光孵育50 min,再加入1×Perm/Wash buffer 2 mL,4℃,350 g,离心6 min后弃上清,每管加入PBS 300 μL重悬细胞,立即上机检测。
使用流式细胞仪C6检测,检测前用BD公司提供的质控微球进行设置和调节。预先设置空白管、补偿管、同型对照管、样本管。先用空白管在FSC/SSC散点图上圈门(圈淋巴细胞区域设门,注意将分析细胞设在门内,尽量减少碎片掺入,保证足够的细胞数量)。随后以CD4-FITC、CD154-PE和CXCR5-PerCP-cy5.5补偿管(检测Treg时为CD4-FITC、CD25-APC和Foxp3-PE补偿管)进行补偿调节,最后测定样本管,分析CD4+CD154+CXCR5+Tfh和CD4+CD25+Foxp3+Treg细胞分别占CD4+T细胞的百分比。
2 结果
2.1 一般状况 建模前所有小鼠饮食、活动均正常,皮毛光滑。建模第4周,模型组小鼠免疫部位出现红肿硬结,免疫部位周边毛发油亮不整,个别小鼠硬结轻微破溃、渗血,小鼠有舔舐现象;正常对照组小鼠则为正常。建模第6周,与对照组相比,模型组小鼠体质量减轻,饮食、活动减少,皮毛欠光滑,脾脏增大增重。
2.2 小鼠血清TGAb和TPOAb水平分析 结果显示,模型组小鼠TGAb水平高于对照组,差异有统计学意义(P< 0.05);而模型组小鼠TPOAb水平与对照组差异无统计学意义(P> 0.05)。见表1。

表1 两组小鼠血清TGAb和TPOAb水平 U/mL
2.3 甲状腺组织病理学检查 正常对照组小鼠甲状腺组织结构正常,甲状腺滤泡上皮细胞排列较为整齐疏松,细胞呈扁平状。与正常对照组相比,模型组小鼠甲状腺滤泡部分萎缩,胶质减少;滤泡上皮细胞增生,排列较为紧密,细胞轻微肿胀呈低柱状;个别滤泡上皮细胞成簇排列为微滤泡结构,可见部分细胞核增大;淋巴细胞浸润不明显。见图1 。
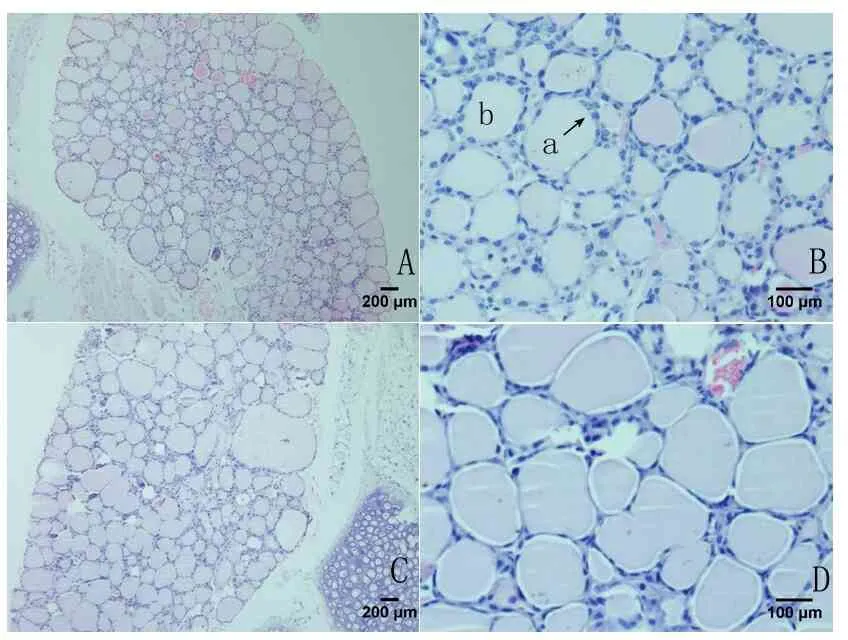
A.模型组(×100);B.模型组(×400),a:滤泡上皮细胞,b:滤泡腔;C.对照组(×100);D.对照组(×400)。
图1 小鼠甲状腺组织病理图
2.4 小鼠外周血Treg和Tfh细胞的比例分析 小鼠外周血CD4+CD25+Foxp3+Treg和CD4+CD154+CXCR5+Tfh流式细胞术检测结果如图2所示,分析结果发现,模型组CD4+CD25+Foxp3+Treg占CD4+T细胞比例(%)低于对照组,差异有统计学意义(P<0.05); 但模型组CD4+CD154+CXCR5+Tfh占CD4+T细胞比例(%)与对照组相比,差异无统计学意义(P>0.05)。见表2。
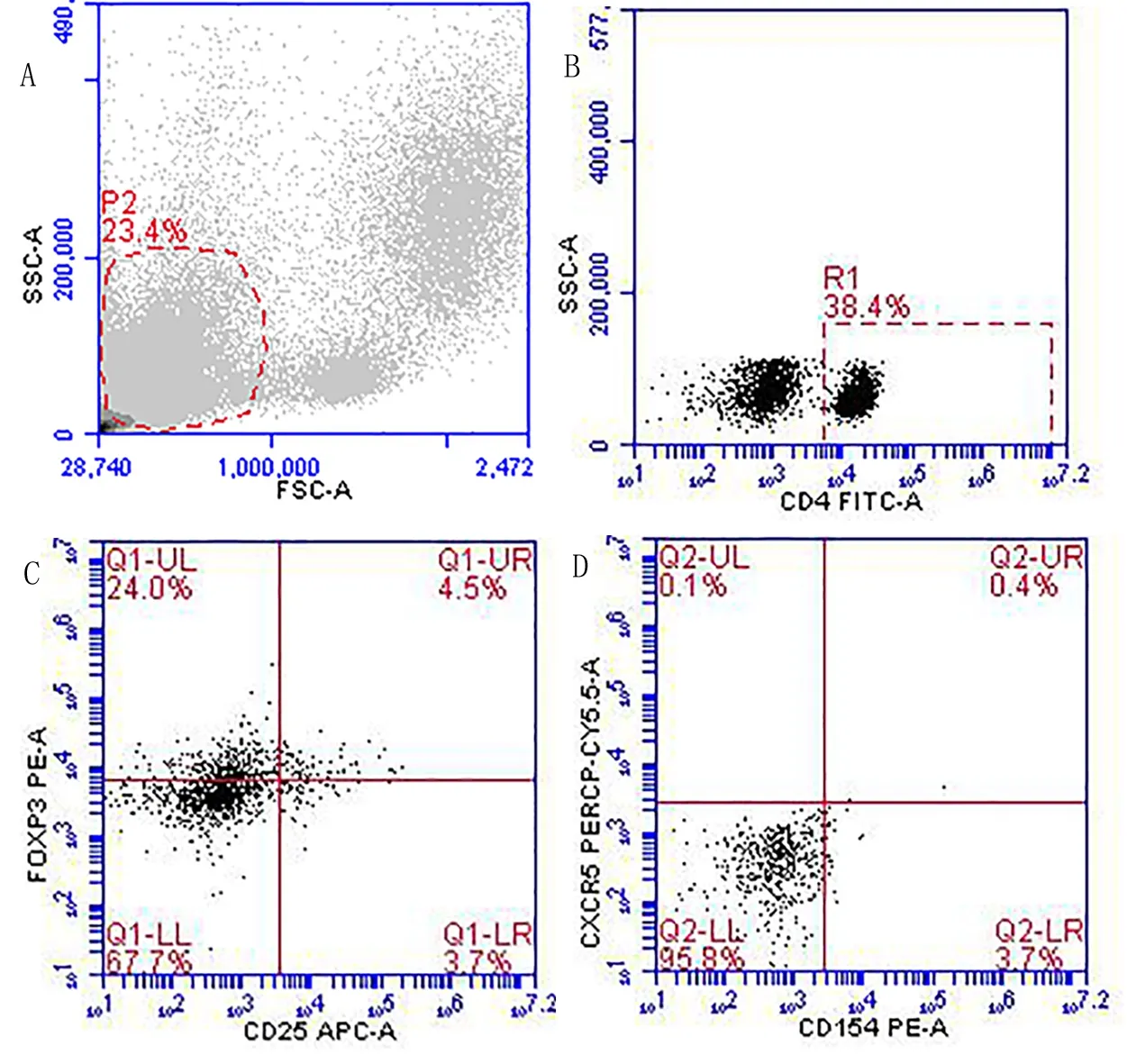
A.淋巴细胞区域设门;B.模型组小鼠CD4+T细胞比例;C. 模型组小鼠Treg比例;D.模型组小鼠Tfh比例。
图2 小鼠外周血Treg和Tfh细胞流式图
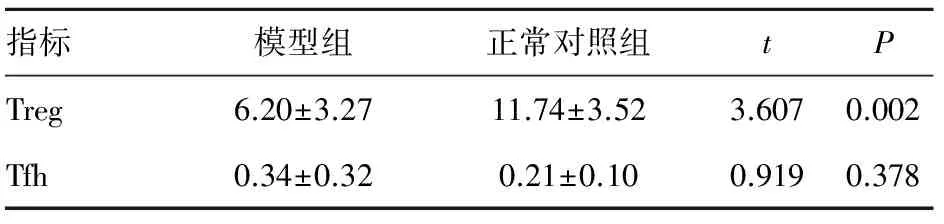
表2 两组小鼠外周血Treg和Tfh细胞的比例 %
3 讨论
3.1 实验性自身免疫性甲状腺炎早期炎症模型建立 EAT动物模型建立是研究AIT较好的手段。利用TG、TPO或TSHR等甲状腺自身抗原成分单独或加用CFA等佐剂来免疫动物是公认的经典造模方法[4]。此外,大量的碘摄入可增加碘与Tg的结合,产生碘化Tg,其可加重Tg免疫诱发的自身免疫性甲状腺炎[5]。袁继红等[6]通过设置对照组、高碘组、TG免疫组和联合组对BALB/c小鼠进行为期8周的EAT模型的建立,结果显示:高碘组甲状腺组织少见淋巴细胞;TG免疫组可见单个散在淋巴细胞;联合组可见甲状腺滤泡结构破坏及局部淋巴细胞浸润。另有研究表明[7],给予小鼠8周的高碘刺激,小鼠血清TGAb水平升高伴甲状腺组织呈现不同程度的淋巴细胞浸润。上述建模方法经过8周时间的免疫和刺激,均发生了自身免疫炎症,甲状腺组织有不同程度的淋巴细胞浸润。而更多的研究证实8周以上的建模周期可出现较为典型的EAT表现。
本实验旨在分析EAT发病早期阶段小鼠的相关指标变化,叶登美等[2]研究发现,为期5周的EAT模型建立显示小鼠出现了自身免疫现象。故我们选择连续5周给予PTg和弗氏佐剂免疫合并高碘刺激ICR雌性小鼠,观察小鼠甲状腺组织的病理学变化,结果显示:正常对照组甲状腺组织结构正常,甲状腺滤泡上皮细胞排列较为整齐疏松,细胞呈扁平状;模型组甲状腺滤泡有部分萎缩,胶质减少;滤泡上皮细胞增生,形态呈低柱状,可见部分细胞核增大,细胞成簇排列为微滤泡结构,间质未出现明显的淋巴细胞浸润。自身抗体检测,模型组小鼠血清TGAb较对照组升高,TPOAb水平无明显变化。另外发现,模型组小鼠脾脏增大增重。分析上述结果,模型组小鼠血清TGAb水平升高、脾脏增大,说明自身免疫已经发生;模型组甲状腺滤泡上皮细胞由扁平变为低柱状,细胞核增大,可能是细胞在炎症因子刺激下异常表达MHC-Ⅱ类分子而呈“激活”状态所致[8];甲状腺滤泡上皮细胞增生,滤泡有部分萎缩,胶质减少,是甲状腺呈代偿性功能活跃的表现,这些均提示甲状腺已经有轻度炎症改变。但甲状腺间质尚未出现明显的淋巴细胞浸润,TPOAb水平也未见升高,提示为期5周的PTg免疫合并高碘刺激,小鼠尚未达典型炎症状态,只是处于自身免疫炎症的早期阶段。本结果中TGAb升高而TPOAb未见变化,与自身免疫早期状态吻合,因为早期的免疫反应常针对单个决定簇, 随后扩散到同一靶组织的其他蛋白质分子, 称为分子间扩散。TG 和TPO 均可引起甲状腺组织抗原决定簇的扩散, 从而产生其他甲状腺抗体[4,9]。在TG引起的免疫反应尚未扩散至甲状腺组织TPO等其他蛋白质分子时,只产生TGAb,还未来得及产生TPOAb的状态是存在的。
本结果揭示了在造模5周时间后即可出现小鼠EAT早期轻度炎症变化,并且小鼠已经发生了自身免疫。提示实验性自身免疫性甲状腺炎早期炎症模型建立成功。
3.2 自身免疫性甲状腺炎发病早期小鼠外周血Treg和Tfh细胞分析 CD4+CD25+Treg是具有免疫抑制功能的T细胞亚群。Foxp3是维持 Treg发育和功能的关键转录因子,其表达有赖于转化生长因子-β的存在[10]。研究表明,CD4+CD25+T细胞可通过免疫负调节作用抑制自身反应性T细胞的活化增殖而维持免疫稳态[11-12]。本结果中,在小鼠自身免疫性甲状腺炎早期阶段,与对照组相比,模型组外周血CD4+CD25+Foxp3+Treg占CD4+T细胞的比例明显降低,提示CD4+CD25+Foxp3+Treg的免疫负调节作用已经参与了EAT发病早期自身免疫机制。CD4+CD25+Foxp3+Treg细胞主要通过分泌TGF-β等抑制性细胞因子以及表达的CTLA-4等抑制性受体而发挥免疫抑制作用,其数量和功能的低下导致对自身免疫反应性细胞功能的抑制作用也下降,自身免疫损伤也就难以控制。已知树突状细胞所分泌的IL-10/TGF-β可诱导Treg细胞产生,许多研究已经证实在自身免疫性疾病患者和相关动物模型中,均存在髓系树突状细胞功能缺陷,这会导致CD4+CD25+Foxp3+Treg数量和功能异常[13]。本结果中Treg细胞的减少是否也与树突状细胞功能缺陷有关呢?这需要进一步研究。
近年来,辅助T细胞另一新成员Tfh被证实在许多自身免疫性疾病中发挥作用[14-15]。因其主要位于淋巴滤泡,能辅助B细胞产生抗体、介导体液免疫,且表型为CXCR5+CD154+ICOS+,不同于Th1和Th2,故命名为Tfh[16]。CXCR5分子表达于所有成熟B细胞和识别抗原后的部分CD4+T细胞上,它是Tfh细胞迁移到外周淋巴器官B细胞区的关键的“运输分子”[17]。CD154分子与其在B细胞表面的受体CD40结合对介导B细胞的活化有重要作用。
Tfh细胞在CXCR5配体CXCL13的趋化吸引下定位于B细胞淋巴滤泡来直接辅助B细胞,进而参与调节效应性和记忆性B细胞的形成以及特异性抗体产生的过程[18]。本实验结果表明,模型组小鼠外周血CD4+CXCR5+CD154+Tfh占CD4+T细胞比例与对照组相比差异无统计学意义。虽然有研究表明Tfh参与了某些自身免疫疾病的发生,但本结果提示EAT早期自身免疫炎症阶段,Tfh细胞未见明显变化。可能是因为辅助体液免疫的细胞有多种如Tfh、Th2等,而Tfh细胞是B细胞在淋巴滤泡内应答的辅助细胞,在生发中心形成后发挥作用,主要通过分泌IL-21等机制辅助B细胞产生抗体类别转换等事件,发挥作用比较迟[19]。我们推测Tfh细胞只在炎症后期参与辅助B细胞应答,所以在本实验的炎症早期,Tfh细胞未见明显变化,这也可能是此时TPOAb水平未见升高的一个原因。Tfh细胞参与EAT发生、发展的机制还有待进一步研究。
(致谢:本实验得到皖南医学院微生物学与免疫学教研室的大力支持,同时,得到皖南医学院第二附属医院病理科曹晓智老师和皖南医学院基础医学院陆晓华、陈京、吴敏等多位老师的悉心指导,在此一并感谢!)
【参考文献】
[1] 杨学超,石云,邹全明.滤泡辅助T细胞的研究进展[J].重庆医学,2011,40 (23):2376-2379.
[2] 王萍,叶登美,窦德宇,等.白芍总苷对EAT小鼠Th1/Th2型细胞因子表达的影响[J].中国临床药理学与治疗学,2016,21(8):894-898.
[3] 孙葳,宋光华,贺斌.碘和甲状腺球蛋白诱导大鼠实验性自身免疫性甲状腺炎的研究[J].中华内科杂志,2000,39(12):841-842.
[4] 唐伟,贾悦.实验性自身免疫性甲状腺炎动物模型的建立[J].国外医学免疫学分册,2003,26(4):211-214.
[5] 李磊,郭晖.促甲状腺激素受体抗体与自身免疫性甲状腺疾病[J].中国地方病学杂志,2012,31(1):115-118.
[6] 袁继红,周晓丽,史亚男,等.促甲状腺激素β剪接体在自身免疫性甲状腺炎小鼠甲状腺中的表达[J].中华地方病学杂志,2014,33(3):254-257.
[7] 杨榕,范晨玲,毕美,等.溴氯哌喹酮干预对NOD.H-2h4 小鼠自身免疫甲状腺炎发病的影响及机制研究[J].中华内分泌代谢杂志,2014,30(11):999-1002.
[8] 龚非力.医学免疫学[M].4版.北京:科学出版社,2014:109.
[9] 邓莉,孙文,侯毅,等.自身免疫性甲状腺炎实验动物模型的研究进展[J].天津中医药,2016,33(3):189-192.
[10] 薛海波,马蕾,李元宾,等.Treg/Th17细胞轴与桥本甲状腺炎自身免疫的相关性[J].中国现代医学杂志,2012,22(23):67-71.
[11] 江强,苏占涛.自身免疫性甲状腺炎大鼠CD4+CD25+调节性T细胞变化及意义[J].医学检验与临床,2010,21(2):59-61.
[12] 张恒辉,郭芳,费然,等.慢性乙型肝炎患者CD4+CD25+调节性T细胞免疫抑制功能的研究[J].中华医学杂志,2008,88(8):511-515.
[13] 龚非力.医学免疫学[M].4版.北京:科学出版社,2014:114.
[14] XIAO N,ETO D,ELLY C,etal.The E3 ubiquitin ligase ltch is required for the differentiation of follicular helper T Cells[J].Nat Immunol,2014,15(7):657-666.
[15] 唐凌雯,李作孝.滤泡辅助性T细胞及在自身免疫性疾病发病中所起作用的研究进展[J].中国医刊,2014,49(1):28-30.
[16] VINUESA CG,TANGYE SG,MOSER B,etal.Follicular B helper T cells in antibody responses and autoimmunity[J].Nat Rev Immunol,2005,5:853-865.
[17] LINTERMAN MA,VINUESA CG.Signals that influence T follicular helper cell differentiation and function[J].Semin Immunopathol,2010,32(2):183-196.
[18] TANGYE SG,MA CS,BRINK R,etal,The good,the bad and the ugly-TFH cells in human health and disease[J].Nat Rev Immunol,2013,13(6):412-426.
[19] 龚非力.医学免疫学[M].4版.北京:科学出版社,2014:205-206.
DetectionoftheTregandTfhcellsintheperipheralbloodinexperimentalautoimmunethyroiditismice
WANGMaolin,SUNBinjie,BAOHuiwen,ZHANGPeng,ZHANGHaomin,TAOMengying,TANGXingli,LIUHui
School of Clinical Medicine, Wannan Medical College, Wuhu 241002, China
Objective:To investigate the function of Treg and Tfh cells in the pathogenetic process in experimental autoimmune thyroiditis in mice.Methods: ICR female mice were divided into model group and normal control group. Mice in the model group were immunized with porcine thyroglobulin(PTg) and Freund′s adjuvant combined with high iodine stimulation, and sacrificed at the 6th week. Enzyme-linked immunosorbent assay (ELISA) was performed to detect the thyroglobulin antibody (TGAb) and thyroid peroxidase antibody(TPOAb) levels, and thyroid tissues obtained from the mice were pathologically examined. Flow cytometry was used to determine the percentages of CD4+CD25+Foxp3+Treg and CD4+CD154+CXCR5+Tfh cells in peripheral blood from experimental mince.Results: Mice in the model group had higher TGAb level than those in the control group[(138.10±12.10)U/mLvs. (2.46±0.56)U/mL,P<0.05)], yet the TPOAb level remained no significant difference between groups (P> 0.05).Pathological examination showed minor inflammation in the thyroid tissues. Percentage of circulating CD4+CD25+Foxp3+Treg cells was significantly higher in the model group than the control group[(6.20±3.27)%vs. (11.74±3.52)%,P<0.05)], whereas the two groups had no significant difference regarding CD4+CD154+CXCR5+Tfh cells (P> 0.05).Conclusion: PTg combined with high iodine stimulation for five weeks may lead to autoimmune in mice, when mild inflammation occurs in the thyroid tissues. CD4+CD25+Foxp3+Treg cells may be associated with autoimmune response in early stage.
autoimmune thyroiditis; Treg cells; Tfh cells; flow cytometry
1002-0217(2017)06-0521-05
国家级大学生创新创业训练计划项目(201510368007)
2017-05-11
王茂林(1995-),男,2013级临床医学专业本科生,(电话)18375338724,(电子信箱)1240874877@qq.com;
刘 辉,女,副教授,(电子信箱)hegenlh@sina.com,通信作者。
R 581.4;R 392.1
A
10.3969/j.issn.1002-0217.2017.06.003
