华蟾酥毒基对U2OS细胞增殖和凋亡的影响△
2017-12-26余铃郭卫春代国
余铃,郭卫春,代国
(武汉大学 人民医院 骨科,湖北 武汉 430060)
·基础研究·
华蟾酥毒基对U2OS细胞增殖和凋亡的影响△
余铃,郭卫春,代国*
(武汉大学 人民医院 骨科,湖北 武汉 430060)
目的观察华蟾酥毒基对人骨肉瘤细胞系U2OS增殖和凋亡的影响,从而探讨华蟾酥毒基诱导骨肉瘤凋亡的可能机制。方法体外培养人骨肉瘤细胞系U2OS,CCK-8法检测不同浓度华蟾酥毒基对骨肉瘤细胞系U2OS增殖的抑制作用,Annexin V-FITC/PI 染色,流式细胞术检测细胞凋亡,Hoechst 33258 染色,显微镜下观察细胞凋亡的形态学变化,应用逆转录荧光定量PCR法检测华蟾酥毒基对凋亡通路相关mRNA表达的影响。结果CCK-8检测显示华蟾酥毒基可抑制人骨肉瘤U2OS细胞增殖,并具有时间和剂量依赖性,在华蟾酥毒基浓度为20 nmol·L-1时,对细胞增殖的抑制作用明显增强;流式细胞术检测显示华蟾酥毒基可明显诱导骨肉瘤细胞凋亡;Hoechst 33258 染色可见凋亡小体;逆转录荧光定量PCR分析显示经华蟾酥毒基处理后的骨肉瘤细胞系U2OS表达Caspase-3,8,9较用药前明显增高。结论华蟾酥毒基对骨肉瘤细胞系U2OS的增殖有显著抑制作用,并可诱导其发生凋亡,其作用机制可能与激活Caspase依赖的凋亡途径有关。
华蟾酥毒基;骨肉瘤;细胞增殖;细胞凋亡
骨肉瘤是最常见的骨的原发性恶性肿瘤,好发于儿童和青少年,主要发生于长骨远端,目前主要的治疗方法是行新辅助化疗后,再手术切除。得益于此治疗方案,使得骨肉瘤患者的5年生存率提高到了60%[1-2]。诱导肿瘤细胞发生凋亡是治疗的一个重要目标,近年来,许多学者把目光放在寻找新的药物上,以寻求更好的治疗效果。
华蟾素是中华大蟾蜍全皮经过水化萃取而制成的中药制剂,具有清热解毒、利水消肿、化瘀溃坚等作用,其化学成分复杂,包括吲哚生物碱、还原糖、氨基酸以及蟾蜍毒素、蟾蜍色胺等。华蟾素具有低毒、抗癌谱广等诸多优点,目前已成为我国临床上应用较广的抗肿瘤中药制剂之一[3-4]。华蟾酥毒基(cinobufagin,CB)作为华蟾素中提取的主要毒性配基之一,亦具有良好的抗肿瘤作用。先前有许多研究证实华蟾素可以通过抑制肿瘤细胞增殖诱导其凋亡来发挥抗肿瘤作用。研究发现其对肝癌、乳腺癌、小细胞肺癌、结肠癌、前列腺癌等多种恶性肿瘤具有良好的抗癌功效[5-8]。但将华蟾酥毒基应用于骨肉瘤的研究并不多见。本实验探讨了华蟾酥毒基对人骨肉瘤U2OS细胞的增殖抑制和诱导凋亡的作用,并检测了其对凋亡相关mRNA表达的调控,为进一步明确华蟾酥毒基的抗肿瘤机制提供理论依据。
1 材料
DMEM培养基、新鲜小牛血清(Hyclone公司);华蟾酥毒基(美国Sigma公司),用二甲基亚砜(DMSO)溶解配制成0.01 mol·L-1的储备液分装备用,使用时用无血清DMEM培养基稀释到所需浓度,DMSO的含量小于1‰;Cell Counting Kit-8(CCK-8,日本同仁化学研究所);Annexin V-FITC/PI细胞凋亡检测试剂盒(南京凯基生物科技有限公司);DMSO、Hoechst 33258及胰蛋白酶(美国Sigma公司);TRIzol试剂(美国Invitrogen Life Technologies公司);RevertAid第一链cDNA合成试剂盒(美国Thermo Fisher Scientific公司);2X SYBR绿色荧光染料反应混合液(美国Ambino公司)。Caspase-3,8,9引物由上海生工生物工程股份有限公司合成。
2 方法
2.1 细胞培养
用含10%胎牛血清、100 U·mL-1青霉素、100 μg·mL-1链霉素的DMEM培养液在37 ℃、饱和湿度、5% CO2培养箱中常规培养,每24 h换液,用0.25%含EDTA胰酶消化液隔天消化、传代,取对数生长期的细胞进行后续实验。
2.2 CCK-8法检测华蟾酥毒基对U2OS细胞增殖的影响
取对数生长期的细胞,制成1×105·mL-1的细胞悬液,接种于96孔板,每孔100 μL,培养24 h待其贴壁后加入终浓度分别为20、50、100、150、200 nmol·L-1的华蟾酥毒基,阴性对照组加等体积的DMEM培养液处理(每个浓度设5个复孔),每个浓度处理24、48、72 h后,加入CCK-8 10 μL 培养1 h,酶标仪450 nm波长下检测各孔吸光度(A)值,实验重复3次。按公式(1)计算细胞存活率。
细胞存活率=(A给药组-A空白组)/(A阴性对照组-A空白组)×100%
(1)
2.3 Annexin V-FITC/PI双染结合流式细胞术检测华蟾酥毒基对U2OS细胞凋亡的影响
收集处于对数生长期的骨肉瘤U2OS细胞,制备单细胞悬液,计数后调整细胞密度为2×105·mL-1,按2 mL/孔接种于6孔板,37 ℃、5% CO2、饱和湿度培养箱中常规培养24 h,待细胞完全贴壁后吸弃原培养液,加入终浓度分别为20、50、100 nmol·L-1的华蟾酥毒基的新鲜DMEM培养液,同时设立空白对照组。药物作用48 h后,各组重复3次,经胰酶消化,收集细胞于流式管内,1500 r·min-1、4 ℃离心5 min,弃上清液,4 ℃预冷的磷酸缓冲液(PBS)洗涤细胞1次,用稀释好的结合缓冲液[结合缓冲液-去离子水(1∶10)]500 μL重悬细胞。每管依次加Annexin V-FITC 5 μL,再加入5 μL PI染色液,轻轻混匀,室温下避光孵育5 min,上流式细胞仪进行细胞凋亡检测。以Annexin V为横坐标,PI为纵坐标,左上象限代表坏死细胞碎片,左下象限代表活细胞(Annexin V和PI双阴性)、右下象限代表凋亡早期(Annexin V阳性,PI阴性)、右上象限代表凋亡晚期(Annexin V和PI双阳性)。
2.4 Hoechst 33258 检测细胞凋亡
选取对数生长期的U2OS细胞接种于6孔板,采用经CCK-8和流式检测作用较明显的20、50 nmol·L-1的华蟾酥毒基分别作用,含等体积DMSO的DMEM培养基作为对照。收集作用后48 h的细胞,PBS洗2次,用75%的乙醇水4 ℃固定5 min,PBS冲洗,Hoechst 33258 染色10 min 后置于荧光显微镜下观察。
2.5 实时荧光定量PCR分析细胞Caspase mRNA表达的变化
收集不同浓度华蟾酥毒基作用48 h后的U2OS细胞约1×107个,应用TRIzol法提取细胞总RNA,紫外分光光度计检测总RNA含量。使用RevertAid第一链cDNA合成试剂盒合成cDNA。cDNA(5 μL;1∶100)被添加到12.5 μL的2X SYBR绿色荧光染料反应混合液,使得总体积为25 μL,以GAPDH为内参,通过观察扩增曲线来测量Caspase-3、Caspase-8、Caspase-9的CT值(扩增曲线达到阈值时的循环圈数)。数据处理采用相对定量中的2-ΔΔCt计算结果来表示各个基因表达的水平,最后取3次重复实验平均值作为最终结果,具体引物见表1。

表1 引物信息表
2.6 统计学分析

3 结果
3.1 华蟾酥毒基对骨肉瘤U2OS细胞增殖的影响
CCK-8检测发现,用不同浓度华蟾酥毒基处理后,在24~72 h内U2OS细胞生长增殖均受到明显抑制(与对照组相比,P<0.05或P<0.01),并且抑制作用呈剂量依赖性,在浓度为20 nmol·L-1时即出现抑制细胞增殖的作用,在一定范围内随着华蟾酥毒基剂量的增加和作用时间的延长抑制效果增加,各个剂量及作用时间对U2OS细胞增殖的抑制作用均有统计学差异,见图1。
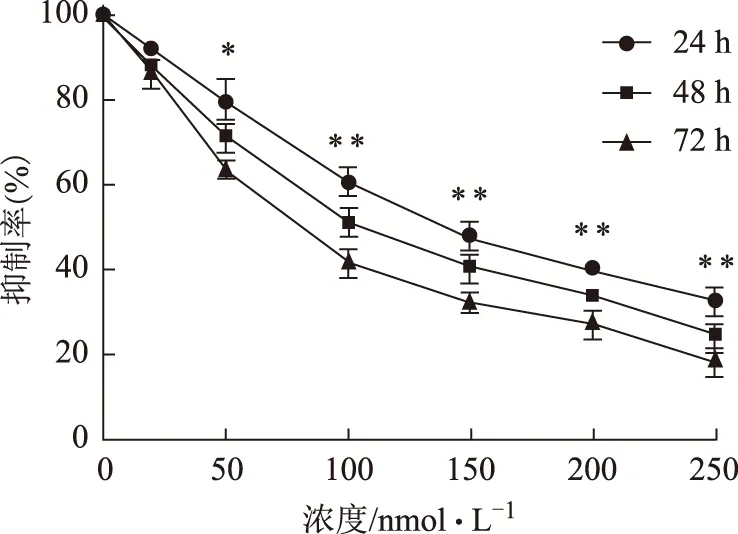
注:与对照组比较,*P<0.05,**P<0.01;下同。图1 CCK-8法检测华蟾酥毒基对骨肉瘤U2OS细胞的抑制作用
3.2 华蟾酥毒基对骨肉瘤U2OS细胞凋亡的影响
通过Annexin V-FITC和PI双染标记法检测,结果显示,随着华蟾酥毒基浓度的增加,凋亡率逐渐升高,华蟾酥毒基50、100、200 nmol·L-1组处理48 h时,其凋亡率分别为(25.4±1.3)%、(52.7±0.8)%、(65.9±2.8)%,与空白对照组(2.1±0.3)%比较,差异均具有统计学意义(P<0.01),见图2。
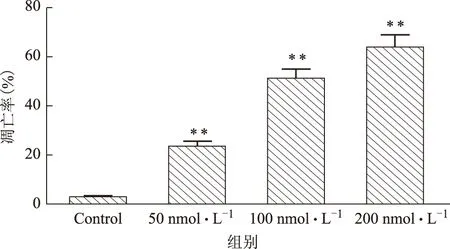
图2 流式细胞术检测不同浓度华蟾酥毒基对骨肉瘤U2OS细胞的凋亡率
3.3 Hoechst 33258 荧光染色法观察细胞形态学改变
荧光显微镜下对照组人骨肉瘤U2OS细胞核完整,着色均匀,荧光呈弥散状,比较黯淡(见图3)。华蟾酥毒基(20、50 nmol·L-1)处理48 h 后组细胞染色质凝聚,细胞核裂解,着色不规则,部分浓聚,呈现出细胞凋亡的典型变化即核碎裂,产生凋亡小体(见图3)。

图3 Hoechst 33258 荧光染色法显示不同浓度华蟾酥毒基处理后细胞形态学的改变
3.4 华蟾酥毒基对骨肉瘤细胞Caspase依赖的凋亡通路相关mRNA表达的影响
不同浓度的华蟾酥毒基作用于U2OS细胞48 h后,应用RT-PCR法检测Caspase依赖的凋亡信号通路相关mRNA Caspase-3、Caspase-8和Caspase-9的表达情况。结果显示,20、50、100 nmol·L-1的华蟾酥毒基均能够提高Caspase-3、Caspase-8、Caspase-9 mRNA的表达水平,且随着浓度的增加,促凋亡mRNA的表达量不断增高,见图4。
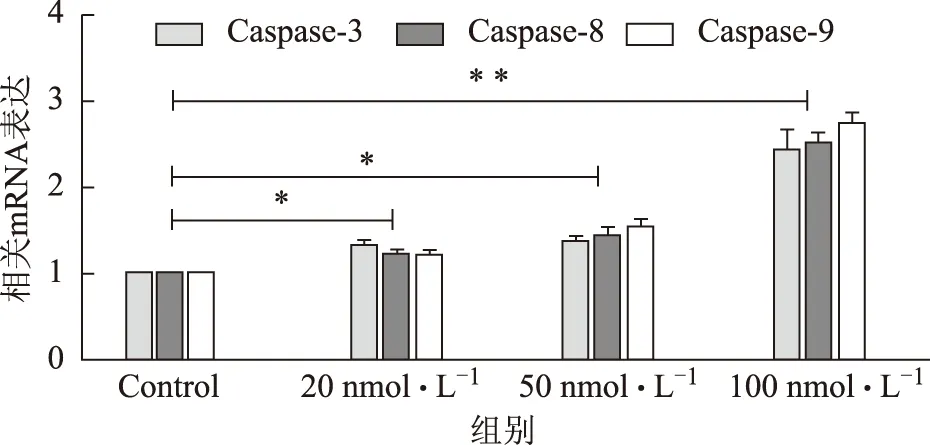
图4 不同浓度华蟾酥毒基对骨肉瘤细胞Caspase依赖的凋亡通路相关mRNA的表达
4 讨论
尽管早期手术治疗结合新辅助化疗已很大程度提高骨肉瘤患者的5年生存率(60%~70%),但目前仍有20%~40%的患者死于骨肉瘤的远处转移。如何延缓其生长及转移,进一步提高其治疗效果仍然是目前骨肉瘤治疗的难题之一[9-12]。传统化疗药因其毒副作用高和耐药性等原因,常导致化疗失败。因此寻找一种具有高抗肿瘤活性的新型药物,能够协助或者替代传统化疗药物促进骨肉瘤细胞的凋亡,以减少传统化疗药物的使用时间和使用剂量,降低其毒副作用或逆转耐药性的发生,从而提高骨肉瘤患者的耐受性和长期生存率是目前骨肉瘤的研究热点之一[13-14]。现代研究发现,中药蟾皮或蟾酥的主要成分华蟾酥毒基是一种甾体类,具有较强的抗肿瘤活性而得到广泛的关注。华蟾素作为抗肿瘤中药制剂,在肿瘤治疗方面应用很广,对肝癌、胃癌、肺癌、乳腺癌、骨肉瘤等多种肿瘤都有一定的治疗作用[8,15-17]。此外,相关毒理研究还证实其具有副作用小、使用安全的特点。目前认为华蟾酥毒基主要通过线粒体或Fas/FasL介导的凋亡通路、上调Caspases蛋白酶诱导凋亡、抑制Notch信号通路、诱导细胞周期阻滞、调节凋亡抑制基因的表达等多种机制诱导肿瘤细胞凋亡而对肿瘤起到治疗作用[3,18-22]。
在本实验中,采用不同浓度的华蟾酥毒基体外作用于人骨肉瘤系U2OS,通过CCK-8法检测细胞增殖,发现不同浓度华蟾酥毒基可以抑制骨肉瘤细胞的增殖,且其存活率与华蟾酥毒基的浓度和作用时间均有关,当华蟾酥毒基浓度为20 nmol·L-1,作用时间48 h时抑制作用明显增强,与对照组相比,差异有统计学意义(P<0.05,见图1)。本研究与国外其他学者研究结果相似[21],提示华蟾酥毒基可以抑制骨肉瘤细胞的增殖,对骨肉瘤细胞起到杀伤作用。
凋亡在肿瘤治疗中起着重要作用,凋亡与肿瘤的发生、发展有很大关系,诱导肿瘤细胞凋亡,对肿瘤治疗有重要意义,许多抗癌药物都是通过诱导凋亡而发挥杀伤癌细胞的作用。本文流式分析结果显示,华蟾酥毒基在体外试验中诱导人骨肉瘤U2OS细胞发生凋亡,且其凋亡率随着华蟾酥毒基浓度的增加而增加(见图2)。Hoechst 33258 可透过细胞膜并对DNA染色而发出明显而强烈的蓝色荧光,常常用来进行凋亡细胞的形态学检测的研究。本文通过荧光显微镜下观察显示20、50 nmol·L-1的华蟾酥毒基处理后可诱导骨肉瘤U2OS细胞发生凋亡,细胞出现核固缩、碎裂,以及凋亡小体。以上这些结果都说明,华蟾酥毒基可以诱导骨肉瘤细胞发生凋亡。
研究发现,细胞凋亡机制失调是恶性肿瘤发生、发展的机制之一[23],在细胞凋亡的执行过程中,天冬氨酸特异的半胱氨酸蛋白酶(Caspase)家族起着非常重要的作用,这种凋亡方式称为Caspase依赖的细胞凋亡。Caspase家族包含多个成员,在细胞凋亡过程中起着非常关键的作用。正常情况下Caspase以无活性的酶原形式存在,在促凋亡因素的作用下级联激活而触发凋亡。本文检测不同浓度华蟾酥毒基对Caspase-3、8、9 mRNA表达的影响,从图4的结果中可以看到U2OS细胞中Caspase-3、8、9 mRNA的表达在加入华蟾酥毒基处理后均有不同程度明显增高,提示华蟾酥毒基诱导的U2OS细胞凋亡与Caspase级联活化有关,并可能同时涉及线粒体通路和死亡受体通路。
综上,华蟾酥毒基具有抑制骨肉瘤U2OS细胞增殖并诱导细胞凋亡的作用,其效应呈时间和浓度依赖性。华蟾酥毒基可能通过Caspase依赖的凋亡途径诱导了U2OS骨肉瘤细胞凋亡,其作用机制涉及上调Caspase mRNA表达,最终可能与启动了细胞凋亡的信号转导的级联反应过程有关。总之,本研究为华蟾酥毒基治疗骨肉瘤提供了新的实验依据,下一步我们将进行更加深入的在体实验研究。
[1] Ma K,Zhang C,Huang M Y,et al.Cinobufagin induces autophagy-mediated cell death in human osteosarcoma U2OS cells through the ROS/JNK/p38 signaling pathway[J].Oncol Rep,2016,36(1):90-98.
[2] Yin J Q,Wen L,Wu L C,et al.The glycogen synthase kinase-3beta/nuclear factor-kappa B pathway is involved in cinobufagin-induced apoptosis in cultured osteosarcoma cells[J].Toxicol Lett,2013,218(2):129-136.
[3] 李泉旺,孙韬,胡凯文.华蟾素抗肿瘤机制的研究进展[J].中华中医药杂志,2010,25(12):2075-2078.
[4] Qi F,Li A,Inagaki Y,et al.Antitumor activity of extracts and compounds from the skin of the toad Bufo bufo gargarizans Cantor[J].Int Immunopharmacol,2011,11(3):342-349.
[5] Yu C,Kan S,Pu H,et al.Apoptotic signaling in bufalin-and cinobufagin-treated androgen-dependent and-independent human prostate cancer cells[J].Cancer Sci,2008,99(12):2467-2476.
[6] Qi F,Inagaki Y,Gao B,et al.Bufalin and cinobufagin induce apoptosis of human hepatocellular carcinoma cellsviaFas-and mitochondria-mediated pathways[J].Cancer Sci,2011,102(5):951-958.
[7] Xie C,Chan W Y,Yu S,et al.Bufalin induces autophagy-mediated cell death in human colon cancer cells through reactive oxygen species generation and JNK activation[J].Free Radic Biol Med,2011,51(7):1365-1375.
[8] Ma L,Song B,Jin H,et al.Cinobufacini induced MDA-MB-231 cell apoptosis-associated cell cycle arrest and cytoskeleton function[J].Bioorg Med Chem Lett,2012,22(3):1459-1463.
[9] Isakoff M S,Bielack S S,Meltzer P,et al.Osteosarcoma:Current treatment and a collaborative pathway to success[J].J Clin Oncol,2015,33(27):3029-3035.
[10] 赵亚恒,冯和林,郑丽华,等.骨肉瘤发病机制的研究进展[J].肿瘤防治研究,2014,41(3):283-286.
[11] 马瑞连,王跃文,包毅敏,等.骨肉瘤治疗新进展[J].内蒙古医科大学学报,2013,35(S2):451-457.
[12] 郭征.我国骨肉瘤治疗的现状与问题及发展方向[J].中国骨与关节杂志,2015,4(5):338-342.
[13] 宋科官,马德胜,王洪智,等.华蟾素对MG-63骨肉瘤细胞杀伤作用的实验研究[J].中国骨肿瘤骨病,2010,9(3):231-235.
[14] 宋科官,张涛,严峰,等.华蟾素和顺铂对骨肉瘤MG-63细胞联合杀伤作用的研究[J].中国骨与关节杂志,2014,3(3):224-229.
[15] Cheng L,Chen Y,Peng Y,et al.Ceramide production mediates cinobufotalin-induced growth inhibition and apoptosis in cultured hepatocellular carcinoma cells[J].Tumor Biol,2015,36(8):5763-5771.
[16] 邵淑丽,刘盛楠,张蕾,等.华蟾素诱导人胃癌SGC-7901细胞凋亡[J].基因组学与应用生物学,2015,34(9):1826-1832.
[17] Kai S,Lu J,Hui P,et al.Pre-clinical evaluation of cinobufotalin as a potential anti-lung cancer agent[J].Biochem Biophys Res Commun,2014,452(3):768-774.
[18] Sousa L Q,Machado K D,Oliveira S F,et al.Bufadienolides from amphibians:A promising source of anticancer prototypes for radical innovation,apoptosis triggering and Na+/K+-ATPase inhibition[J].Toxicon,2017,127:63-76.
[19] Yin P H,Liu X,Qiu Y Y,et al.Anti-tumor activity and apoptosis-regulation mechanisms of bufalin in various cancers:new hope for cancer patients[J].Asian Pac J Cancer Prev,2012,13(11):5339-5343.
[20] Cao Y,Yu L,Dai G,et al.Cinobufagin induces apoptosis of osteosarcoma cells through inactivation of Notch signaling[J].Eur J Pharmacol,2017,794:77-84.
[21] Wang D,Bi Z.Bufalin inhibited the growth of human osteosarcoma MG-63 cells via down-regulation of Bcl-2/Bax and triggering of the mitochondrial pathway[J].Tumor Biol,2014,35(5):4885-4890.
[22] Qi F,Li A,Inagaki Y,et al.Induction of apoptosis by cinobufacini preparation through mitochondria-and Fas-mediated caspase-dependent pathways in human hepatocellular carcinoma cells[J].Food Chem Toxicol,2012,50(2):295-302.
[23] 邱淑敏,陈涛,刘美玲,等.中药诱导肿瘤细胞凋亡机制研究进展[J].动物医学进展,2015,36(1):83-86.
EffectofCinobufaginonProliferationandApoptosisofU2OS
YU Ling,GUO Weichun,DAI Guo*
(DepartmentofOrthopedics,RenminHospitalofWuhanUniversity,Wuhan430060,China)
Objective:To investigate the effect of cinobufagin on the growth inhibition,apoptosis and the expression of Caspases mRNA in human osteosarcoma cell line U2OS.MethodsOsteosarcoma cell line U2OS was culturedinvitro. Cell proliferation was detected by Cell Counting Kit-8 (CCK-8).The cells stained by Annexin V and PI were observed by flow cytometry ( FCM) for apoptosis.Hoechst 33258 was used to detect the morphological change of apoptotic cells.The mRNA expression of Caspases in U2OS was observed by RT-PCR.ResultsThe proliferation of human osteosarcoma cell line U2OS could be inhibited and apoptosis could be induced by cinobufagin.The inhibition rate and apoptosis rate were different with the different concentrations.The inhibition rate and apoptosis rate of U2OS cells rose significantly when the concentration of cinobufagin was over 20 nmol·L-1.Apoptotic body could be observed by Hoechst 33258 dying.The Caspases mRNA expression of human osteosarcoma cell line U2OS increased obviously by using cinobufagin.ConclusionCinobufagin could significantly inhibit the proliferation and induce apoptosis of human osteosarcoma cell line U2OS.Its mechanism of action may be related to activation of Caspase dependent apoptosis pathway.
Cinobufagin;osteosarcoma;proliferation;apoptosis
10.13313/j.issn.1673-4890.2017.9.008
国家自然科学基金(81341078)
*
代国,住院医师,研究方向:脊柱外科与骨肿瘤;E-mail:daiguo720@sina.com
2017-03-06)
