吉西他滨联合顺铂新辅助化疗对非小细胞肺癌TXNIP基因表达的影响
2017-12-25,
,
(南华大学附属第二医院胸心外科, 湖南 衡阳 421001)
·临床医学·
吉西他滨联合顺铂新辅助化疗对非小细胞肺癌TXNIP基因表达的影响
刘桂军,胡名松*
(南华大学附属第二医院胸心外科, 湖南 衡阳 421001)
目的研究吉西他滨联合顺铂新辅助化疗对非小细胞肺癌硫还蛋白结合蛋白氧(TXNIP)基因表达的影响。方法获取非小细胞肺癌(NSCLC)患者化疗前的肿瘤标本及采用吉西他滨联合顺铂(GP)方案新辅助化疗2个周期后的肿瘤标本,通过实时定量PCR法、免疫组化及Western blot分析标本中TXNIP表达的变化。并取一部分正常肺组织做为对照。结果正常人肺组织中TXNIP呈一定水平表达,相比之下,NSCLC患者癌标本中TXNIP信使RNA(mRNA)显著降低。当患者经2周期GP方案化疗后,癌标本中TXNIP mRNA表达水平明显增高;再次免疫组化及Western blot法检测结果显示,正常人群肺组织中TXNIP呈一定量的表达,而NSCLC患者癌标本中TXNIP表达量极低。但经GP方案治疗后,癌标本中TXNIP的含量增高。结论吉西他滨联合顺铂化疗能上调非小细胞肺癌TXNIP基因和蛋白的表达。
吉西他滨; 顺铂; 硫氧还蛋白结合蛋白; 非小细胞肺癌
肺癌我国最常见的恶性肿瘤之一,其死亡率和发病率均占所有恶性肿瘤的第一位,其中约80%患者为非小细胞肺癌 (non-small cell lung cancer,NSCLC)。目前治疗NSCLC以手术切除方法疗效最好,但约80%的患者在就诊时就已为中晚期,错过了手术机会。为了提高ⅢA/ⅢB期患者手术切除率,近年来提倡新辅助化疗(neoadjuvant or primary chemotherapy)[1]。有研究表明吉西他滨联合顺铂新辅助化疗方案可明显提高非小细胞肺癌患者的疗效,而且没有出现与化疗相关的死亡病例,被认为是目前应用最广泛、疗效最显著的晚期联合化疗方案之一[2]。治疗以2周期为宜[3]。研究表明,人体多种肿瘤的发生与TXNIP的低表达有关,在胃癌、肝细胞癌、黑色素瘤等不同的癌细胞中,TXNIP表达低于正常人群[4]。TXNIP 基因可通过不同的机制发挥作用,最终直接影响肿瘤细胞的进展和愈后[5]。TXNIP 基因在应用吉西他滨联合顺铂方案新辅助化疗的非小细胞肺癌组织中的表达情况如何,尚未见文献报道。本文拟通过观察非小细胞肺癌应用吉西他滨联合顺铂方案新辅助化疗2个周期后TXNIP基因的变化,探讨吉西他滨联合顺铂方案新辅助化疗在非小细胞肺癌综合治疗过程中的作用。
1 资料与方法
1.1一般资料40例非小细胞肺癌患者均通过病理学确诊,按照国际 TNM 分期,其中IIIA期 28例,IIIB期 12 例。其中女性18人,男性22人,年龄43~64岁,中位年龄52岁;其中鳞癌15例,腺癌19例,其他类型非小细胞肺癌6例;其中不吸烟者19例,吸烟者21例。选择经询问病史及相关检查证实无其他器官基础疾病的人体肺组织,作为正常对照(经过医院论理协会通过批准,患者及家属知情同意情况下,取外伤病人,行肺组织切除治疗的,保留小部分正常肺组织)。
入选标准:①病理学上符合非小细胞肺癌;②病理分期为IIIA、IIIB期;③采用GP方案新辅助化疗2周;④患者所有资料保持完整(含联系方式)。
剔除标准:①患者伴有其他恶性肿瘤;②化疗2周期后未实施肺癌根治术;③术前使用其他抗肿瘤治疗方法;④曾经使用过其他化疗方案治疗者。
1.2治疗方法40例患者均为初治患者,予以吉西他滨联合顺铂(GP)化疗方案化疗:按每平方体表面积确定用药剂量,即吉西他滨1 000 mg/m2,化疗第1天与第8天,静脉滴注;顺铂 25 mg/m2,化疗第1、2、3天,静脉滴注,21 天为 1 个周期。所有患者接受 2 个周期的治疗,通过CT评估其疗效。将手术后切除的肺癌标本送检。
1.3指标检测方法获取非小细胞肺癌(NSCLC)患者化疗前的肿瘤标本及采用吉西他滨联合顺铂(GP)方案新辅助化疗2个周期后的肿瘤标本,通过实时定量PCR法、免疫组化及Western blot分析标本中TXNIP表达的变化。并取一部分正常肺组织做为对照。
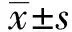
2 结 果
2.1 GP治疗方案对TXNIP mRNA表达的影响正常人肺组织中TXNIP mRNA呈一定水平表达,相比之下,NSCLC患者体内TXNIP mRNA显著降低。当患者经2周期GP方案治疗后,TXNIP mRNA表达水平明显增高(图1)。

图1 GP治疗方案对NSCLC患者TXNIP mRNA表达的影响与正常组比较,*:P<0.05;与治疗前NSCLC比较,#:P<0.05
2.2 GP治疗方案对组织中TXNIP表达的影响免疫组化结果显示,正常人群肺组织中TXNIP呈一定量的表达,而NSCLC患者肺组织中TXNIP表达量极低。而经GP治疗后,TXNIP的含量有所增高(图2)。
2.3 GP治疗方案对细胞TXNIP表达的影响Western blot显示,正常组中TXNIP表达较高,而NSCLC患者中呈低表达。而GP治疗2周期后,与NSCLC组相比,表达水平有所增高(图3)。
3 讨 论
近几十年来,肺癌已成为最常见的恶性肿瘤。病理学上以非小细胞肺癌(NSCLC)最多。大部分患者确诊时已丧失手术治疗的机会。为了提高ⅢA/ⅢB期患者手术率,近年来提倡新辅助化疗,即对恶性肿瘤进行手术或放疗等局部治疗前进行的化疗,又称原发化疗、诱导化疗或术前化疗。新辅助化疗结合手术治疗非小细胞肺癌是目前医学界研究的热点,其作用主要包括以下几方面:(1)缩小肺癌原发病灶,增加手术切除率和提高中晚期的生存率;(2)减少肺癌的分期(T和 N);(3)清除可能已发生转移的肺癌;(4)可评估药物的敏感性。
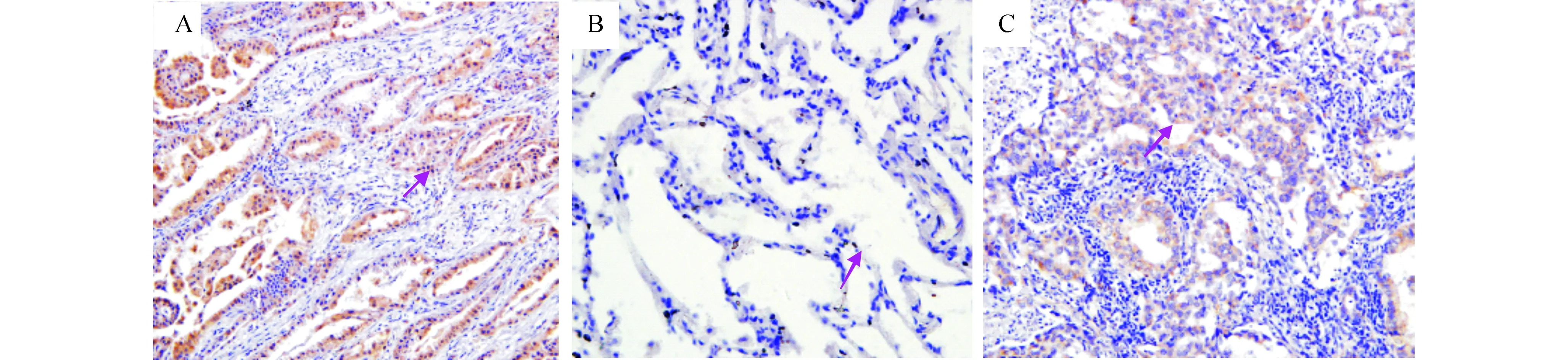
图2 免疫组化检测TXNIP蛋白表达(100×) A:正常组; B:NSCLC;C:GP

图3 Western blot检测NSCLC中TXNIP表达
TXNIP 基因最初是通过用1,25二羟基维生素D-3(1,25-(OH)2D3) 作用人类白血病(Human leukemia)细胞系HL-60 中而发现的[6],亦称维生素D3上调蛋白1(vitamin D3 up-regulating protein 1,VDUP1),是α-视紫红质抑制蛋白家族中可与硫氧还蛋白( thioredoxin,Trx) 发生结合的唯一蛋白。TXNIP作为一种新的抑癌基因,已经发现在肝癌、胃肠癌等恶性肿瘤组织中表达水平下调,然而在肺癌中的报道非常少。TXNIP可与Trx半胱氨酸残基结合从而负调控其抗氧化功能。此外,TXNIP还具有调节代谢平衡和调节生长信号的作用。
吉西他滨属于抗代谢类抗癌药,是目前对治疗NSCLC最有效的化疗药之一,主要作用于细胞周期S期细胞的特异性药物,可使DNA合成减少,且能使抑制细胞从G1期到达S期。吉西他滨常在临床中同其他药物联用尤其是铂类药物联合治疗方法效果均较理想[7-8]。顺铂(DDP)在抗癌药物中是被应用最广泛之一,属细胞周期非特异性抗肿瘤药,主要作用是和DNA链上碱基发生作用,从而抑制DNA复制,减少了肿瘤细胞的分裂。顺铂在抗癌中的作用有较高的抗癌活性,且和其他抗癌药物发生无交叉耐药,故通常采用和其他抗肿瘤药物联合使用[9]。
目前非小细胞肺癌患者新辅助化疗常采用“吉西他滨+顺铂”(GP)方案。大量临床研究表明,吉西他滨联合顺铂的新辅助化疗方案可明显提高非小细胞肺癌的临床效果,而且患者对化疗过程中出现的不良反应均能耐受,没有出现化疗相关死亡病例,被认为是目前应用最广泛、疗效最显著的晚期联合化疗方案之一。
为了明确吉西他滨联合顺铂治疗能否影响TXNIP的表达,本文通过体内实验进行了观察。结果显示,正常人肺组织中TXNIP mRNA 呈一定水平表达,相比之下,NSCLC患者体内TXNIP mRNA显著降低。当患者经2周期GP方案治疗后,TXNIP mRNA表达水平明显增高。免疫组化和Western blot也证实NSCLC患者体内TXNIP蛋白水平明显低于正常人群。由此可见,吉西他滨联合顺铂治疗可上调NSCLC患者TXNIP的表达水平。Knoll等[10]研究表明miR-224/452介导的TXNIP低表达可能是上皮间质转化以及肿瘤侵袭的重要机制。Farrell[11]证实TXNIP能调节HIF介导的基因转录活性,从而改变VEGF的表达而发挥多肿瘤的抑制作用。因此,在吉西他滨联合顺铂新辅助化疗非小细胞肺癌中,高表达的TXNIP可能是一种理想的标志物,可能对预测转移和预后具有一定的意义。
综前所述,吉西他滨联合顺铂处理肺癌细胞后,可能通过诱导TXNIP基因mRNA的表达,从而上调TXNIP蛋白的表达水平。随着TXNIP基因表达的增强,其对TrxR的抑制作用加强,从而抑制了硫氧还蛋白清除活性氧的功能,最终抑制肿瘤的生长。
[1] Li DP,Li W,Feng J,et al.Adjuvant chemotherapy with sequential cytokine-induced killer (CIK) cells in stage ib non-small cell lung cancer[J].Oncol Res,2015,22(2):67-74.
[2] Fang H,Lin RY,Sun MX,et al.Efficacy and survival-associated factors with gefitinib combined with cisplatin and gemcitabine for advanced non- small cell lung cancer[J].Asian Pac J Cancer Prev,2014,15(24):10967-10970.
[3] Wang Y,Chen J,Wu S,et al.Clinical effectiveness and clinical toxicity associated with platinum-based doublets in the first-line setting for advanced non-squamous non-small cell lung cancer in Chinese patients:a retrospective cohort study[J].BMC Cancer,2014,14:940.
[4] Song J,Li J,Hou F,et al.Mangiferin inhibits endoplasmic reticulum stress-associated thioredoxin-interacting protein/NLRP3 inflammasome activation with regulation of AMPK in endothelial cells[J].Metabolism,2015,64(3):428-437.
[5] Woolston CM,Madhusudan S,Soomro IN,et al.Thioredoxin interacting protein and its association with clinical outcome in gastro-oesophageal adenocarcinoma[J].Redox Biol,2013,1:285-291.
[6] Hirata Y,Saito M,Tsukamoto I,et al.Analysis of the inhibitory mechanism of D-allose on MOLT-4F leukemia cell proliferation[J].J Biosci Bioeng,2009,107(5):562-568.
[7] Hayashi H,Kurata T,Nakagawa K.Gemcitabine:efficacy in the treatment of advanced stage nonsquamous non-small cell lung cancer[J].Clin Med Insights Oncol,2011,5:177-184.
[8] Tournoux-Facon C,Senellart H,Lemarie E,et al.Phase I and pharmacokinetic study of IV vinflunine in combination with gemcitabine for treatment of advanced non-small cell lung cancer in Chemonaive patients[J].J Thorac Oncol,2011,6(7):1247-1253.
[9] Davidov MI,Polotzky BE,Marenich AF,et al.Gemcitabine combined with cisplatin as neoadjuvant chemotherapy in stage IB-IIIA non-small cell lung cancer[J].Anticancer Drugs,2011,22(6):569-575.
[10] Knoll S,Furst K,Kowtharapu B,et al.E2F1 induces miR-224/452 expression to drive EMT through TXNIP downregulation[J].EMBO Rep,2014,15(12):1315-1329.
[11] Farrell MR,Rogers LK,Liu Y,et al.Thioredoxin-interacting protein inhibits hypoxia-inducible factor transcriptional activity[J].Free Radic Biol Med,2010,49(9):1361-1367.
Effectoftheneo-adjuvantchemotherapyofthecombinationofgemcitabineandcisplatinontxnipexpressioninnon-smallcelllungcancercells
LIU Guijun,HU Mingsong
(DepartmentofCardiothoracicsurgery,TheSecondAffiliatedHospitalofUniversityofSouthChina,Hengyang421001,Hunan,China)
ObjectiveTo observe the effect of gemcitabine and cisplatin therapy on TXNIP expression in non-small cell lung cancer cells.MethodsThe healthy populations were collected,and non-small cell lung cancer patients were administrated with two course of gemcitabine and cisplatin,then the clinical specimens were collected before and after the treatment.The Thioredoxin-interacting protein (TXNIP) was detected by real time PCR,the protein were measured by immunohistochemistry and western blot.ResultThe mRNA of TXNIP in the healthy populations expressed to a certain level.In contrast,the TXNIP mRNA in NSCLC patients was lower than that in healthy control.After two courses of gemcitabine and cisplatin treatment,the TXNIP mRNA was gradually increased;Immunohistochemistry demonstrated that in the lung of the healthy population,TXNIP was expressed to a certain level,while it decreased in NSCLC patients.Gemcitabine and cisplatin administration could increase its expression level.ConclusionThe combination of gemcitabine and cisplatin can upregulate TXNIP gene and protein expression in non small cell lung cancer patients.
Gemcitabine; Cisplatin; Thioredoxin-interacting protein; non-small cell lung cancer
10.15972/j.cnki.43-1509/r.2017.01.016
2016-07-23;
2016-12-21
湖南省卫生厅科研课题支助(编号:B2014-057).
*通讯作者,E-mail:nanhua2h@126.com.
R734.2
A
蒋湘莲)
