NLRC4炎症小体在细菌感染中的免疫调控作用
2017-12-25,
,
(南华大学病原生物学研究所,湖南 衡阳 421001)
·讲座与综述·
NLRC4炎症小体在细菌感染中的免疫调控作用
旷星星,吴移谋*
(南华大学病原生物学研究所,湖南 衡阳 421001)
炎症小体(inflammasome)是一类胞浆内大分子多蛋白复合体,它能调节半胱氨酸天冬氨酸特异蛋白酶1(caspase-1)的活化,促进白细胞介素(interleukin,IL)-1β和IL-18成熟与分泌,引起炎症反应。尽管大部分炎症小体激活的具体分子机制尚不明确,但是最近NLRC4炎症小体越来越为人们所知。NLRC4炎症小体参与机体的固有免疫应答,在多种病原体感染过程中发挥重要的免疫调控作用。本文将对NLRC4炎症小体的构成、活化机制以及在微生物感染中的作用作一概述。
NLRC4炎症小体; 沙门菌; 弗氏志贺菌; 嗜肺军团菌; 铜绿假单胞菌; 产单核细胞李斯特菌
固有免疫(innate immunity)系统是机体在长期种系进化过程中形成的抵御病原体入侵的第一道防线,该系统含大量模式识别受体(pattern recognition receptors,PRPs)。宿主主要通过两类PRPs识别病原相关分子模式(pathogen associated molecular patterns,PAMPs)调节固有免疫应答:一类是膜结合受体,如Toll样受体(Toll-like eceptors,TLRs);另一类是细胞内NOD样受体 (NOD-like receptor NLRs)[1-3]。其中NLR识别相应的配体后可组装形成炎症小体。炎症小体是一类胞浆内大分子多蛋白复合体,它能通过募集和活化caspase-1诱导促炎因子IL-1β和IL-18成熟与分泌,还能诱导细胞pyroptosis[4]。目前已发现的炎症小体包括:NLRP1、NLRP3、NLRP6、NLRP7、NLRP12、NLRC4以及NAIP炎症小体[5]。本文主要介绍宿主细胞中的NLRC4炎症小体对沙门菌、弗氏志贺菌、嗜肺军团菌、铜绿假单胞菌以及产单核细胞李斯特菌感染的免疫调控作用。
1 NLRC4炎症小体的构成
NLRC4炎症小体(NLRC4 inflammasome)由NLRC4(NOD-like receptor (NLR) containing a caspase activating and recruitment domain (CARD) 4 )、凋亡相关斑点样蛋白( apoptosis associated speck-like protein containing a CARD,ASC)以及pro-caspase -1三部分组成。
NLRC4也称IPAF、Card12以及CLAN,为胞浆内受体蛋白NLR家族成员。与所有的NLR一样(图1),NLRC4的C端为亮氨酸重复结构域(leucin rich repeat,LRRs),该结构域与TLR的胞外结构域相同,用于识别PAMPs等配体;中间为NACHT结构域,由下列相关分子拼接组成:NAIP(神经元凋亡抑制蛋白)、CⅡTA、HET-E和TPl,该结构域为NLR蛋白家族共有的特征性结构域,可介导NLRC4自身寡聚反应; N端含三个caspase募集结构域( caspase recruitment domain,CARD),该结构域为效应结构域,可连接衔接蛋白及效应分子,介导下游信号转导。
ASC为衔接蛋白,它一端可与NLR分子链接,另一端通过CARD结构域募集炎症相关蛋白激酶 caspase-1的前体。有趣的是,由于NLRC4存在CARD结构域,它可直接或间接募集和活化caspase-1,并不依赖于ASC[6]。但研究发现,ASC缺失后,caspase-1的活化和IL-1β的分泌均减少,说明ASC在NLRC4炎症小体的活化中发挥重要作用[7],但是,ASC在NLRC4炎症小体形成中的具体作用还未阐明。
Pro-caspase-1无催化活性,激活后形成有活性的caspase-1。Caspase-1是炎症小体的重要组成部分,活化的caspase-1可剪切促炎细胞因子IL-1β和IL-18前体,产生相应的成熟细胞因子,引起炎症反应。Caspase-1也可诱导细胞pyroptosis。Pyroptosis是一种caspase-1依赖性细胞程序性死亡方式,它可导致细胞膜破裂,胞内容物释放,进而放大炎症反应[8]。
当NLRC4的LRR结构域识别相应的PAMP时,NLRC4炎症小体可被激活,pro-caspase-1剪切为成熟的caspase-1,随后引起下游IL-1β和IL-18的成熟与分泌,进而参与胞外炎症反应。同时,成熟的caspase-1可介导宿主细胞pyroptosis。
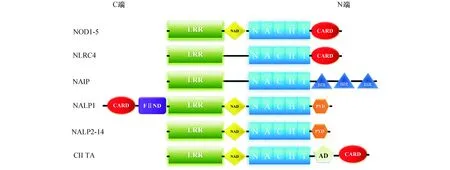
图1 NLR结构示意图NLR家族蛋白是一类含有LRR结构域和NACHT结构域的胞浆内多功能受体蛋白家族。人类NLR家族共有22个成员。其中包括14个NLRP成员、5个NOD成员、NAIP、NLRC4和CIITA。如图第一行所示, NOD分子由LRR―NAD―NACHT―CARD四个部分组成,如果C端的结构域CARD换成PYD成为LRR―NAD—NACHT―PYD,则形成另一类NLR,称为NAIP蛋白(NACHT/LRR/PYD-containing protien)。NOD和NALP是NLR受体家族中两种主要的类型或亚家族。NLRC4由LRR-NACHT-CARD三部分组成
2 NLRC4炎症小体的活化机制
现有研究已表明,沙门菌、弗氏志贺菌、嗜肺军团菌、铜绿假单胞菌以及产单核细胞李斯特菌可激活宿主细胞的NLRC4炎症小体,活化caspase-1。其中,沙门菌、嗜肺军团菌、铜绿假单胞菌及李斯特菌含有鞭毛,鞭毛蛋白是细菌鞭毛的主要成分。研究表明,胞浆中的细菌鞭毛蛋白是NLRC4炎症小体的激活剂(图2)。NLRC4识别胞浆中的细菌鞭毛蛋白后激活炎症小体,引起caspase-1的活化[9]。细菌鞭毛蛋白是如何活化NLRC4炎症小体呢?进一步研究发现,细菌鞭毛蛋白单体可通过功能性细菌III型分泌系统(functional bacterial type III secretion system,T3SS)进入感染的细胞质中,从而导致NLRC4炎症小体的活化[10]。T3SS是分子针状结构,病原体可通过这个跨膜针状结构将效应分子导入宿主细胞胞浆中。据报道,鼠伤寒沙门氏菌、弗氏志贺菌和铜绿假单胞菌也可通过T3SS分别将非鞭毛蛋白的效应蛋白分子PrgJ、Mxil和ExoU导入宿主细胞浆内[11],激活NLRC4炎症小体。研究表明T3SS的杆状蛋白是NLRC4炎症小体的激活剂。另外,Lindestam等发现,铜绿假单胞菌的菌毛也是一种NLRC4炎症小体激活因子[12]。
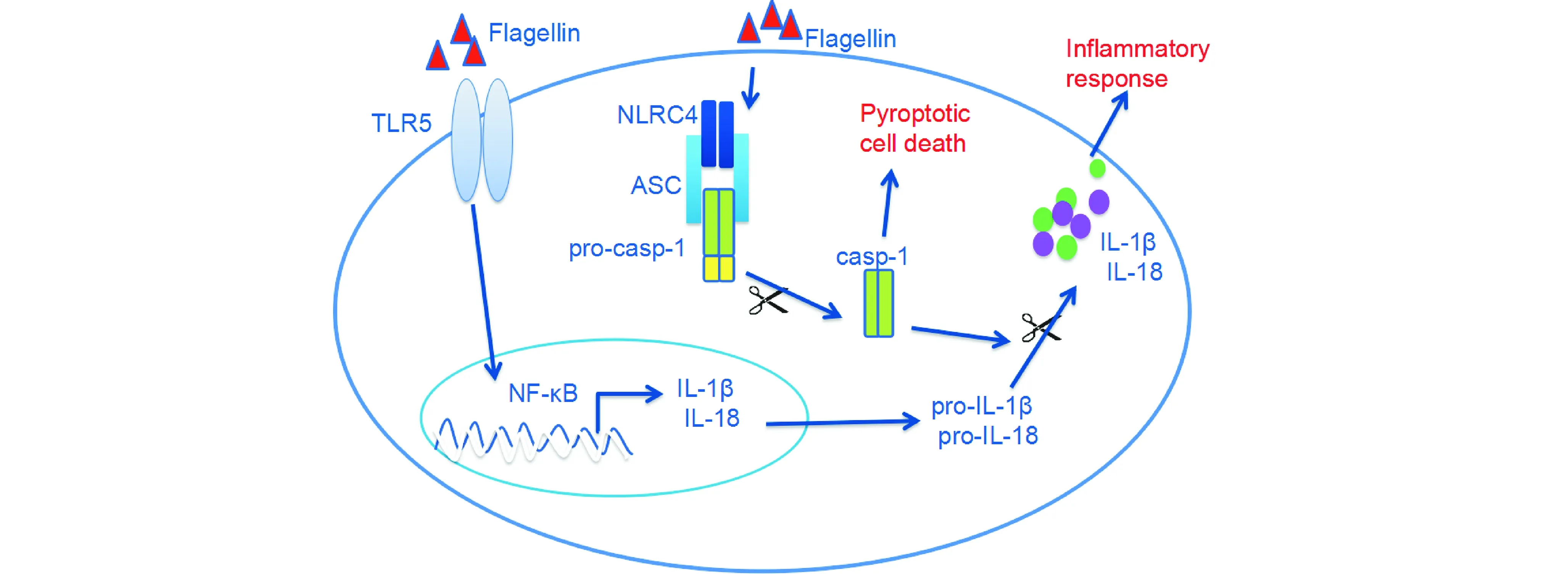
图2 NLRC4炎症小体活化信号通路示意图NLRC4炎症小体由NLRC4、ASC、pro-caspase-1三部分组成。其中NLRC4是受体,识别胞浆中NLRC4的PAMPs;ASC为衔接蛋白;pro-caspase-1为效应蛋白。NLRC4识别PAMPs(通常为鞭毛蛋白)后,NLRC4炎症小体激活,pro-caspase-1活化形成caspase-1,活化的caspase-1剪切pro-IL-1β和pro-IL-18,分泌成熟IL-1β和IL-18,引起炎症反应。同时,caspase-1还可引起细胞发生pyroptosis
NAIP5是含3个BIR信号结构域的NLR成员。有研究发现,NAIP5能感受嗜肺军团菌鞭毛蛋白的CARD结构域,激活NLRC4炎症小体[13]。但是,另有报道表明,嗜肺军团菌活化caspase-1需要NLRC4和鞭毛蛋白的参与,而不依赖于NAIP5[14]。因此,NAIP5是否与NLRC4相互作用激活炎症小体还不明确。
研究发现,NLRP3炎症小体的激活可依赖于K+外流[15]。NLRC4炎症小体主要在微生物感染中发挥免疫调控作用,它识别的主要是微生物及微生物组分。然而,也有研究发现,鼠伤寒沙门氏菌和铜绿假单胞菌感染宿主细胞后,增加胞外钾离子的浓度,宿主细胞中NLRC4炎症小体活化受到抑制[16]。然而,另外有研究表明,NLRC4炎症小体的活化并不依赖于K+[17],也尚未发现K+通道在NLRC4活化中发挥作用。
3 NLRC4炎症小体与细菌感染
一些细菌感染可激活NLRC4炎症小体,引起炎症反应。适度的炎症反应有利于细菌的清除,抑制细菌感染,而过度的炎症反应会引起宿主细胞死亡。某些细菌可在胞内生存,通过调控NLRC4炎症小体的活化,逃避宿主免疫系统的检测,引起严重的感染。
3.1 NLRC4炎症小体和沙门菌沙门菌(Salmonella)是一类常见的寄生于人类和动物肠道中的革兰阴性杆菌,它是沙门菌病(Salmonellosis)的病原体。沙门菌病是食物中毒的主要原因之一。据报道,NLRC4炎症小体对调控炎症反应和控制沙门菌感染有重要作用。
Franchi等发现,在感染鼠伤寒沙门菌(Salmonellatyphimurium)的巨噬细胞中,caspase-1的活化呈NLRC4依赖性[18]。也有报道表明,鼠伤寒沙门菌感染宿主细胞后,NLRC4炎症小体被激活,活化的caspase-1剪切pro-IL-1β和pro-IL-18,并诱导pyroptosis和caspase-7的活化,引起炎症反应[19-20]。然而,有研究发现,使用中等载量的鼠伤寒沙门菌感染过表达NLRC4的人细胞系后,该细胞抑制了鼠伤寒沙门菌的增殖。而将高载量鼠伤寒沙门菌感染过表达NLRC4的巨噬细胞后,巨噬细胞发生细胞死亡[21]。这表明细菌载量不同,NLRC4炎症小体发挥的作用可能不同。
研究者通常采用巨噬细胞研究炎症小体对机体固有免疫应答的调节作用。研究表明,沙门菌激活NLRC4炎症小体可诱导巨噬细胞pyroptosis。然而,Chen等发现,与巨噬细胞不同的是,沙门菌感染中性粒细胞后激活了NLRC4炎症小体,但并不发生pyroptosis。这种中性粒细胞抗pyroptosis现象是炎症小体通路研究中的新发现[22]。促炎细胞因子IL-1可促进中性粒细胞从血管渗出至炎症部位,参与免疫应答。急性沙门菌感染后可激活中性粒细胞中的NLRC4炎症小体,产生IL-1β,而不发生pyroptosis,这意味着沙门菌感染后中性粒细胞可在感染部位持续产生IL-1β,而不会因为发生快速细胞死亡而影响炎症小体依赖性抗菌效应蛋白的功能。因此,这一发现也表明,中性粒细胞中NLRC4炎症小体通路可使宿主的促炎反应和抗菌效应最大化。
近期有研究发现,在感染鼠伤寒沙门菌或转染鼠伤寒沙门菌鞭毛蛋白的巨噬细胞中,NLRP3的活化与NLRC4相关。NLRP3和NLRC4之间存在的相互作用揭示了在不同的炎症小体之间可能存在重叠[23]。
3.2 NLRC4炎症小体与弗氏志贺菌弗氏志贺菌(Shigella)是细菌性痢疾的病原体,它是一种无鞭毛兼性胞内细菌。在感染后可诱发严重炎症反应。据报道,弗氏志贺菌感染后可诱导巨噬细胞中caspase-1的活化,IL-1β的加工以及pyroptosis。该过程并不依赖于鞭毛蛋白(弗氏志贺菌无鞭毛),而需要T3SS和NLRC4炎症小体的参与[24-25]。其中弗氏志贺菌Mxil[11]和IpaB[26]是已发现的参与NLRC4炎症小体激活的T3SS效应分子。Suzuki等发现,弗氏志贺菌还可通过T3SS分泌效应蛋白侵袭质粒抗体 H7.8 (IpaH7.8)激酶3(E3)泛素连接酶激活NLRP3、NLRC4炎症小体和caspase-1,并导致巨噬细胞以 IpaH7.8 E3连接酶依赖性的方式发生细胞死亡[27]。以上表明,弗氏志贺菌在感染期可通过多个T3SS机制活化NLRC4炎症小体。
已有研究表明,弗氏志贺菌是一种能逃避和破坏固有免疫系统监视的致病菌。它可抑制上皮细胞中NLRC4炎症小体的活化。最近Hermansson AK等研究证实,志贺菌感染上皮细胞,巨噬细胞,中性粒细胞,树突状细胞以及BT淋巴细胞等不同的细胞后,均可调控炎症小体活化,调节炎症反应。他们认为,志贺菌通过调控炎症小体活化的“开关”这种免疫逃避的本领来优化和宿主之间的相互作用,并成功形成感染[28]。
3.3 NLRC4炎症小体与嗜肺军团菌嗜肺性军团菌(L.pneumophila)是一种有鞭毛兼性胞内菌。这种机会致病菌可经人肺部吸入,在巨噬细胞中复制后引起一种称为“军团病”的重型肺炎。研究表明,在嗜肺军团菌小鼠模型中,NAIP5和NLRC4协同作用,诱导caspase-1的活化[13]。NAIP5 /NLRC4炎症小体被嗜肺军团菌鞭毛蛋白激活,随后引起caspase-1的活化以及pyroptosis。也有研究报道,嗜肺军团菌感染可引起caspase-1和caspase-7二者的活化[7]。虽然NAIP5与NLRC4炎症小体对嗜肺军团菌感染的作用机制尚不明确。但是,可以确定的是,NAIP5在抗嗜肺军团菌感染中发挥作用:活化形成NAIP5炎症小体与NLRC4炎症小体相互作用,抑或是作为胞浆受体促进NLRC4炎症小体的活化。
有报道发现,在生理感染(低)水平的嗜肺军团菌载量下,caspase-1的活化依赖于细菌鞭毛蛋白和宿主的NLRC4。而在高细菌载量下,上皮细胞中caspase-1的活化不依赖NLRC4[29]。这也表明,嗜肺军团菌感染载量不同,NLRC4炎症小体在caspase-1活化中的作用也不同。
最新研究表明,除了研究颇多的NLRC4-NAIP5鞭毛蛋白识别通路外,肿瘤坏死因子(TNF)和活性氧(ROS)也在有效控制嗜肺军团菌感染的固有免疫中发挥重要作用,但不依赖于NLRC4、caspase-1、caspase-11和 NOX2。这也体现了在嗜肺军团菌感染后体内NLRC4炎症小体等多条信号通路活化并相互作用[30]。
3.4 NLRC4炎症小体与与铜绿假单胞菌铜绿假单胞菌(P.aerugenosa,PA)是一种条件致病菌,它广泛分布在医院环境中,可引起致急重病人发生严重感染。据报道,铜绿假单胞菌可通过T3SS活化NLRC4炎症小体,在宿主组织中诱导产生炎症细胞因子如IL-1β和IL-18。其中铜绿假单胞菌毒力因子ExoU是T3SS的效应蛋白[31]。
有报道表明,在低细菌载量时,鞭毛蛋白参与铜绿假单胞菌感染后的caspase-1活化。而在高水平细菌载量时,缺乏鞭毛蛋白的铜绿假单胞菌突变体仍能活化caspase-1。但是,与嗜肺军团菌不同的是,缺乏鞭毛蛋白的铜绿假单胞菌突变体刺激caspase-1的活化仍依赖于NLRC4。这些数据也提出了一种可能,即NLRC4不仅能识别鞭毛蛋白,也能识别其他PAMPs,其具体机制有待进一步研究。
3.5 NLRC4与产单核细胞李斯特菌产单核细胞李斯特菌(Listeria monocytogenes)是一种有鞭毛的革兰阳性菌,它可感染新生儿、老年人或免疫力低下的人群,并引起脑膜炎和败血症,孕妇尤其易感。产单核细胞李斯特菌可从巨噬细胞的吞噬体中逃逸,并在其胞质中复制。有研究表明,胞质中李斯特菌可激活caspase-1,加工和分泌IL-1β和IL-18以及引起caspase-1依赖性pyroptosis。该过程主要通过受体NLRC4和NAIP3。NLRC4炎症小体被李斯特菌鞭毛蛋白激活后,诱导细胞死亡,最终清除病原体,发挥抗菌作用[32]。
4 展 望
过去十几年的研究大大增加了人们对NLRC4炎症小体功能的认识,它的功能不仅限于免疫识别,而且广泛参与免疫应答的调节过程,在抗微生物感染和维持自身稳态方面具有重要作用。在不同病原体感染,不同细菌载量情况下,NLRC4炎症小体发挥的调控作用可能不同。随着研究的不断深入,研究者发现不仅是单一的NLRC4炎症小体在细菌感染中发挥免疫调控作用,炎症小体间相互作用也是其调控免疫的重要方式。然而,目前仍存在诸多问题亟待解决,例如:NLRC4炎症小体的具体活化途径尚不明确;是否有其他未知的激活剂活化NLRC4炎症小体;不同的微生物感染后NLRC4炎症小体激活途径不同的原因;NLRC4炎症小体是否在其他病原体感染中也发挥免疫调控作用;NLRC4炎症小体与其他炎症小体是如何相互作用的;是否存在宿主内源性分子参与NLRC4炎症小体的调节。因此,进一步的研究将有利于人们更深入了解某些病原体的致病机制,指导相关疾病的预防和治疗。
[1] Jin MS,Lee JO.Structures of the toll-like receptor family and its ligand complexes[J].Immunity,2008,29(2):182-191.
[2] Strowig T,Henao-Mejia J,Elinav E,et al.Inflammasomes in health and disease[J].Nature,2012,481(7381):278-286.
[3] Sutterwala FS,Flavell RA.NLRC4/IPAF:a CARD carrying member of the NLR family[J].Clin Immunol,2009,130(1):2-6.
[4] 吴丹,周树生.炎症小体调控机制的研究进展[J].微生物学免疫学进展,2015,(1):59-63.
[5] Man SM,Ekpenyong A,Tourlomousis P,et al.Actin polymerization as a key innate immune effector mechanism to controlSalmonellainfection[J].Proc Natl Acad Sci USA,2014,111(49):17588-17593.
[6] Schroder K,Tschopp J.The inflammasomes[J].Cell,2010,140(6):821-832.
[7] Akhter A,Gavrilin MA,Frantz L,et al.Caspase-7 activation by the Nlrc4/Ipaf inflammasome restricts Legionella pneumophila infection[J].PLoS Pathog,2009,5(4):e1000361.
[8] Liu X,Zhang Z,Ruan J,et al.Inflammasome-activated gasdermin D causes pyroptosis by forming membrane pores[J].Nature,2016,535(7610):153-158.
[9] Miao EA,Alpuche-Aranda CM,Dors M,et al.Cytoplasmic flagellin activates caspase-1 and secretion of interleukin 1beta via Ipaf,Nat Immunol,2006,7(6):569-575.
[10] Sun YH,Rolan HG,Tsolis RM.Injection of flagellin into the host cell cytosol bySalmonellaenterica serotype Typhimurium[J].J Biol Chem,2007,282(47):33897-33901.
[11] Miao EA,Mao DP,Yudkovsky N,et al.Innate immune detection of the type III secretion apparatus through the NLRC4 inflammasome[J].Proc Natl Acad Sci USA,2010,107(7):3076-3080.
[12] Arlehamn CS,Evans TJ.Pseudomonas aeruginosa pilin activates the inflammasome[J].Cell Microbiol,2011,13(3):388-401.
[13] Lightfield KL,Persson J,Trinidad NJ,et al.Differential requirements for NAIP5 in activation of the NLRC4 inflammasome[J].Infect Immun,2011,79(4):1606-1614.
[14] Lamkanfi M,Amer A,Kanneganti TD,et al.The Nod-like receptor family member Naip5/Birc1e restricts Legionella pneumophila growth independently of caspase-1 activation[J].J Immunol,2007,178(12):8022-8027.
[15] Petrilli V,Papin S,Dostert C,et al.Activation of the NALP3 inflammasome is triggered by low intracellular potassium concentration.Cell Death Differ,2007,14(9):1583-1589.
[16] Arlehamn CS,Petrilli V,Gross O,et al.The role of potassium in inflammasome activation by bacteria[J].J Biol Chem,2010,285(14):10508-10518.
[17] Hwang I,Park S,Hong S,et al.Salmonellapromotes ASC oligomerization-dependent caspase-1 activation.Immune Netw,2012,12(6):284-290.
[18] Franchi L,Amer A,Body-Malapel M,et al.Cytosolic flagellin requires Ipaf for activation of caspase-1 and interleukin 1beta in salmonella-infected macrophages[J].Nat Immunol,2006,7(6):576-582.
[19] Damiano JS,Newman RM,Reed JC.Multiple roles of CLAN (caspase-associated recruitment domain,leucine-rich repeat,and NAIP CIIA HET-E,and TP1-containing protein) in the mammalian innate immune response[J].J Immunol,2004,173(10):6338-6345.
[20] Lamkanfi M,Kanneganti TD,Van Damme P,et al.Targeted peptidecentric proteomics reveals caspase-7 as a substrate of the caspase-1 inflammasomes[J].Mol Cell Proteomics,2008,7(12):2350-2363.
[21] Damiano JS,Stehlik C,Pio F,et al.CLAN,a novel human CED-4-like gene[J].Genomics,2001,75(1-3):77-83.
[22] Chen KW,Gross CJ,Sotomayor FV,et al.The neutrophil NLRC4 inflammasome selectively promotes IL-1beta maturation without pyroptosis during acuteSalmonellachallenge[J].Cell Rep,2014,8(2):570-582.
[23] Qu Y,Misaghi S,Newton K,et al.NLRP3 recruitment by NLRC4 duringSalmonellainfection[J].J Exp Med,2016,213(6):877-885.
[24] Schroeder GN,Jann NJ,Hilbi H.Intracellular type III secretion by cytoplasmicShigellaflexneri promotes caspase-1-dependent macrophage cell death[J].Microbiology,2007,153(Pt 9):2862-2876.
[25] Suzuki T,Franchi L,Toma C,et al.Differential regulation of caspase-1 activation,pyroptosis,and autophagy via Ipaf and ASC inShigella-infected macrophages[J].PLoS Pathog,2007,3(8):e111.
[26] Yang SC,Hung CF,Aljuffali IA,et al.The roles of the virulence factor IpaB inShigellaspp.in the escape from immune cells and invasion of epithelial cells[J].Microbiol Res,2015,181:43-51.
[27] Suzuki S,Mimuro H,Kim M,et al.ShigellaIpaH7.8 E3 ubiquitin ligase targets glomulin and activates inflammasomes to demolish macrophages[J].Proc Natl Acad Sci USA,2014,111(40):E4254-4263.
[28] Hermansson AK,Paciello I,Bernardini ML.The orchestra and its maestro:Shigella’s fine-tuning of the inflammasome platforms[J].Curr Top Microbiol Immunol,2016,397:91-115.
[29] Vinzing M,Eitel J,Lippmann J,et al.NAIP and Ipaf control Legionella pneumophila replication in human cells[J].J Immunol,2008,180(10):6808-6815.
[30] Ziltener P,Reinheckel T,Oxenius A.Neutrophil and alveolar macrophage-mediated innate immune control of legionella pneumophila lung infection via TNF and ROS[J].PLoS Pathog,2016,12(4):e1005591.
[31] Sutterwala FS,Mijares LA,Li L,et al.Immune recognition of Pseudomonas aeruginosa mediated by the IPAF/NLRC4 inflammasome[J].J Exp Med,2007,204(13):3235-3245.
[32] Warren SE,Mao DP,Rodriguez AE,et al.Multiple nod-like receptors activate caspase 1 during listeria monocytogenes infection[J].J Immunol,2008,180(11):7558-7564.
EffectsofNLRC4inflammasomeinimmuneregulationduringbacterialinfections
KUANG Xingxing,WU Yimou
(InstituteofPathogenBiology,UniversityofSouthChina,Hengyang421001,Hunan,China)
Inflammasomes comprise a family of cytosolic multi-protein complex that can regulate the secretion of IL-1β and IL-18,and initiate inflammation via the recruitment and activation of the caspase-1.While the mechanisms of activation of most inflammasomes are unclear,the NLRC4 subfamily of inflammasomes is increasingly well understood.NLRC4 Inflammasome participates in the body’s innate immune response and plays an important role in immune regulation after bacterial infection.Here,the component of NLRC4 Inflammasome,the mechanism of activation of NLRC4 Inflammasome and the effects of NLRC4 Inflammasome after infected with bacteria were reviewed.
NLRC4 inflammasome;Salmonella;Shigella; Legionella; Pseudomonas aeruginosa; Listeria monocytogenes
10.15972/j.cnki.43-1509/r.2017.01.001
2016-07-09;
2016-09-09
*通讯作者,E-mail:yimouwu@sina.com.
R37
A
秦旭平)
