超声引导下肉毒毒素注射对脑卒中后肩痛的疗效研究
2017-12-22马贤聪陈敬君饶金柱
马贤聪,陈敬君,杨 泉,饶金柱,鲍 晓
·临床医学·
·论著·
超声引导下肉毒毒素注射对脑卒中后肩痛的疗效研究
马贤聪,陈敬君,杨 泉,饶金柱,鲍 晓
目的观察超声引导下肉毒毒素注射治疗脑卒中后肩关节疼痛的疗效以及患肢康复效果。方法75例脑卒中肩痛患者,随机配对分为肉毒毒素注射+常规康复组(A组)、曲安奈德+常规康复组(B组)、常规康复组(C组),比较3组患者治疗前后Fugl-Meyer上肢功能评定、VAS评分和肩关节活动度。结果3组患者在治疗前患肢Fugl-Meyer上肢功能评分、VAS评分和肩关节活动度无明显差异(P>0.05)。3组治疗4周后和治疗前对比,患肢Fugl-Meyer上肢功能评分、VAS评分和肩关节活动度均改善,差异有统计学意义(P<0.05)。其中A组和B组患者在治疗4周后Fugl-Meyer上肢功能评分、VAS评分和肩关节活动度改善均比C组明显(P<0.05)。A组Fugl-Meyer上肢功能评分、VAS评分和肩关节活动度(49.3±7.4,2.34±1.10,103.7±11.2,91.5±7.4)和B组(40.0±5.1,3.7±1.2,79.4±9.3,74.3±9.2)相比改善明显,差异有统计学意义(P<0.05)。结论肉毒毒素治疗脑卒中后肩痛结合常规康复训练,对脑卒中偏瘫患者上肢功能康复具有特殊的意义,且未发现有不良反应。
A型肉毒毒素; Fugl-Meyer上肢功能评分;脑卒中 ;肩痛
脑梗死后常引起一侧肢体瘫痪,偏瘫侧肩关节疼痛和随后造成的功能障碍是常见并发症之一,其发病率为5%~84%[1-3]。引起脑卒中后肩关节疼痛的原因很多,包括肩关节半脱位、肌肉痉挛、肩手综合征以及肩关节软组织损伤等[4],其中肩关节软组织损伤是导致肩痛的重要原因,常常由运动康复和日常生活时的损伤造成。肩关节软组织损伤最常见包括肩峰下滑囊炎、肱二头肌腱长头肌腱炎、冈上肌腱炎等。偏瘫侧肩关节疼痛常常影响患者的上肢功能康复训练以及日常生活,导致偏瘫侧肢体功能训练无法正常开展,严重影响患肢康复治疗效果和功能恢复[5]。对于此,临床常常采用物理因子治疗、针灸以及服用止痛药物等方式进行干预,但效果不佳或有并发症出现。针对上述情况,本研究旨在观察超声引导下肉毒毒素注射治疗脑卒中后肩关节疼痛的效果以及随后的患肢康复效果。
1 资料与方法
1.1 临床资料 以1995年全国第四届脑血管病学术会议通过的诊断要点为诊断标准,并经CT或MRI检查,临床做出脑梗死诊断。根据入选标准,选取2015年6月至2016年12月期间因脑梗死后患者肩关节疼痛需治疗患者75人,按照随机配对的原则,分为肉毒毒素注射+常规康复组(A组)、曲安奈德+常规康复组(B组)、常规康复组(C组),每组25例。A组男14例,女11例,年龄47~75岁,平均年龄(67.0±8.3)岁,左侧偏瘫20例,右侧偏瘫5例;B组男9例,女16例,年龄53~71岁,平均年龄(65.0±7.8)岁,左侧偏瘫17例,右侧偏瘫8例;C组男8例,女17例,年龄50~70岁,平均年龄(63.0±8.9)岁,左侧偏瘫12例,右侧偏瘫13例。入选标准:(1)患肢肩关节疼痛;(2)观察组知情同意使用肉毒毒素。排除标准:(1)肩关节X片显示肩关节脱位或半脱位者;(2)发病前有肩关节周围软组织损伤或肩关节骨折、手术史者;(3)注射部位发生感染者;(4)神经肌肉传导障碍者;(5)处于发热期或近7 d内服用加重神经肌肉传导抑制药物;(6)认知障碍者;(7)不愿意签署知情同意书者。所有患者均经超声检测为肩关节周围软组织损伤,其中肩峰下滑囊炎27例、肱二头肌长头肌病变(肌腱炎、腱鞘炎、积液)31例、冈上肌肌腱炎17例。
1.2 治疗方法 所有患者及家属均同意自愿参与实验调查。A组选用A型肉毒毒素注射配合常规康复治疗,A型肉毒毒素(卫生部兰州生物制品研究所)冻干结晶粉剂,规格100 U/支,每次注射剂量为100 U,用1 ml注射用水进行配置。B组患者使用曲安奈德和利多卡因的混合物进行注射,按1∶2进行配置,每次注射2 ml。所有患者均在超声引导下进行注射治疗。采用GE Logic E9、Philips iU Elite超声多普勒诊断仪,探头频率6~15 MHz,探头为线阵探头。患者取卧位,常规消毒,使用二维、彩色超声对患侧肩关节进行实时诊断引导,采用牙科穿刺针进行超声引导注射,注射部位均为病变损伤部位(肩峰下滑囊炎患者注射进入滑囊、肱二头肌长头腱和冈上肌腱病变者均注射入腱鞘,注意避免注射进入肌腱内),术后避免沐浴。常规康复训练,包括:(1)按良姿位摆放,确保患肩不受压;(2)矫正肩胛骨的姿势,用物理因子对肩关节进行治疗并对肩关节周围肌肉进行刺激;(3)肩关节主动和被动活动的诱发和引导,以及抗阻训练等;(4)采用运动想象疗法对患侧肢体进行干预。每组患者治疗以及康复干预后均密切注意观察生命体征,注意注射部位有无感染、疼痛、有无肌肉乏力等情况出现。
1.3 观察指标 (1) 采用简化Fugl-Meyer上肢功能评定量表(FMA)对治疗前后上肢运动功能进行评定。上肢运动功能总积分66分。评定分数越大,证明患者患肢功能越好。(2) 对患者肩关节疼痛的评分可通过VAS刻度尺从0(无痛)~100 mm(非常严重的疼痛)评估,分值越大,疼痛越强。(3) 对患者肩关节活动度评分,在肩关节无痛范围内采用量角器测量肩关节治疗前后被动前屈、 外展角度。对所有患者各项目在治疗前、治疗后4周时进行评分,共2次。
1.4 统计学处理 采用SPSS 11.7统计软件对数据进行分析。计量资料数据用均数±标准差(x±s)表示,2组患者治疗前后Fugl-Meyer上肢功能评定各项得分和关节活动度比较采用方差分析,治疗前后的VAS评分比较均采用配对样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 3组患者治疗前后患肢Fugl-Meyer上肢功能评分 3组治疗4周后和治疗前进行对比,患肢Fugl-Meyer上肢功能评分均有改善,差异有统计学意义(P<0.05)。A组和B组患者在治疗后4周Fugl-Meyer上肢功能评分和C组比较,均明显改善,差异有统计学意义(P<0.05)。A组Fugl-Meyer上肢功能评分和B组相比改善明显,差异有统计学意义(P<0.05)。见表1。
2.2 3组患者治疗前后患肢肩关节疼痛评分比较 3组在治疗4周后和治疗前比较患肢肩关节疼痛评分均改善,差异有统计学意义(P<0.05)。A组和B组治疗后4周肩关节疼痛评分和C组比较,均明显改善(P<0.05)。A组肩关节疼痛评分和B组比较改善明显,差异有统计学意义(P<0.05)。见表2。

表1 3组患者治疗前后Fugl-Meyer上肢功能评分比较(分,x±s)
注:与治疗前比较aP<0.05,与治疗后C组比较bP<0.05,与治疗后B组比较cP<0.05。A组为肉毒毒素治疗+常规康复组,B组为曲安奈德+常规康复组,C组为常规康复组
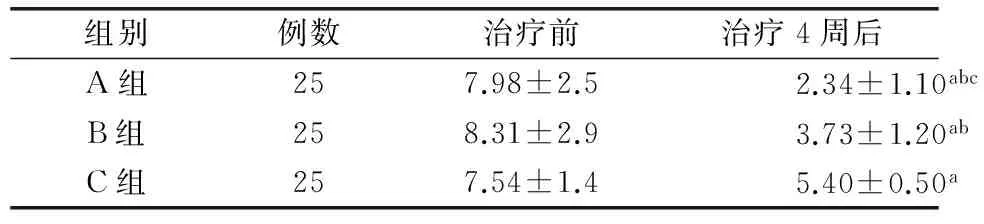
表2 3组患者治疗前后肩关节疼痛评分比较(分,x±s)
注:与治疗前比较aP<0.05,与治疗后C组比较bP<0.05,与治疗后B组比较cP<0.05。A组为肉毒毒素治疗+常规康复组,B组为曲安奈德+常规康复组,C组为常规康复组
2.3 3组患者治疗前后患肢肩关节活动度比较 3组治疗前肩关节活动度差异无统计学意义(P>0.05)。3组治疗4周后和治疗前比较,患肢肩关节活动度均改善,差异有统计学意义(P<0.05)。A组和B组患者在治疗4周后肩关节活动度和C组比较均明显改善,差异有统计学意义(P<0.05)。A组肩关节活动度和B组相比改善明显,差异有统计学意义(P<0.05)。见表3。

表3 3组患者治疗前后肩关节前屈和外展关节活动度比较(°,x±s)
注:与治疗前比较aP<0.05,与治疗后C组比较bP<0.05,与治疗后B组比较cP<0.05。A组为肉毒毒素治疗+常规康复组,B组为曲安奈德+常规康复组,C组为常规康复组
3 讨论
脑卒中后常引起一系列的并发症,这些并发症可致残或者是导致肢体功能恢复不佳,其中较常见的是患侧肩痛,国内发病率高达84%[6],它是影响脑卒中偏瘫患肢功能恢复的重要因素。脑卒中后肩痛的发病机制非常复杂,目前还没有一个确切的病因,但主要有以下几点:(1)肩关节正常功能被异常的肌张力破坏(如痉挛或者肌肉乏力),导致肩胛骨后缩,肱骨内收、内旋;(2)患侧肩关节在治疗中被采取了不正确的辅助运动,造成上肢屈曲而无肩胛骨充分前伸和旋转;(3)肩关节和肩胛骨周围肌力的不平衡;(4)康复训练时被动牵拉过度;(5)患侧肩关节由于活动性差导致一些黏性改变。以上因素可相互叠加引起肩关节囊和关节周围软组织的慢性无菌性炎症, 进而出现组织水肿, 产生关节囊和肌间粘连。不仅影响了关节活动度, 也使肩关节因炎症而产生疼痛,致肩关节功能障碍。
在临床中,针对脑卒中后患侧肩痛一般采取的都是口服止痛药物或者是通过物理因子以及针灸、制动等方式来进行治疗,但是临床效果不佳。肩痛导致后续的康复治疗不能进行,患者的康复治疗依从性变差,对患者整体的康复及时性和有效性产生巨大的阻碍。因此,寻找有效的干预方式是临床迫切需要解决的问题。A型肉毒毒素是一种神经递质传导阻滞药物,在临床上已被广泛应用于治疗局部肌肉痉挛、眼睑痉挛、面肌痉挛、痉挛性斜颈等疾病[7-8]。然而,笔者发现在疼痛的治疗中也具有良好的作用[9-10]。本研究中,笔者应用超声引导的方式将A型肉毒毒素精准地注射到患肩的病变部位。发现患者肩痛明显缓解,在后续康复训练中患者的依从性明显加强,且患者Fugl-Meyer上肢功能评分和肩关节主动活动度较其他组得到明显改善,分析原因如下:(1)A型肉毒毒素可能通过减少引起疼痛的神经递质的释放如P物质和降钙素基因相关肽等来缓解疼痛[11];(2)A型肉毒毒素的弥散作用可能使得上肢部分痉挛肌肉得到缓解,利于主动活动的诱发;(3)A型肉毒毒素缓解疼痛作用维持时间长,且可以避免不良作用的产生。在实际应用过程中根据患者实际情况采取多点或者单一点进行注射,每次用量为100 U,根据文献报道,A型肉毒毒素中毒剂量是其临床应用剂量的30~120倍[12],目前大量临床研究均未发现A型肉毒毒素治疗引起全身性或严重的不良反应的案例。在本研究中,也未观察到A型肉毒毒素治疗组出现肌力减弱、感染、过敏等并发症。
本研究仅仅观察了治疗4周之后的患者状况,并没有继续跟踪更长时间患者肩关节疼痛、活动度以及患肢功能情况,主要是由于随访的困难以及住院时间的限制。希望在今后的研究中可以延长对此类患者的观察时间,从而得出更精准的结论。
综上所述, A型肉毒毒素治疗脑卒中后肩痛结合常规康复训练,对脑卒中偏瘫患者上肢功能康复具有特殊的意义,值得在临床治疗上推广。
[1] Turner-Stokes L, Jackson D. Shoulder pain after stroke: a review of the evidence base to inform the development of an integrated care pathway[J]. Clin Rehabil, 2002, 16(3): 276-298. DOI:10.1191/0269215502cr491oa.
[2] Ratnasabapathy Y, Broad J, Baskett J, et al. Shoulder pain in people with a stroke: a population-based study[J]. Clin Rehabil, 2003, 17(3): 304-311. DOI:10.1191/0269215503cr612oa.
[3] Lindgren I, Jonsson AC, Norrving B, et al. Shoulder pain after stroke: a prospective population-based study[J]. Stroke, 2007, 38(2): 343-348. DOI:10.1161/01.STR.0000254598.16739.4e.
[4] Pong YP, Wang LY, Huang YC, et al. Sonography and physical findings in stroke patients with hemiplegic shoulders: a longitudinal study[J]. J Rehabil Med, 2012, 44(7): 553-557. DOI:10.2340/16501977-0987.
[5] Parry RH, Lincoln NB, Vass CD. Effect of severity of arm impairment on response to additional physiotherapy early after stroke[J]. Clin Rehabil, 1999, 13(3): 187-198.DOI:10.1177/026921559901300302.
[6] 刘雅丽.偏瘫后肩痛的原因与治疗[J].国外医学(物理医学与康复学分册),1999(4):149-152.
[7] Agafonova NV, Khasanova DR. The use of different doses of botulotoxin A in the treatment of early arm poststroke spasticity[J]. Zh Nevrol Psikhiatr Im S S Korsakova,2014,114(10):68-71.
[8] Grosset DG, Tyrrell EG, Grosset KA. Switch from abobotulinumtoxin A (Dysport) to incobotulinumtoxin A (Xeomin) botulinum toxin formulation: a review of 257.J Rehabil Med,2015,47(2):183-186. DOI:10.2340/16501977-1895.
[9] Zhang H, Lian Y, Ma Y, et al. Two doses of botulinum toxin type A for the treatment of trigeminal neuralgia: observation of therapeutic effect from a randomized, double-blind, placebo-controlled trial[J].J Headache Pain,2014,15:65. DOI:10.1186/1129-2377-15-65.
[10] 鲍晓,谭杰文,王呜鸿,等. A型肉毒毒素用于膝骨性关节炎治疗的临床疗效[J]. 中国康复医学杂志,2015,30(8):808-810. DOI:10.3969/j.issn.1001-1242.2015.08.013.
[11] Guo BL, Zheng CX, Sui BD, et al. A closer look to botulinum neurotoxin type A-induced analgesia[J]. Toxicon,2013,71: 134-139. DOI:10.1016/j.toxicon.2013.05.011.
[12] Dodick DW. Botulinum neurotoxin for the treatment of migraine and other primary headache disorders: from bench to bedside[J]. Headache,2003,43(Suppl 1):S25-S33. DOI:10.1046/j.1526-4610.43.7s.5.x.ases.
Clinical study of the effects of botulinum toxin injection on shoulder pain following stroke under ultrasonography
MaXiancong,ChenJingjun,YangQuan,RaoJinzhu,BaoXiao
(DepartmentofRehabilitation,YuebeiPeople′Hospital,Shaoguan510020,China)
ObjectiveTo observe the effects of botulinum toxin injection on shoulder pain following stroke under ultrasonography and the recovery of the affected limb.MethodsSeventy-five patients with shoulder pain following stroke were randomly divided into 3 groups: the botulinum toxin injection + conventional rehabilitation group (group A), the triamcinolone acetonide therapy + conventional rehabilitation group (group B), and the conventional therapy group (group C). Fugl-Meyer upper-limb function scores, VAS scores and range of shoulder motion before and after treatment were evaluated and compared between the groups.ResultsBefore treatment, there were no significant differences in Fugl-Meyer scores, VAS scores and range of motion (ROM) of shoulder for the patients of the 3 groups(P>0.05). Four weeks after treatment, Fugl-Meyer scores, VAS scores and shoulder ROM all improved, as compared with those before treatment, and statistical significance could be seen, when comparisons were made between them(P<0.05). Fugl-Meyer scores, VAS scores and shoulder ROM for the patients of group A and B improved more significantly after 4 weeks of treatment, as compared with those of group C, with statistical significance (P<0.05). More significant improvement of Fugl-Meyer scores, VAS scores and shoulder ROM could be noted in the patients of group A (49.3±7.4,2.3±1.1,103.7±11.2,91.5±7.4), when compared with those of group B (40.0±5.1,3.7±1.2,79.4±9.3,74.3±9.2)(P<0.05).ConclusionBotulinum toxin injection combined with conventional rehabilitation training in the treatment of should pain following stroke was of great significance to the recovery of upper limb function following stroke, and without any adverse reactions. For this reason, it was worth further clinical popularization.
Botulinum toxin A; Fugl-Meyer upper limb function evaluation; Stroke; Shoulder pain
R684
A
10.3969/j.issn.1009-0754.2017.06.019
2017年度韶关市卫生计生科研项目(Y17035))
510020 广东 韶关,粤北人民医院康复医学科
2017-03-23)
(本文编辑:彭润松)
