N-甲基-D-天冬氨酸受体阻断对大鼠海马神经元癫痫样放电模型泛连接蛋白-1表达的影响
2017-12-22罗海龙姜爱英郭艳芹毕鹏翔
罗海龙 贾 茜 姜爱英 郭艳芹 董 妍 毕鹏翔
(牡丹江医学院附属红旗医院神经内科,黑龙江 牡丹江 157000)
N-甲基-D-天冬氨酸受体阻断对大鼠海马神经元癫痫样放电模型泛连接蛋白-1表达的影响
罗海龙 贾 茜 姜爱英 郭艳芹 董 妍 毕鹏翔
(牡丹江医学院附属红旗医院神经内科,黑龙江 牡丹江 157000)
目的观察N-甲基-D-天冬氨酸(NMDA)受体阻断对大鼠海马神经元癫痫样放电模型神经元细胞活力,凋亡及泛连接蛋白(Panx)-1表达的影响。方法取SD新生乳鼠双侧海马,体外培养海马神经元至第9天,经鉴定的海马神经元随机分为正常对照组、模型组和MK-801(地卓西平,NMDA受体拮抗剂)组。正常对照组为正常细胞的细胞培养液培养3 h后恢复维持培养液;模型组为无镁细胞外液培养3 h后恢复维持培养液;MK-801组加入含10 μmol/L MK-801维持培养液预保护30 min,更换为无镁细胞培养液培养3 h 后恢复维持培养液。模型建立24 h后,采用细胞计数试剂盒(CCK-8)检测神经元细胞活力,分别采用末端脱氧核苷酸转移酶介导的dUTP缺口末端标记测定法(TUNEL)法和流式细胞仪膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)双染法检测神经元凋亡,采用蛋白质印迹法(Western印迹)检测神经元Panx-1表达,采用实时荧光定量PCR(Real Time-PCR)检测神经元Panx-1 mRNA表达。结果与模型组比较,MK-801组神经元细胞活力显著升高(P<0.05),神经元凋亡指数和凋亡率、Panx-1表达、Panx-1 mRNA表达显著降低(P<0.05)。结论NMDA受体阻断可抑制大鼠海马神经元癫痫样放电模型神经元损伤,发挥神经元保护作用,并抑制神经元Panx-1表达。
癫痫;N-甲基-D-天冬氨酸(NMDA)受体;泛连接蛋白(Panx)-1
癫痫(Epilepsy)是常见的神经系统疾病,发病率较脑血管疾病略低,主要表现为脑细胞突然异常的过度放电,导致脑功能失调〔1,2〕。流行病学资料显示,老年人癫痫的发病率较高,究其病因具有复杂性和多样性特点〔3〕。目前并没有彻底研究清楚癫痫的发病机制,治疗方法主要以对症治疗为主,故治疗效果往往欠佳〔4,5〕。研究发现,N-甲基-D-天冬氨酸(NMDA)受体过度激活是一个重要的导致癫痫的原因〔6,7〕。关于NMDA受体阻断对癫痫神经元的影响鲜见报道。本研究拟采用体外建立大鼠海马神经元癫痫样放电模型,观察阻断NMDA受体对模型神经元损伤的作用及对泛连接蛋白(Panx)-1的影响。
1 材料与方法
1.1实验动物 12只SPF级新生24 h内SD大鼠乳鼠,雌雄不限,体重5~12 g,由哈尔滨医科大学动物实验中心提供,实验动物使用许可证号:SYXK(黑)2015-007,实验动物合格证号:SCXK(黑)2015-001。
1.2实验药物及主要试剂 NMDA受体拮抗剂MK-801(地卓西平,纯度>98.0%,美国Apexbio公司);神经元基础培养基,B-27添加剂(美国Gibco公司);胎牛血清(美国Hyclone公司);L-多聚赖氨酸、L-谷氨酰胺、4-羟乙基哌嗪乙磺酸、甘氨酸、胰蛋白酶、Panx-1抗体、甘油醛-3-磷酸脱氢酶(GAPDH)抗体、辣根过氧化物酶标记的二抗(美国Sigma公司);细胞计数试剂盒(CCK-8,天津百萤生物科技有限公司);末端脱氧核苷酸转移酶介导的dUTP缺口末端标记测定法(TUNEL)凋亡检测试剂盒(德国Merck公司);膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)双染凋亡检测试剂盒(上海BestBio贝博生物);Trizol试剂(美国Invitrogen公司);二辛可宁酸(BCA)蛋白定量试剂盒(北京鼎国昌盛生物技术有限责任公司);增强化学发光(ECL)试剂盒(美国Amersham Bioscience公司);其他试剂均为国产或进口分析纯。
1.3主要培养液的配制 种植培养液:神经元基础培养基(90%)+ L-谷氨酰胺(0.2 mol/L)+胎牛血清(10%)+链霉素(100 mg/L)+青霉素(100 U/ml);维持培养液:神经元基础培养基(98%)+L-谷氨酰胺(0.2 mol/L)+B-27 添加剂(2%)+链霉素(100 mg/L)+青霉素(100 U/ml);无镁细胞培养液:氯化钾(2.5 mmol/L)+氯化钠(145 mmol/L)+氯化钙(2 mmol/L)+甘氨酸(0.002 mmol/L)+4-羟乙基哌嗪乙磺酸(10 mmol/L)+葡萄糖(10 mmol/L)。
1.4主要仪器 低温高速离心机(GS-15R,美国BECKMAN公司);膜片钳(EPC-10,德国NanionTechnologies);CO2培养箱(HERAcell 240i,美国Thermofisher Scientific公司);酶标仪(RT-6100,美国Rayto公司);流式细胞仪(FACScan,美国BD公司);电泳仪(PowerPac HV,美国BIO-RAD公司);转膜仪(VE-186,上海天能科技有限公司);蛋白成像系统(ChemiDoc XRS,美国BIO-RAD公司)。
1.5与海马神经元培养 取新生24 h内的SD大鼠乳鼠,体积分数75%乙醇消毒后断头取脑,置入装有预冷的D-Hank液的玻璃皿中,钝性分离双侧海马,剥除脑膜、血管,剪碎约1 mm3的小块,装入15 ml的玻璃离心管中,加入5倍于脑组织块的1.25 g/L胰蛋白酶,37℃恒温水箱水浴15 min。吸除上层胰酶后,4 ml种植培养基终止消化,漂洗组织2 次,巴氏滴管轻轻吹打细胞约20次,1 000 r/min离心5 min,弃上清,在沉淀中加种植培养液6 ml,轻轻吹打几次重悬,200目细胞筛过滤。台盼蓝染色,血细胞计数板计数活细胞,根据计数结果,以种植培养液调整细胞终浓度为1×109/L,种植于L-多聚赖氨酸包被的96孔板,37℃饱和湿度,5%CO2培养箱内进行培养。种板后10 h将培养液全量换成维持培养液,随后每3 d 半量换液。
1.6海马神经元鉴定 海马神经元培养至第9天,以神经微丝免疫组化染色鉴定神经元,倒置显微镜下观察神经元胞质内和轴突内棕黄色阳性颗粒。
1.7大鼠海马神经元癫痫样放电模型的建立及给药 海马神经元培养至第9天,随机分为正常对照组,模型组和MK-801组。正常对照组更换为正常细胞的细胞培养液培养3 h后恢复维持培养液;模型组更换为无镁细胞外液培养3 h后恢复维持培养液,采用EPC-10 膜片钳系统进行全细胞模式的电压钳记录海马神经元动作电位变化,以检测到频发的动作电位发放表示模型建立成功〔8〕;MK-801组加入含10 μmol/L MK-801维持培养液预保护30 min〔9〕,更换为无镁细胞培养液培养3 h 后恢复维持培养液。各组于37℃饱和湿度,5% CO2培养箱内继续培养24 h。每组设6个平行孔。
1.8CCK-8检测神经元细胞活力 实验分组、模型建立及给药同“1.7”。检测过程参照CCK-8检测试剂盒操作说明书进行。RT-6100酶标仪于450 nm波长处测定吸光度值(OD)。
1.9TUNEL法 采用TUNEL凋亡检测试剂盒检测神经元凋亡指数,严格按照试剂盒的说明书进行操作。荧光显微镜下观察荧光变化,凋亡神经元核和(或)神经元碎片发出绿色荧光,未凋亡神经元(正常神经元)核发出蓝色荧光。随机选取10个高倍视野(200×),记录每个视野内的绿色荧光及蓝色荧光神经元数,并计算凋亡率。凋亡率=(视野内凋亡神经元数/视野内神经元总数)×100%。
1.10流式细胞仪AnnexinV-FITC/PI双染法 实验分组,模型建立及给药同“1.7”。各组1 200 r/min离心5 min,收集细胞,1 ml磷酸盐缓冲液(PBS)冲洗2次,500 μl结合缓冲液重悬成单细胞悬液,依次加入Annexin V-FITC和碘化丙啶(Propidiumiodide)液各5 μl混匀,室温避光反应15 min。1 h内以FACScan流式细胞仪检测神经元细胞凋亡情况,计算凋亡率。凋亡率=右下象限的早期凋亡神经元百分率+右上象限的晚期凋亡神经元百分率。
1.11蛋白质印迹法(Western印迹)检测神经元Panx-1的表达 收集分组培养的细胞,严格按照试剂盒说明书提取总蛋白,BCA法测定总蛋白浓度。取50 μg蛋白上样后进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离,当电泳完成后,电转膜仪转膜至0.45 μm聚偏氟乙烯(PVDF)膜上,5%脱脂奶粉封闭2 h。与Panx-1抗体(1∶500稀释),GAPDH抗体(1∶2 000稀释)4℃孵育过夜,1×吐温20 Tris盐酸缓冲液(TBS-T)洗膜后加辣根过氧化物酶标记的二抗(1∶1 000稀释)孵育2 h。ECL试剂显色。ChemiDoc XRS蛋白成像系统对各组条带进行灰度值计值。
1.12实时荧光定量PCR(Real Time-PCR)检测神经元Panx-1 mRNA的表达 Trizol试剂提取总RNA,检测RNA纯度,按照Real Time-PCR试剂盒进行反转录反应,合成单链的cDNA。cDNA产物保存在-20℃。利用Pubmed查找相关基因序列,并利用引物合成软件Primer Premier 5.0设计引物。Real Time-PCR反应体系:体积为20 μl;反应程序为:95℃预变性10 s,50℃退火15 s,72℃延伸20 s,共40个循环,最后72℃ 延伸5 min。每个样本以内参基因GAPDH调整。2-ΔΔCT法定量分析。引物序列为:Panx-1,正义TCTGCTCCGACCTGAA,反义GAAGAGCGTGTAGATGACC,168 bp;GAPDH,正义GAGGGAAATCGTGCGTGAC,反义GCATCGGAACCGCTCATT,212 bp。
1.13统计学分析 采用SPSS17.0软件进行单因素方差分析及LSD法检验。
2 结 果
2.1海马神经元鉴定结果 神经元胞质内和轴突内有大量棕黄色阳性颗粒,表明培养获得的海马神经元纯度相对较高。见图1。
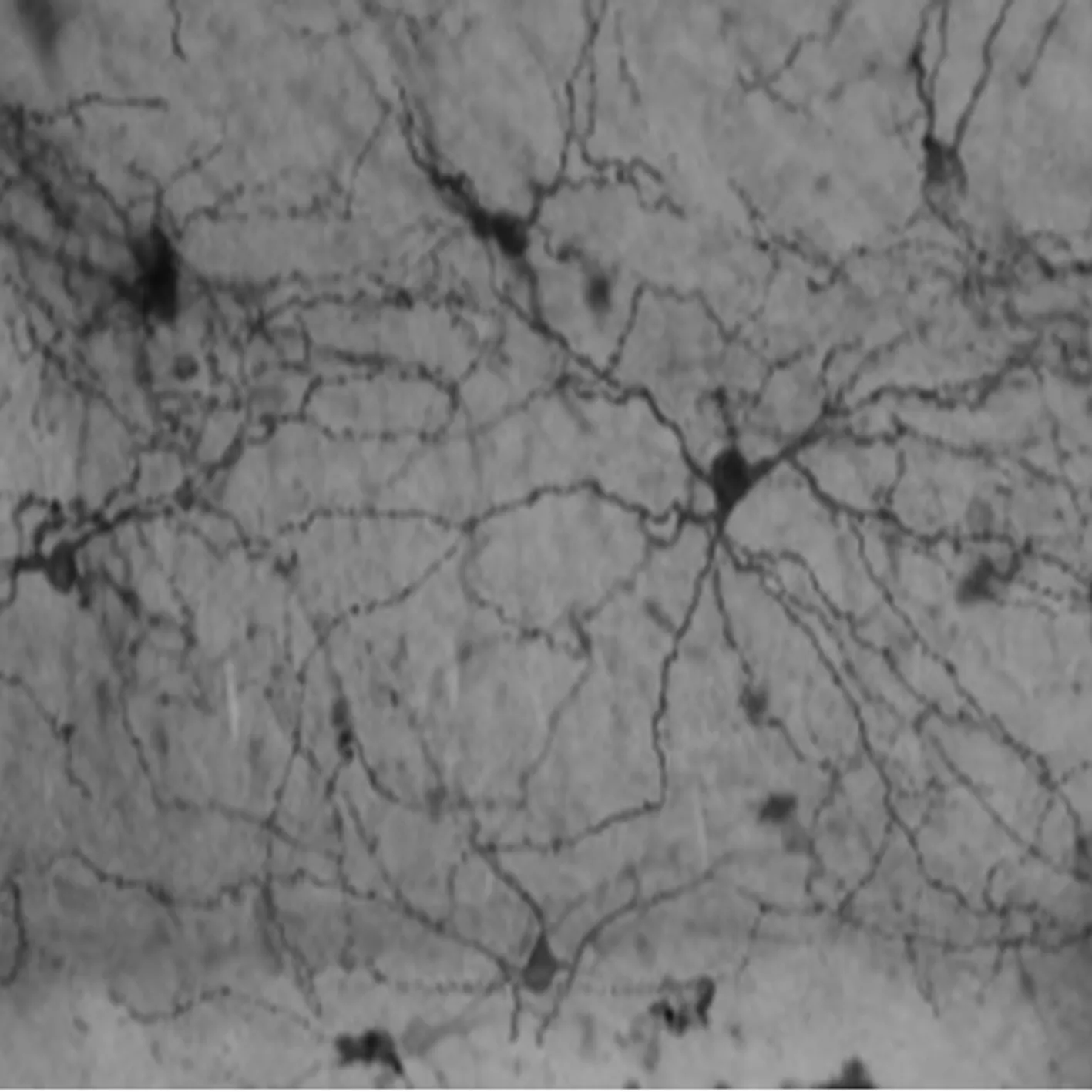
图1 海马神经元神经微丝免疫组化染色结果(神经微丝免疫组化染色,×100)
2.2CCK-8检测结果 与正常对照组〔(100.00±0.00)%〕比较,模型组海马神经元细胞活力〔(79.38±2.31)%〕显著降低(P<0.05),表明大鼠海马神经元癫痫样放电模型中存在神经元损伤;与模型组比较,MK-801组海马神经元细胞活力〔(92.06±2.74)%〕显著升高(P<0.05),表明阻断NMDA受体可减轻大鼠海马神经元癫痫样放电模型神经元损伤。
2.3NMDA受体阻断对大鼠海马神经元癫痫样放电模型神经元凋亡的影响
2.3.1TUNEL染色检测结果 与正常对照组〔(9.72±0.54)%〕比较,模型组海马神经元凋亡指数〔(47.26±2.37)%〕显著升高(P<0.05);与模型组比较,MK-801组海马神经元凋亡指数〔(23.76±2.11)%〕显著降低(P<0.05)。见图2。
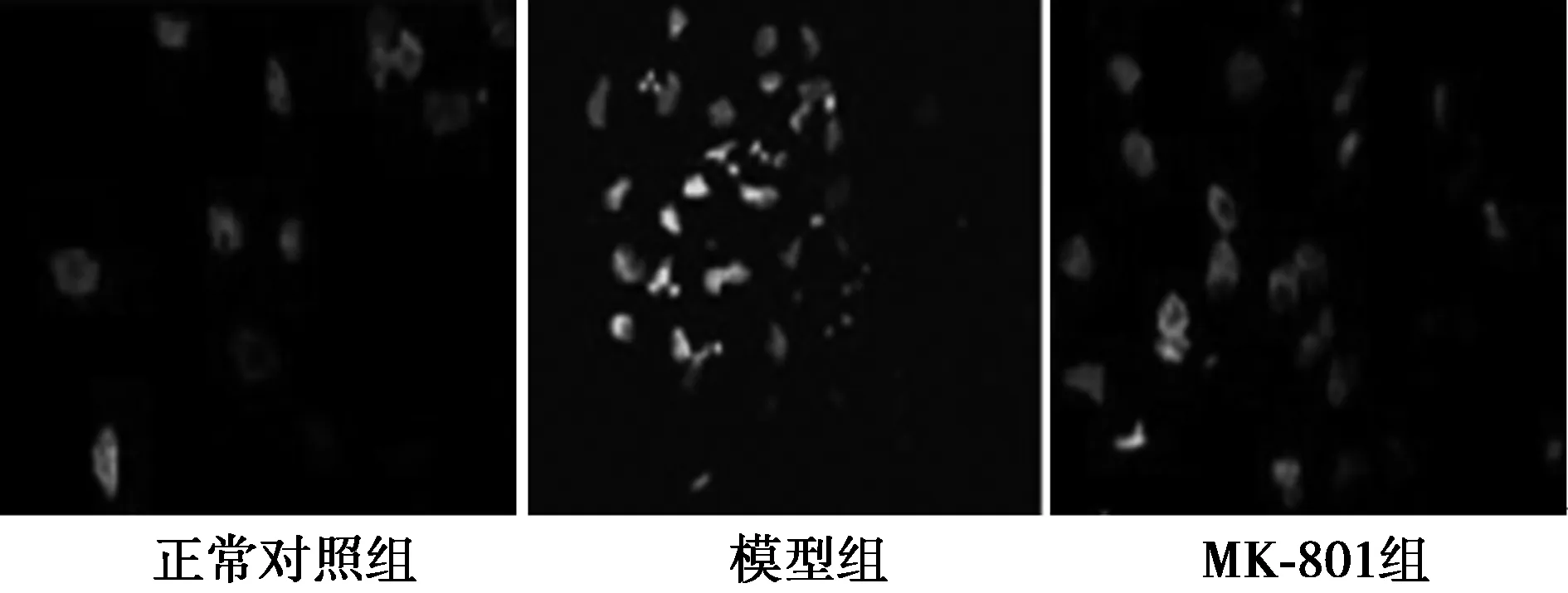
图2 各组神经元凋亡TUNEL染色结果(×200)
2.3.2AnnexinⅤ-FITC/PI双染流式细胞术检测结果 与正常对照组〔(8.31±0.62)%〕比较,模型组海马神经元凋亡率〔(46.42±3.95)%〕显著升高(P<0.05);与模型组比较,MK-801组海马神经元凋亡率〔(34.67±2.71)%〕显著降低(P<0.05)。见图3。
2.4NMDA受体阻断对大鼠海马神经元癫痫样放电模型Panx-1表达的影响 与正常对照组(0.845±0.045)比较,模型组海马神经元Panx-1表达(2.202±0.120)显著升高(P<0.05);与模型组比较,MK-801组海马神经元Panx-1表达(0.996±0.052)显著降低(P<0.05)。见图4。

图3 AnnexinⅤ-FITC/PI双染流式细胞术结果

图4 各组Panx-1表达Western印迹结果
2.5NMDA受体阻断对大鼠海马神经元癫痫样放电模型神经元Panx-1 mRNA表达的影响 与正常对照组(0.347±0.028)比较,模型组海马神经元Panx-1 mRNA表达(0.681±0.112)显著升高(P<0.05);与模型组比较,MK-801组海马神经元Panx-1 mRNA表达(0.471±0.033)显著降低(P<0.05)。
3 讨 论
我国癫痫患病率为5‰,老年人癫痫的发生率居所有人群之首〔10,11〕。研究发现,NMDA受体与癫痫的关系非常密切〔12〕。NMDA受体是神经元中一种重要的配体依赖的电压门控的选择性钙离子通道,由NR1亚单位与NR2亚单位(NR2A-NR2D)构成,因具有电压依赖性的Mg2+阻断特性及对钙离子的高通透性这一特性,使得NMDA受体在兴奋毒性表现重要的作用〔13〕。NMDA受体在全脑几乎都有分布,主要在杏仁体、纹状体、大脑皮质、海马等部位分布最多〔14〕。当机体处于某些病理状态,导致谷氨酸在细胞内的含量升高,引起NMDA受体过度激活,解除了内源性Mg2+的阻滞作用,过多的神经元的突触后膜发生同步性去极化,发生持续性放电,最后引起癫痫的发生〔15〕。癫痫可表现为脑神经元异常放电〔16,17〕。本研究提示NMDA受体阻断可抑制大鼠海马神经元癫痫样放电模型神经元损伤,发挥神经元保护作用。
Panx-1是新型缝隙连接蛋白Pannexin家族中的成员之一,可通过形成半通道来发挥作用,在炎症、肿瘤、脑缺血、癫痫等病理过程具有重要的意义〔18〕。在海马中,主要以椎体神经元中可见Panx-1表达,NMDA受体激活可触发Panx-1通道开放,进而引起癫痫的发生〔19〕。降低Panx-1表达将对癫痫的治疗产生有利影响。NMDA受体阻断可以抑制大鼠海马神经元癫痫样放电模型神经元损伤,发挥神经元保护作用,并抑制神经元Panx-1表达。
1Dharmadhikari AS,Sinha VK.Psychiatric comorbidity in children with epilepsy:a cross-sectional 5 years rural prevalence study〔J〕.J Neurosci Rural Pract,2017;8(2):179-84.
2Hansen J,Åsberg S,Kumlien E,etal.Cause of death in patients with poststroke epilepsy:results from a nationwide cohort study〔J〕.PLoS One,2017;12(4):e0174659.
3赵新春,邢效如.癫痫发病机制和治疗的研究进展〔J〕.中国民康医学,2015;27(18):74-6,80.
4Pavone C,Giacalone N,Vella M,etal.Relation between sexual dysfunctions and epilepsy,type of epilepsy,type of antiepileptic drugs:a prospective study〔J〕.Urologia,2017;84(2):88-92.
5Ochoa-Gomez L,Lopez-Pison J,Fernando-Martinez R,etal.A descriptive study of non-symptomatic epilepsy according to age at onset at a neuropediatric section of regional reference〔J〕.Rev Neurol,2016;63(10):447-54.
6Schidlitzki A,Twele F,Klee R,etal.A combination of NMDA and AMPA receptor antagonists retards granule cell dispersion and epileptogenesis in a model of acquired epilepsy〔J〕.Sci Rep,2017;7(1):12191.
7Addis L,Virdee JK,Vidler LR,etal.Epilepsy-associated GRIN2A mutations reduce NMDA receptor trafficking and agonist potency-molecular profiling and functional rescue〔J〕.Sci Rep,2017;7(1):66.
8董长征,赵文清,李文玲,等.大鼠海马神经元癫痫样放电模型的构建〔J〕.河北医药,2014;36(14):2093-5.
9马 融,杨常泉,刘全慧,等.熄风胶囊、茸菖胶囊、抗痫胶囊对海马神经元NMDA受体电流及细胞内游离钙的影响〔J〕.中药药理与临床,2015;31(6):140-2.
10常 琳,王小姗.中国癫痫流行病学调查研究进展〔J〕.国际神经病学神经外科学杂志,2012;39(2):161-4.
11黄远桂.脑卒中与癫痫〔J〕.中华老年心脑血管病杂志,2013;15(5):449-51.
12焦 聚,马 融,任献青.NMDA受体及其与癫痫所致认知功能损害的关系〔J〕.中国中西医结合儿科学,2014;6(3):215-8.
13贾祥磊,张继川.N-甲基-D-天冬氨酸受体在可卡因成瘾中作用的研究进展〔J〕.中国老年学杂志,2015;35(21):6285-8.
14夏春凤,李艳菊,朱 瑾,等.二氮嗪预处理对Aβ(1~42)作用神经元NR2B亚基蛋白表达的影响〔J〕.中国老年学杂志,2015;35(2):401-4.
15彭毓棻,宋 治.NMDA 受体在癫痫发病机制中的作用〔J〕.中国病理生理杂志,2011;27(6):1230-3,1239.
16张翠芳.平痫颗粒对老年外伤性癫痫患者肿瘤坏死因子-α、白细胞介素-6、C反应蛋白的影响〔J〕.中国老年学杂志,2015;35(17):4992-3.
17施晓莉.老年急性脑梗死患者脑电图异常与癫痫发作的关系〔J〕.中国老年学杂志,2015;35(13):3612-3.
18翟婷婷,高志伟,姜正林,等.左乙拉西坦对戊四氮激发癫痫大鼠海马区Panx1表达的影响〔J〕.江苏医药,2013;39(23):2807-10.
19孔祥兴,李彬寅,管晓静,等.Pannexin1的分布及其开放调控〔J〕.生理科学进展,2013;44(3):188-92.
R742
A
1005-9202(2017)23-5752-04;
10.3969/j.issn.1005-9202.2017.23.004
黑龙江省卫生计生委科研课题(2016-382);黑龙江省中医药科研项目(2HY16-019);牡丹江市科学技术计划项目(Z2016s0084)
毕鹏翔(1980-),男,硕士,副主任医师,主要从事癫痫及头痛研究。
罗海龙(1977-),男,硕士,副主任医师,主要从事癫痫及脑血管病研究。
〔2016-12-25修回〕
(编辑 王一涵)
