控制减压与开颅常规减压治疗重型颅脑损伤的对照研究
2017-12-21蔡舒管义祥
蔡舒 管义祥
(南通大学附属海安人民医院神经外科,江苏海安 226600)
控制减压与开颅常规减压治疗重型颅脑损伤的对照研究
蔡舒 管义祥
(南通大学附属海安人民医院神经外科,江苏海安 226600)
目的:对比控制减压与开颅常规减压治疗重型颅脑损伤(severe traumatic brain injury,sTBI)的效果与安全性。方法:整理我院2015年5月~2016年3月收治的132例sTBI患者的临床资料,按照其减压术式,将接受标准大骨瓣开颅快速减压治疗的64例患者纳入常规减压组,将接受阶梯式控制减压治疗的68例患者纳入控制减压组,比较两组患者颅内压、神经功能缺损评分变化,以及并发症发生情况、预后情况。结果:两组患者术后颅内压、术后1个月神经功能缺损评分均较术前下降,控制减压组术后1 d~术后5 d颅内压均低于常规减压组,其术后1个月神经功能缺损评分亦低于后者,差异有统计学意义(P<0.05)。控制减压组术后急性脑膨出、迟发性颅内血肿及大面积脑梗死发生率均低于常规减压组,其整体预后质量优于常规减压组,差异有统计学意义(P<0.05)。结论:控制减压可进一步提高颅内压控制效果、降低术后并发症发生率,较开颅常规减压治疗sTBI具有更为理想的疗效与安全性。
控制减压;常规减压;重型颅脑损伤;对照研究
重型颅脑损伤(severe traumatic brain injury,sTBI)是指格拉斯哥昏迷评分(GCS)≤8分、伤后昏迷>6 h或伤后24 h内意识恶化、再次昏迷6 h以上的外伤性颅脑损伤[1]。一项国外调查研究表明,sTBI年发病率约为14/10万,患者病死率可达33%,其病死原因与颅内压升高所致脑组织缺血缺氧、脑疝有关[2]。当前临床常用的标准大骨瓣开颅快速减压术式虽然效果确切,但易导致急性脑膨出、迟发性颅内血肿、术后大面积脑梗死等并发症,安全性不够理想[3]。近年来,越来越多的神经外科医生开始关注控制减压术[4]。为总结控制减压的疗效与安全性,本研究选取132例患者进行了回顾性分析如下。
1 资料与方法
1.1 对象
2015年5月—2016年3月我院sTBI患者排除合并原发性脑干损伤者[5]、合并重大脏器疾病、感染性疾病、凝血功能异常者。64例行标准大骨瓣开颅快速减压术(常规减压组)。68例接受阶梯式控制减压治疗(控制减压组),手术准备及骨瓣去除方法同标准大骨瓣减压术[6],骨瓣去除后,使用咬骨钳将蝶骨嵴咬除,给予250 mL 20%甘露醇静滴+40~80 mg呋塞米静推,并增加吸氧浓度,过度换气约30 min后,于硬脑膜下剪开数个小口缓慢放出血肿,而后于外侧裂附近硬膜上作弧形切口,经外侧裂处置入颅内压监测探头,深度需超过2 cm,缓慢释放外侧裂处血性脑脊液、附近血肿,将颅内压下降速度控制在10~15 mmHg/min;待颅内压降至20 mmHg以下后,即可放射状剪开硬膜,充分清除颅内血肿及坏死脑组织,必要时切除颞极脑组织行内减压;患者颅内压持续保持在20 mmHg以下时,即可使用人工硬膜减张缝合修补,留置引流管,关颅[7]。
1.2 疗效评价
比较两组术前、术后1 d、术后3 d及术后5 d颅内压变化;神经功能缺损评分分别于术前、术后1个月进行评价,评价方法参照相关文献[8],总分0~45分,评分越高则神经功能缺损越严重;预后情况于末次随访时参照格拉斯哥预后评分(GOS)予以判定[9]:1级:死亡;2级:植物生存;3级:重残;4级:中残;5级:恢复良好。
1.3 统计学分析
对本临床研究的所有数据采用SPSS18.0进行分析,性别、并发症发生率等计数资料以(n/%)表示,并采用χ2检验或秩和检验,年龄、颅内压、神经功能缺损评分等计量资料以()表示,并采用t检验,以P<0.05为差异有统计学意义。
2 结果
两组患者年龄、性别、术前GCS评分、致伤原因、损伤类型等基线资料比较,差异无统计学意义(P>0.05),本临床研究具有可比性。见表1。
两组患者术后颅内压均较术前下降,控制减压组术后1 d~术后5 d颅内压均低于常规减压组,差异有统计学意义(P<0.05)。两组患者术后1个月神经功能缺损评分均较术前下降,控制减压组术后1个月神经功能缺损评分低于常规减压组,差异有统计学意义(P<0.05)。见表2。
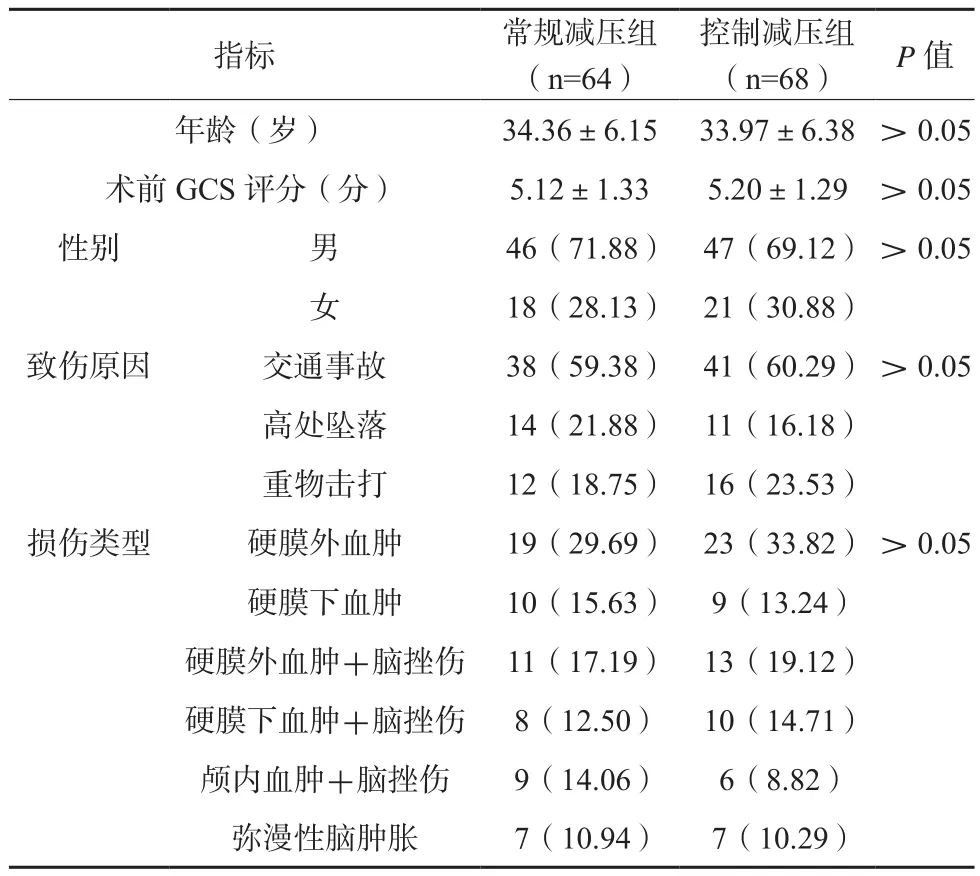
表1 两组患者基线临床资料比较(n/%)
表2 两组术后指标变化()
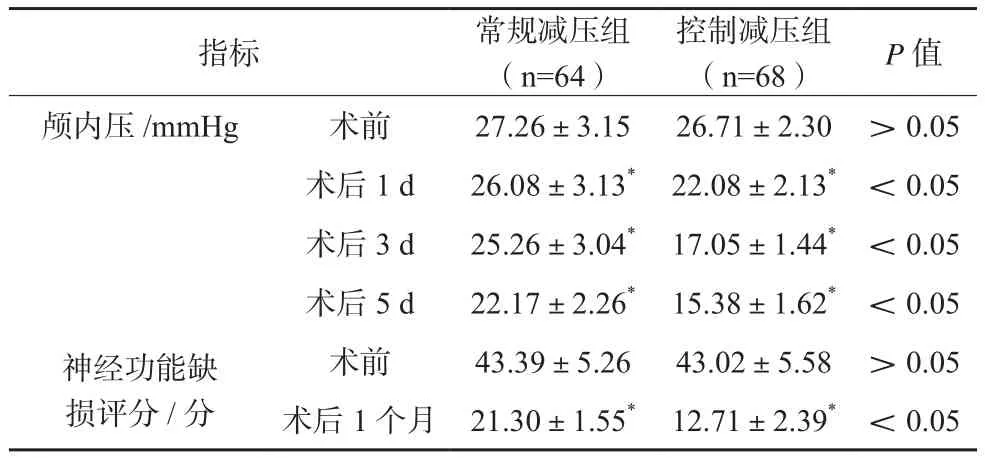
表2 两组术后指标变化()
注:与术前比较,*P<0.05
指标 常规减压组(n=64)控制减压组(n=68) P值颅内压/mmHg 术前 27.26±3.15 26.71±2.30 >0.05术后1 d 26.08±3.13* 22.08±2.13* <0.05术后3 d 25.26±3.04* 17.05±1.44* <0.05术后5 d 22.17±2.26* 15.38±1.62* <0.05神经功能缺损评分/分术前 43.39±5.26 43.02±5.58 >0.05术后1个月 21.30±1.55* 12.71±2.39* <0.05
控制减压组术后急性脑膨出7例(10.29%)、迟发性颅内血肿9例(13.24%)、大面积脑梗死4例(5.88%),发生率均低于常规减压组,差异有统计学意义(P<0.05)。控制减压组患者整体预后质量优于常规减压组,差异有统计学意义(P<0.05)。见表3。

表3 两组患者末次随访时预后结局比较(n/%)
3 讨论
sTBI的病理生理改变以脑水肿所致恶性颅内压升高为主,持续性高颅压可导致脑组织继发性损伤进一步加剧,因此,及时有效地降低颅内高压、预防继发性脑损伤,是控制病情、保证治疗效果、改善患者预后质量的关键[10]。既往去骨瓣减压术无法充分暴露额极、颞极及颅底,仅能做到局部减压,无法彻底清除坏死组织,减压效果不够理想[11-12]。当前标准大骨瓣减压术减压窗面积大、范围广、位置低,能够做到颅内血肿及坏死组织的彻底清除,并通过去除额、颞、顶等部位的颅骨和硬脑膜扩大切开减张缝合,达到充分降低颅内压的目的[13]。然而,随着标准大骨瓣减压术的普及,越来越多的学者发现,术中血肿的快速清除与颅内压的迅速下降可导致颅内血流动力学骤变,进而引发脑组织缺血-再灌注损伤的发生[14];与此同时,sTBI患者往往伴有血管运动中枢受损,此时盲目开展快速减压可直接引发脑血管调控失常,并导致脑血管通透性上升、脑水肿加剧[15]。因此,术中颅内压迅速降低、压力填塞效应突然消失后,患者极易出现急性脑膨出、迟发性颅内血肿、大面积脑梗死等并发症[16]。本研究常规减压组各类并发症发生率均高于控制减压组,且患者死亡率达到15.63%,印证了开颅常规减压在sTBI治疗方面的弊端。
与开颅常规减压相比,控制减压以标准大骨瓣减压术为基础,利用颅内压监测仪控制颅内压下降速度,达到可视化控制颅内压的效果,不仅具有术野暴露充分、止血彻底等特点,还具有快速减压的可控优势,故能够有效降低术后并发症发生风险[17]。与此同时,在颅内压变化、神经功能缺损评分变化的观察中,亦可发现控制减压组患者颅内压降低与神经功能缺损评分改善更为理想,其原因可能与颅内压下降速度相对平稳有关,术中压力梯度的稳定变化能够有效保护脑组织血管,从而促进术后神经功能恢复,提高患者预后质量[18]。这一机制也是保证控制减压组患者末次随访时整体预后质量优于常规减压组的主要原因。可见,控制减压在降低并发症发生率、改善患者预后质量方面较常规减压有着更大的优势,有望成为sTBI的首选外科治疗术式。
[1] JIANG Y Z, LAN Q, WANG Q H, et al. Gradual and controlled decompression for brain swelling due to severe head injury[J].Cell Biochem Biophys, 2014, 69(3): 461-466.
[2] CHARRY J D, RUBIANO A M, NIKAS C V, et al. Results of early cranial decompression as an initial approach for damage control therapy in severe traumatic brain injury in a hospital with limited resources[J]. J Neurosci Rural Pract, 2016, 7(1): 7.
[3] ANDREWS P J D, SINCLAIR H L, RODRIGUEZ A, et al.Hypothermia for intracranial hypertension after traumatic brain injury[J]. N Engl J Med, 2015, 373(25): 2403-2412.
[4] 孟庆海, 潘文勇. 控制性阶梯式减压术在重症颅脑损伤手术中的应用[C]// 天坛全国神经创伤学术研讨会. 2013.
[5] GHOSH A K, PIEK J, BALAN C, et al. Different Methods and Technical Considerations of Decompressive Craniectomy in the Treatment of Traumatic Brain Injury: A Review[J]. Indian J Neurosurg, 2017, 6(1): 036-040.
[6] SZCZYGIELSKI J, MÜLLER A, MAUTES A E, et al. Selective Brain Hypothermia Mitigates Brain Damage and Improves Neurological Outcome after Post-Traumatic Decompressive Craniectomy in Mice[J]. J Neurotrauma, 2017, 34(8): 1623-1635.
[7] MAEKAWA T, YAMASHITA S, NAGAO S, et al. Prolonged mild therapeutic hypothermia versus fever control with tight hemodynamic monitoring and slow rewarming in patients with severe traumatic brain injury: a randomized controlled trial[J]. J Neurotrauma, 2015, 32(7): 422-429.
[8] SZCZYGIELSKI J, MAUTES A E, MÜLLER A, et al.Decompressive craniectomy increases brain lesion volume and exacerbates functional impairment in closed head injury in mice[J]. J Neurotrauma, 2016, 33(1): 122-131.
[9] CHARRY J D, RUBIANO A M, PUYANA J C, et al. Damage control of civilian penetrating brain injuries in environments of low neuro-monitoring resources[J]. Br J Neurosurg, 2016, 30(2):235-239.
[10] STOCCHETTI N, ZOERLE T, CARBONARA M. Intracranial pressure management in patients with traumatic brain injury: an update[J]. Curr Opin Crit Care, 2017, 23(2): 110-114.
[11] HARTINGS J A, VIDGEON S, STRONG A J, et al. Surgical management of traumatic brain injury: a comparativeeffectiveness study of 2 centers[J]. J Neurosurg, 2014, 120(2):434-446.
[12] 沈亮, 苏忠周, 周跃, 等. 控制减压治疗重型颅脑损伤的Meta分析[J]. 中华创伤杂志, 2016, 32(5): 406-409.
[13] DEKOMPRESYON Ş K T T K, ÇALIŞMA B Ö. Controlled decompression for the treatment of severe head injury: a preliminary study[J]. Turk Neurosurg, 2014, 24(2): 214-220.
[14] 李文化,张波,庄会林,等.重型颅脑损伤患者术后发生迟发性血肿影响因素及其预后质量分析[J].现代仪器与医疗,2017,23(2):34-35.
[15] CANTU D, WALKER K, ANDRESEN L, et al. Traumatic brain injury increases cortical glutamate network activity by compromising GABAergic control[J]. Cereb Cortex, 2014,25(8): 2306-2320.
[16] 费舟, 章翔, 高大宽,等. 重型颅脑损伤4462例诊治分析[C]//全国创伤学术会议暨2009海峡两岸创伤医学论坛. 2009:583-586.
[17] ROSSI-MOSSUTI F, FISCH U, SCHOETTKER P, et al. Surgical treatment of severe traumatic brain injury in Switzerland:results from a multicenter study[J]. J Neurol Surg A Cent Eur Neurosurg, 2016, 77(1): 36-45.
[18] DHILLON R S, PARKER J, SYED Y A, et al. Axonal plasticity underpins the functional recovery following surgical decompression in a rat model of cervical spondylotic myelopathy[J]. Acta Neuropathol Commun, 2016, 4(1): 89.
R651.1
A
2095-5200(2017)06-100-03
10.11876/mimt201706040
蔡舒,硕士,主治医师,研究方向:神经外科临床,Email:497149693@qq.com。
