胃癌组织中TS和β-Tubulin的表达研究
2017-12-21江雨璐张敏王亮何杰
江雨璐 张敏 王亮 何杰
(安徽省肿瘤医院病理科,合肥 230032)
胃癌组织中TS和β-Tubulin的表达研究
江雨璐 张敏 王亮 何杰
(安徽省肿瘤医院病理科,合肥 230032)
目的:检测胃癌组织中胸苷酸合成酶(TS)和β微管蛋白(β-Tubulin)mRNA的表达情况,探讨其临床意义。方法:应用实时逆转录PCR技术对胃癌组织和相应癌旁正常胃组织的TS和β-Tubulin的mRNA进行检测,分析TS和β-Tubulin mRNA表达与临床病理特征的关系及两者之间的相关性。结果:胃癌组织TS、β-Tubulin的mRNA高表达率与正常胃组织比较,差异有统计学意义;不同分化程度、不同浸润深度的胃癌组织标本β-Tubulin高表达率差异具有统计学意义(P<0.05);TS和β-Tubulin mRNA表达之间呈弱正相关。结论:胃癌组织中TS、β-Tubulin表达高于正常胃组织,且低分化程度和浸润深度高的胃癌组织中β-Tubulin表达高于高分化程度和浸润程度低的胃癌组织。
胃癌;胸苷酸合成酶;β微管蛋白
胸苷酸合成酶(TS)是核酸及氟尿嘧啶体内代谢通路的关键酶[1],β微管蛋白(β-Tubulin)可参与细胞的物质运输、有丝分裂及形状改变等多个环节[2],两种分子标志物在乳腺癌、食管癌、肺癌等多种恶性肿瘤诊断及疗效预测中的价值已得到广泛认可[3-4]。此次研究使用实时逆转录PCR技术(quantitative Real-time RT-PCR)检测胃癌组织中TS和β-Tubulin的mRNA表达,探讨其临床参考价值。
1 资料与方法
1.1 一般资料
此次研究采用回顾性对照分析方法。选取我院2014年5月至2016年12月收治的95例胃癌患者,均行手术切除,临床资料完整,术前均未接受放、化疗。95例患者中,男77例,女18例,年龄20~81岁,平均(59.87±11.63)岁,临床分期:IA期6例,IB期8例,IIA期7例,ⅡB期13例,ⅢA期12例,ⅢB期26例,IIIC期15例,Ⅳ期8例;分化程度:高分化14例,中分化48例,低分化33例;浸润深度:T1期9例,T2期12例,T3期17例,T4期57例。
1.2 标本检测
1.2.1 检测方法 术中取癌、癌旁正常胃组织,石蜡包埋切片,使用实时逆转录PCR检测95例胃癌组织和相对应正常胃组织标本TS、β-Tubulin的mRNA表达情况。石蜡组织RNA提取试剂盒由OMEGA公司提供,逆转录试剂盒和SybrGreen荧光染料,均由ABI公司提供。主要操作步骤:1)使用TS、β-Tubulin特异性引物,从总RNA逆转录cDNA:10×RTmix、TS或β-Tubulin特异性引物、dNTPs、H2O各1.6 μL,RNase抑制剂、RNase各0.8 uL,加上稀释后个总RNA 8 uL,反应体积共16 μL。反应程序 :25℃ 10 min,42℃ 6 min,94℃ 5 min,4℃冷却 8 min。2)于毛细玻璃管内以特异性双标荧光探针及特异基因引物在定量PCR仪上行PCR扩增反应,总反应体积为20 μL,其中FastStart反应混合液2 μL,TS、β-Tubulin检测混合液 6 μL,MgCL225 mmol/L,H2O 6.4 μL,cDNA 4 μL。扩增程序:95℃预孵5 min,95℃变性、62℃退火、72℃延伸各10 s,循环40次;40℃冷却30 s。引物如下:
β-Actin-F: AGCCATGTACGTTGCTATCCA
β-Actin-R: GTCACCGGAGTCCATCACGAT
TS-F: ACCAACCCTGACGACAGAAG
TS-R: CATGTCTCCCGATCTCTGGT
β-Tubulin-F:GCTGCA ACTTCACAAGGTCAAG
β-Tubulin-R: CTCGCCTCACCTCTGTTTTC
1.2.2 结果判读 以与TS、β-Tubulin基因扩增动力学相似的β-actin作为内参照,每样本重复3次,2-△△CT法进行比较,当2-△△CT≥2时,判定为高表达,<2判定为低表达。
1.3 分析方法
数据运用SPSS19.0软件统计分析,不同临床病理特征组织标本TS和β-Tubulin的mRNA表达采用χ2检验,TS和β-Tubulin的mRNA表达之间的关系用Spearman等级相关分析。
2 结果
胃 癌 组 织 TSmRNA 高 表 达 率 27.36%(26/95),β-Tubulin mRNA高表达率33.68%(32/95)。癌旁正常胃组织TS mRNA高表达率2.1%(2/95)、β-Tubulin mRNA高表达率1.05%(1/95)。胃癌组织TS、β-Tubulin mRNA高表达率与正常胃组织比较,差异有统计学意义。
不同分化程度、不同浸润深度患者的胃癌组织标本的β-Tubulin高表达率比较,差异有统计学意义(P<0.05)。见表1。
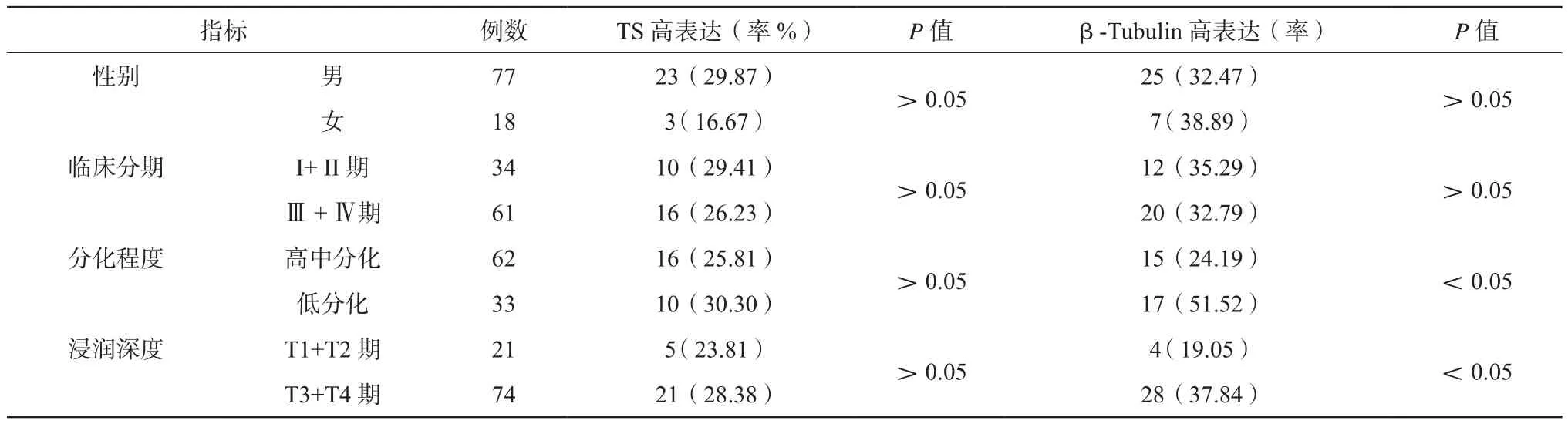
表1 胃癌组织标本TS和β-Tubulin高表达率与临床病理特征的关系
如表2所示,TS和β-Tubulin的mRNA表达之间弱正相关,r=0.491,P< 0.05。

表2 TS和β-Tubulin的mRNA表达相关性分析
3 讨论
我国每年新发胃癌患者约40万,约占世界胃癌新发患者的40%以上,即便给予规范、系统、有效的治疗,患者仍有较高的死亡率和复发、转移风险[10-11]。因此,对胃癌早期筛查诊断及疗效预测分子标志物的探索一直在进行。
TS是胸苷酸合成的起始酶,与肿瘤DNA的合成速度具有密切关联性,也被认为是氟尿嘧啶类药物的主要作用靶点,且其表达情况与非小细胞肺癌患者化疗药物的敏感性密切相关[12]。此次研究胃癌组织中TS高表达率27.36%,而正常组织TS高表达率为2.10%。有研究报道印戒细胞癌病灶组织TS阳性率达到100%[13],其可能是促进印戒细胞癌发生、进展的重要分子标志物,由于TS是DNA合成环节中的重要限速酶,TS过度表达的癌细胞往往具有较高的生长潜能[14]。过往有学者就TS对胃癌化疗效果的临床预测价值进行了分析,得到结论为TS阴性者较TS阳性者有着更高的化疗有效率,其原因与TS调节P53表达从而影响细胞周期、肿瘤细胞增殖的机制有关[15]。但本研究未就癌症病理分型进行分析,可能TS高表达的印绒细胞癌占比较少,未显现出TS高表达与临床分期及浸润深度的相关性。
作为紫杉醇类药物的作用靶点,β-Tubulin与细胞增殖、分化以及肿瘤的发生发展密切相关[16]。Ma等[17]报道恶性肿瘤组织β-Tubulin III高表达提示预后不良。本研究中胃癌组织标本β-Tubulin高表达与肿瘤分化程度、浸润深度相关,其敏感性高于TS。在临床疗效观察中,已有报道β-Tubulin表达改变可对使患者DFS、OS明显缩短,其原因可能与细胞骨架结构稳定性下降、动力性上升有关[18]。
综上所述,胃癌组织中TS和β-Tubulin均呈高表达状态, TS、β-Tubulin表达情况的观察,对于胃癌的深入诊断有着积极作用,后续可重新设计实验观察二者与临床疗效及预后的关系。
[1] HE W, ZHANG D, JIANG J, et al. The relationships between the chemosensitivity of human gastric cancer to paclitaxel and the expressions of class III β-tubulin, MAPT, and survivin[J].Med Oncol, 2014, 31(5): 950.
[2] MIURA J T, JOHNSTON F M, THOMAS J, et al. Molecular profiling in gastric cancer: examining potential targets for chemotherapy[J]. J Surg Oncol, 2014, 110(3): 302-306.
[3] WEHBE H, KEARNEY C M, PINNEY K G. Combretastatin A-4 Resistance in H460 Human Lung Carcinoma Demonstrates Distinctive Alterations in β-Tubulin Isotype Expression[J].Anticancer Res, 2005, 25(6B):3865.
[4] OKUDA K, ODA R, SUZUKI A, et al. Expression of excision repair cross-complementation group 1 and class III β-tubulin in thymic carcinoma[J]. Oncol Lett, 2017, 13(5): 3144-3150.
[5] NI X, WU P, WU J, et al. Correlation of beta-tubulin III and ERCC1 mRNA expression to chemotherapy outcome of gastric cancer patients with malignant ascites[J]. Int J Clin Exp Med,2016, 9(6): 11276-11283.
[6] OJIMA T, NAKAMORI M, NAKAMURA M, et al. Expression of BRCA1, a factor closely associated with relapse-free survival, in patients who underwent neoadjuvant chemotherapy with docetaxel, cisplatin, and fluorouracil for squamous cell carcinoma of the esophagus[J]. Surg Today, 2017, 47(1): 65-73.
[7] SHI W J, GAO J B. Molecular mechanisms of chemoresistance in gastric cancer[J]. World J Gastrointest Oncol, 2016, 8(9): 673.
[8] 刘新福. ERCC1、TS和TUBB3的表达与胃癌化疗敏感性及其预后的相关性研究[D].广州:南方医科大学, 2016.
[9] ZOU Z Q, DU Y Y, SUI G, et al. Expression of TS, RRM1,ERCC1, TUBB3 and postoperative adjuvant chemotherapy[J].Asian Pac J Cancer Prev, 2015, 16(8): 3189-3194.
[10] KARAGEORGOPOULOU S, KOSTAKIS I D, GAZOULI M, et al. Prognostic and predictive factors in patients with metastatic or recurrent cervical cancer treated with platinum-based chemotherapy[J]. BMC Cancer, 2017, 17(1): 451.
[11] OLAUSSEN K A, POSTEL-VINAY S. Predictors of chemotherapy efficacy in non-small-cell lung cancer: a challenging landscape[J]. Ann Oncol, 2016, 27(11): 2004-2016.
[12] CHEN J, SHAO R, LI F, et al. PI3K/Akt/mTOR pathway dualinhibitor BEZ235 suppresses the stemness of colon cancer stem cells[J]. Clin Exp Pharmacol Physiol, 2015, 42(12): 1317-1326.
[13] 胡锵. ERCC1和TUBB3在晚期胃癌组织中的表达及临床意义[D].合肥:安徽医科大学, 2015.
[14] MATBOLI M, EL-NAKEEP S, HOSSAM N, et al. Exploring the role of molecular biomarkers as a potential weapon against gastric cancer: a review of the literature[J]. World J Gastroenterol, 2016, 22(26): 5896.
[15] MA J, SHEN H, KAPESA L, et al. Lauren classification and individualized chemotherapy in gastric cancer[J]. Oncol Lett,2016, 11(5): 2959-2964.
[16] 杨洋, 李良庆, 陈群, 等. ERCC1和TUBB3联合检测对晚期胃癌个体化治疗的应用分析[J]. 中国现代普通外科进展, 2014,17(1): 20-23.
[17] MA J, ZHANG Y, SHEN H, et al. Association between mismatch repair gene and irinotecan-based chemotherapy in metastatic colon cancer[J]. Tumour Biol, 2015, 36(12): 9599-9609.
[18] HAN Y, YU D P, ZHOU S J, et al. Associations between clinical characteristics and oncogene expression in patients with nonsmall cell lung cancer[J]. Genet Mol Res, 2014, 13(4): 8913-8924.
R365
A
2095-5200(2017)06-068-03
10.11876/mimt201706027
江雨璐,本科,主管技师,研究方向:病理临床,Email:1473252585@163.com。
何杰,博士,主任医师,教授,博士生导师。
