肾癌不同病理分型的CT影像特征分析
2017-12-21李慧顾爱燕张爱娟张宏
李慧 顾爱燕 张爱娟 张宏
(南京医科大学附属江宁医院放射科,南京 211100)
肾癌不同病理分型的CT影像特征分析
李慧 顾爱燕 张爱娟 张宏
(南京医科大学附属江宁医院放射科,南京 211100)
目的:对比肾癌不同病理分型的CT影像特征,总结鉴别诊断特点。方法:回顾30例经病理证实肾癌患者临床资料,概括其CT影像特征。结果:不同病理分型肾癌形状、边界比较,差异无统计学意义(P>0.05)。肾透明细胞癌平扫表现为低密度12例,其中1例病灶内可见钙化,增强扫描呈不均匀强化;嫌色细胞癌平扫低密度6例,等密度2例,增强扫描呈均匀轻中度强化,均基本呈持续性强化,各期强化程度均低于肾透明细胞癌;乳头状肾癌平扫2例均匀低密度,5例不均匀低密度,增强扫描3例呈均匀强化,4例呈不均匀强化,7例均基本呈持续性强化,各期强化程度均低于肾透明细胞癌。肾透明细胞癌动脉期CT值及CT值增强量均高于嫌色细胞癌、乳头状肾癌,差异有统计学意义(P<0.05)。结论: 根据动脉期CT值及CT值增强量可诊断典型肾透明细胞癌,在CT影像的基础上,可综合发病特点、临床表现进行判断。
肾癌;病理分型;CT;影像特征
肾癌又称肾细胞癌,患者早期症状不明显,待出现腰痛、血尿及腹部包块等典型临床表现时病程往往已进入中晚期,预后较差[1]。随着医学诊断技术及多层螺旋设备的普及,肾癌的早期诊断率上升,也为根治性肾切除和保留肾单位手术的早期开展提供可能[2-3]。本文总结肾癌不同病理分型的CT影像特征,希望借此指导治疗方案的制定。
1 资料与方法
30例经病理证实肾癌患者,男18例,女12例,年龄38~71岁;病灶体积1.2×1.5 cm至13.1×7.3 cm;病理分型[4]:透明细胞型肾癌15例,嫌色细胞肾癌8例,乳头状肾癌7例;患者临床表现以腰部疼痛、血尿为主,多数患者无明显临床症状。
使用SOMATOM Definition Flash双源CT(德国西门子公司),行CT平扫加动态增强扫描 。调取患者术前影像资料,使用OsiriX 5.6通用医疗图像分析工具软件[5],由2名影像科副主任及以上职称医师进行读片及测定,包括肿瘤位置、肿瘤体积、肿瘤边界、肿瘤形状、肿瘤坏死和囊性变、肿瘤钙化、肿瘤脂肪、癌栓、局部淋巴转移及远处转移等[6]。根据肿瘤最大横径、各时相CT值、增强扫描动脉期最大横截面平均CT值增强量(肿瘤最大横截面动脉期平均CT值-平扫相平均CT值)[7]等影像学特征,总结鉴别诊断依据。
2 结果
2.1 肾透明细胞癌CT影像特征
肾透明细胞癌平扫表现为低密度12例,其中1例病灶内可见钙化,增强扫描呈不均匀强化;平扫低密度灶内见更低密度2例,增强扫描未见强化,病理证实为坏死区;平扫低密度灶内见高密度影1例,增强扫描未见强化,病理证实为出血灶。实质部分增强后强化程度均低于肾皮质,呈“快进快出”表现。见图1。
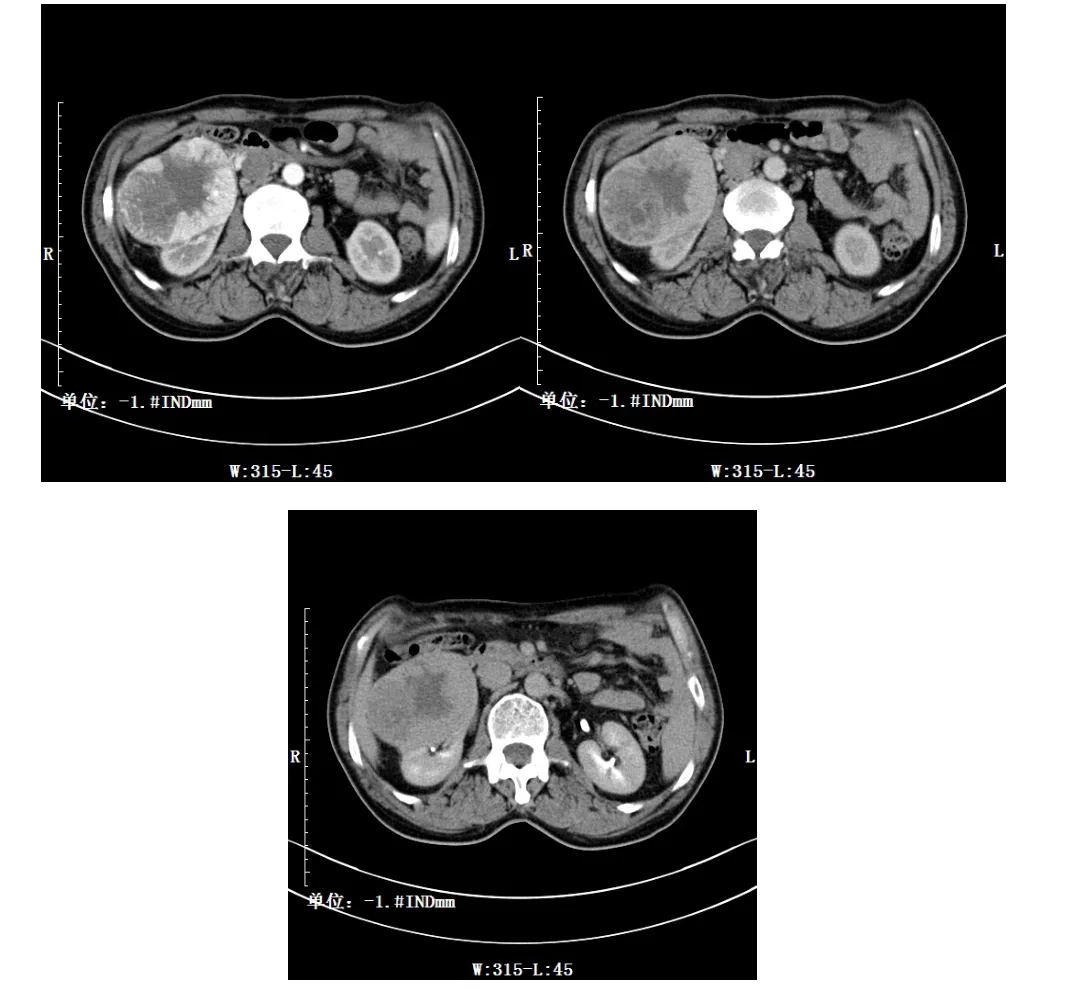
图1 肾透明细胞癌CT影像
2.2 嫌色细胞癌CT影像特征
嫌色细胞癌平扫低密度6例,等密度2例,增强扫描呈均匀轻中度强化,均基本呈持续性强化,各期强化程度均低于肾透明细胞癌。见图2。
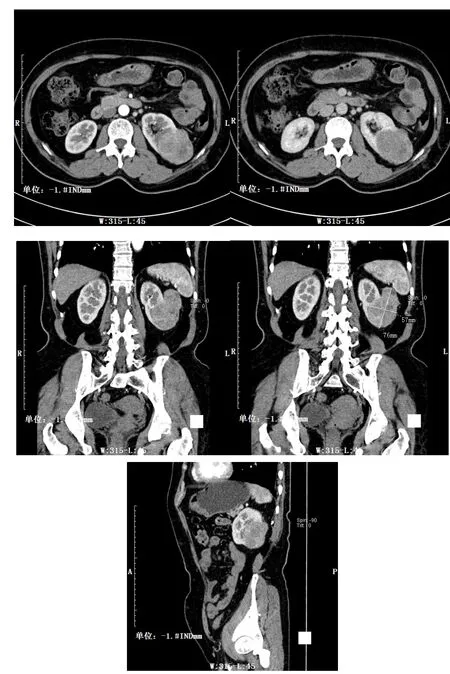
图2 嫌色细胞癌CT影像
2.3 乳头状肾癌CT影像特征
乳头状肾癌平扫2例均匀低密度,5例不均匀低密度,增强扫描3例呈均匀强化,4例呈不均匀强化,7例均基本呈持续性强化,各期强化程度均低于肾透明细胞癌。见图3。
肾透明细胞癌动脉期CT值及CT值增强量均高于嫌色细胞癌、乳头状肾癌,差异有统计学意义(P<0.05)。见表1。
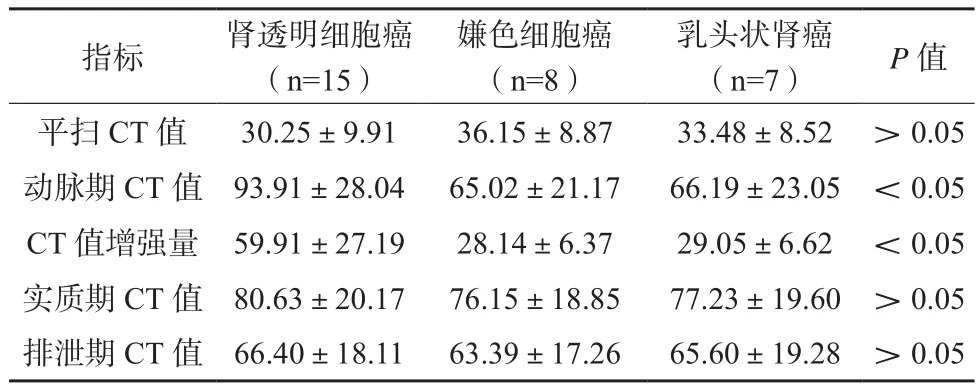
表1 肾癌不同病理分型的CT值比较(n/%)
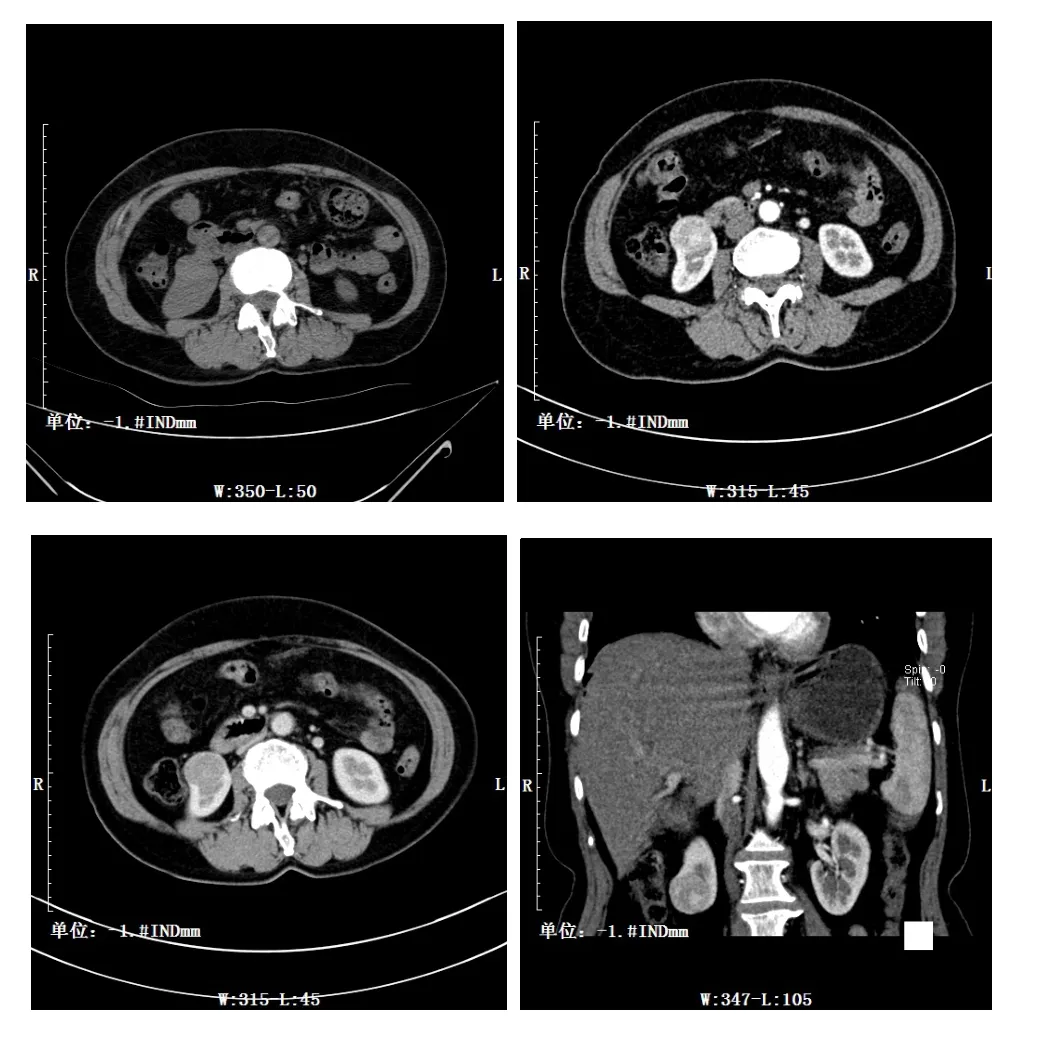
图3 乳头状肾癌CT影像
3 讨论
CT检查是当前肾癌初步诊断的重要手段[8],其图像分辨率高、可明确血供情况、提供三维重建影像、多时相动态观察等,能够为肾周扩散、肾血管受累、腔静脉癌栓形成、区域淋巴结转移及远处转移的判断提供可靠的参考[9-10]。
本研究就肾癌的临床特点及CT影像特征进行了回顾性,结果表明,肾透明细胞癌、嫌色细胞癌、乳头状肾癌的肿瘤边界、肿瘤形状均未见明显差异,说明肾癌不同病理分型的生物学特点具有相似性,这也是导致临床早期病理分型判断困难的主要原因[11]。
肾透明细胞癌多来源于近曲肾小管上皮细胞,是临床最常见的肾细胞癌类型,其组患者增强扫描可见各期强化均可见强化程度低于肾皮质强化但高于肾髓质强化,肿块实性部分于肾实质期呈明显不均匀强化,髓质期强化程度快速回落,呈“快进快出”表现,与过往报道一致[12-13]。有报道认为,随着肾实质强化程度的持续增加,肿块强化程度呈下降趋势,并伴有排泄期强化程度的明显下降,可作为肾透明细胞癌的判断依据[14]。
嫌色细胞癌的起源以肾集合管暗细胞为主,其病理标本多呈均匀一致的深棕色[15]。其CT影像特征以肿瘤皮髓交界期肿瘤强化程度略高于肾髓质强化程度,但明显低于肾皮质的强化程度为主,同时,实质期肿瘤强化程度可见轻微上升,且肿瘤强化方式多见持续强化,具有一定的参考价值。
由于乳头状肾癌为少血供肿瘤,增强扫描皮髓质期往往仅可见轻度强化,轻中度强化较为少见,但实质期强化程度存在一定上升趋势。传统观点认为,乳头状肾癌具有密度均匀、形态规则、边界清晰及增强期轻度强化特点[16],但本研究结果三种不同病理分型的肾癌在密度、形态、边界方面均无明显差异,而增强期轻度强化亦可见于嫌色细胞癌。亦有学者发现,乳头状肾癌的实质期强化程度与其分化程度具有明显关联,即分化较差的乳头状细胞癌可出现明显强化,这也给乳头状肾癌与透明细胞癌的鉴别带来了一定困扰[17]。而本研究统计结果,肾透明细胞癌动脉期CT值及CT值增强量均高于嫌色细胞癌、乳头状肾癌,提示可根据动脉期CT值及CT值增强量做出肾透明细胞癌的鉴别诊断,但乳头状肾癌、嫌色细胞癌的鉴别诊断仍难以做出。有学者认为,由于嫌色细胞癌恶性程度较低,瘤体不易出现出血、坏死或囊变,故应根据CT平扫增强扫描密度是否均匀予以鉴别,同时需避免其较高的瘤内钙化比例对鉴别造成的干扰[18]。
总而言之,根据动脉期CT值及CT值增强量可诊断典型肾透明细胞癌,对于乳头状肾癌、嫌色细胞癌的鉴别诊断,应结合发病特点、临床表现及病理结果予以综合判断。
[1] DEMIRCI E, OCAK M, KABASAKAL L, et al. ^ sup 68^Ga-PSMA PET/CT imaging of metastatic clear cell renal cell carcinoma[J]. Eur J Nucl Med Mol Imaging, 2014, 41(7): 1461.
[2] KARLO C A, DI PAOLO P L, CHAIM J, et al. Radiogenomics of clear cell renal cell carcinoma: associations between CT imaging features and mutations[J]. Radiology, 2014, 270(2):464-471.
[3] CONNOLLY S S, RAJA A, STUNELL H, et al. Diagnostic accuracy of preoperative computed tomography used alone to detect lymph-node involvement at radical nephrectomy[J].Scand J Urol, 2015, 49(2):1-7.
[4] LJUNGBERG B, BENSALAH K, CANFIELD S, et al. EAU guidelines on renal cell carcinoma: 2014 update[J]. Eur Urol,2015, 67(5): 913-924.
[5] MILETO A, MARIN D, ALFARO-CORDOBA M, et al. Iodine quantification to distinguish clear cell from papillary renal cell carcinoma at dual-energy multidetector CT: a multireader diagnostic performance study[J]. Radiology, 2014, 273(3): 813-820.
[6] ROWE S P, GORIN M A, HAMMERS H J, et al. Imaging of metastatic clear cell renal cell carcinoma with PSMA-targeted 18F-DCFPyL PET/CT[J]. Ann Nucl Med, 2015, 29(10): 877-882.
[7] RAVAUD A, MOTZER R J, PANDHA H S, et al. Adjuvant sunitinib in high-risk renal-cell carcinoma after nephrectomy[J].N Engl J Med, 2016, 375(23): 2246-2254.
[8] 赵金坤, 叶兆祥, 陈旭升, 等. 不同病理分级肾透明细胞癌与CT表现的相关性分析[J]. 临床放射学杂志, 2015, 34(8): 1233-1237.
[9] BI M, ZHAO S, SAID J W, et al. Genomic characterization of sarcomatoid transformation in clear cell renal cell carcinoma[J].Proc Natl Acad Sci, 2016, 113(8): 2170-2175.
[10] DAVIS C F, RICKETTS C J, WANG M, et al. The somatic genomic landscape of chromophobe renal cell carcinoma[J].Cancer Cell, 2014, 26(3): 319-330.
[11] JOSEPH R W, KAPUR P, ECKEL-PASSOW J E, et al.Loss of BAP1 protein expression is an independent marker of poor prognosis in patients with low-risk clear cell renal cell carcinoma[J]. Cancer, 2014, 120(7): 1059-1067.
[12] IWAMOTO H, KANDA Y, SEJIMA T, et al. Serum miR-210 as a potential biomarker of early clear cell renal cell carcinoma[J].Int J Oncol, 2014, 44(1): 53-58.
[13] SHINAGARE A B, VIKRAM R, JAFFE C, et al.Radiogenomics of clear cell renal cell carcinoma: preliminary findings of The Cancer Genome Atlas-Renal Cell Carcinoma(TCGA-RCC) Imaging Research Group[J]. Abdom Imaging,2015, 40(6): 1684-1692.
[14] 窦勇. 肾透明细胞癌MSCT灌注成像的临床研究[D]. 太原:山西医科大学, 2010.
[15] BEUSELINCK B, JOB S, BECHT E, et al. Molecular subtypes of clear cell renal cell carcinoma are associated with sunitinib response in the metastatic setting[J]. Clin Cancer Res, 2015,21(6): 1329-1339.
[16] KARAM J A, DEVINE C E, URBAUER D L, et al. Phase 2 trial of neoadjuvant axitinib in patients with locally advanced nonmetastatic clear cell renal cell carcinoma[J]. Eur Urol, 2014,66(5): 874-880.
[17] 尚燕宁, 蔡丰, 任安, 等. CT相对强化比值鉴别肾嗜酸性细胞瘤与肾透明细胞癌的应用价值[J]. 放射学实践, 2016, 31(2):159-162.
[18] ARMSTRONG A J, HALABI S, EISEN T, et al. Everolimus versus sunitinib for patients with metastatic non-clear cell renal cell carcinoma (ASPEN): a multicentre, open-label, randomised phase 2 trial[J]. Lancet Oncol, 2016, 17(3): 378-388.
R445.2
A
2095-5200(2017)06-004-03
10.11876/mimt201706002
李慧,本科,主治医师,研究方向:放射临床,Email:2312494795@qq.com。
张宏,Email:jnyyf@126.com。
