黄酒麦曲中产凝乳酶菌株的分离鉴定
2017-12-21李柳郑喆赵笑曹永强余志坚陈超杨贞耐
李柳,郑喆,赵笑,曹永强,余志坚,陈超,杨贞耐,
(1.北京食品营养与人类健康高精尖创新中心,食品添加剂与配料北京高校工程研究中心北京工商大学,北京 100048;2.东君乳业(禹城)有限公司,山东禹城 251200)
黄酒麦曲中产凝乳酶菌株的分离鉴定
李柳1,郑喆1,赵笑1,曹永强2,余志坚2,陈超2,杨贞耐1,2
(1.北京食品营养与人类健康高精尖创新中心,食品添加剂与配料北京高校工程研究中心北京工商大学,北京 100048;2.东君乳业(禹城)有限公司,山东禹城 251200)
本研究利用梯度稀释法和划线纯化法对黄酒麦曲中的微生物进行初筛,再利用酪蛋白平板法和液态培养基发酵法进行复筛,最终得到了两株产凝乳酶的优良细菌菌株LB-1和LB-2。通过形态学特征观察、生理生化实验以及16S rDNA序列分析鉴定,这两株菌分别确定为甲醇芽孢杆菌(Bacillus methanolicus)和枯草芽孢杆菌(Bacillus subtilis)。根据凝乳活力曲线发现,这两株菌在发酵24 h时其发酵液的凝乳活力最高,分别为269.66±0.78 SU/mL和187.50±1.4 SU/mL,此时的蛋白水解活力分别为1.476±0.49 U/mL和1.29±1.41 U/mL,凝乳活力与蛋白水解活力比值(C/P)分别为187.50和145.34。通过凝乳效果评价,其发酵液所形成的凝块组织结构、质构参数和风味物质均与商品凝乳酶形成的凝块相当,适用于干酪的加工。
黄酒麦曲;凝乳酶;分离;鉴定;凝乳效果评价
0 引言
凝乳酶在干酪加工过程中起凝固作用[1]。最早的来源是小牛皱胃,但随着干酪需求量的增加,屠宰大量犊牛已经不能满足人类的需求,而且引发了一些伦理问题[2]。目前报道产凝乳酶的来源有动物源、植物源以及微生物源[3],由于微生物生长繁殖迅速、发酵周期短的特点,已经成为凝乳酶生产的主要来源[4]。
黄酒分为南方黄酒和北方黄酒,南方黄酒有名的是绍兴黄酒[5],北方黄酒典型代表是北宗黄酒.。近年来科研工作者对南方黄酒麦曲中的微生物进行了鉴定[6],对北方黄酒麦曲中的微生物研究很少。
本研究从北宗黄酒麦曲中筛选出了产凝乳酶的菌株,通过形态学观察、生理生化实验以及16S rDNA分子生物学进行了鉴定[7],对其发酵液形成的凝块进行了质构和风味分析[8]。
1 实验
1.1 材料
黄酒麦曲,脱脂乳粉,商品凝乳酶。
1.2 培养基的配制
LB固体培养基(均为质量浓度):酵母提取物5 g/L,胰蛋白胨10 g/L,氯化钠10 g/L,琼脂粉15 g/L,蒸馏水1 L,121℃高压灭菌20 min。LB液体培养基:不添加琼脂粉即可。YEPD培养基:酵母粉10 g,蛋白胨20 g,葡萄糖20 g,琼脂粉15 g,蒸馏水1 L,pH值为6.0,115℃湿热灭菌20 min。PDA培养基:马铃薯浸粉15 g/L,葡萄糖3 g/L,琼脂粉15 g/L,蒸馏水1 L,121℃高压灭菌20 min。酪蛋白培养基:蛋白胨2.5 g/L,葡萄糖10 g/L,酵母膏1 g/L,干酪素10 g/L,琼脂粉20 g/L,脱脂牛乳50 g/L,pH 7.0,95 ℃灭菌15 min。
1.3 仪器与设备
HWS 12恒温水浴锅,Axio Image A1显微镜,分光光度计U-3900,HZQ-Q气浴恒温摇床,全自动凝胶成像系统,TexturePro CT V1.8 Build 31质构仪,GC-MS 7890A-7000。
1.4 方法
1.4.1 产凝乳酶菌株的初筛[9]
准确称取0.5 g粉碎好的麦曲加入装有4.5 mL无菌生理盐水的试管中,在振荡器中混匀,使麦曲均匀的分散在无菌生理盐水中,制得的该样品稀释度为10-1。然后将样品依次进行10倍梯度稀释,直到稀释度为10-7,各取100 μL(10-3~10-7)的稀释液分别涂布于LB,YEPD和PDA三种固体培养基中,实验重复三次。然后将培养基倒置于30℃恒温培养箱中进行培养,在第2,3,4天时挑取少量形态大小不同的菌落接种于相应的固体培养基中进行分离纯化,直至得到单菌株。分离纯化后将编好号的单菌株保存在甘油管中。
1.4.2 产凝乳酶菌株的复筛[10]
将初筛中得到的单一菌株以三点法接种于酪蛋白固体培养基中,在37℃恒温培养2 d,观察不同菌株产凝乳圈和水解圈的情况。取少量产凝乳圈和水解圈的菌株分别接种于LB、YEPD和PDA三种不同液体培养基中,30℃转速为120 r/min振荡培养24 h后分别测定菌株发酵液的凝乳活力和蛋白水解活力。
1.5 产凝乳酶菌株的鉴定
1.5.1 菌体形态观察
将分离得到的产凝乳酶菌株分别接种于LB固体培养基上,放在37℃恒温培养24 h后先通过肉眼观察菌落生长情况,再通过革兰氏染色后在显微镜下进一步观察菌体形态。
1.5.2 API试剂盒法对菌株的生理生化特征分析
用无菌棉签将平板培养好的新鲜菌体全部挑取置含有1 mL无菌生理盐水的试管中制成浓的细菌悬液,加两滴该菌液接种于API 50CHB/E培养基的安甁中,然后分别加入API 50CHB试剂盒各孔内,37℃静置培养24 h和48 h,通过观察试剂盒各孔颜色的变化来确定各反应结果的阴阳性,其中红色代表反应结果阴性,黄色和黑色代表反应结果阳性。
1.5.3 基于16S rDNA基因的菌种分子生物学鉴定
产凝乳酶菌株全基因组DNA的分离纯化:将产凝乳酶菌株分别接种于LB液体培养基中,30℃转速为120 r/min振荡培养12 h后离心,利用细菌基因组DNA提取试剂盒对其全基因组DNA进行提取。并利用提取的DNA作为PCR反应的模板,采用细菌通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-ACGGTTACCTTGTTACGACTT-3')进行PCR扩增[11]。
50 μL PCR反应体系:25 μL 2×Taq PCR Master⁃Mix(with loading dye);2 μL全基因组DNA模板;2 μL 27F(10umol/L);2 μL 1492R(10 umol/L);19 μL ddH2O。
PCR扩增程序:95℃预变性3 min,95℃变性0.5 min,55 ℃退火0.5 min,72 ℃延伸1 min,35个循环,72℃末端延伸5 min,扩增结束后将产物放在-20℃冰箱中保存。用质量分数为1.5%的琼脂糖凝胶电泳检测PCR扩增是否成功,将有特异性条带的PCR产物送至北京鼎国昌盛生物技术有限责任公司测序。测序结果提交到GenBank中,选取与实验菌株序列大小相近的已知菌株的相应序列进行比对,利用MEGA6.0软件将实验菌株与选取的序列相似性较高的菌株序列进行分析,构建系统发育进化树[12]。
1.6 产凝乳酶菌株发酵液活力的测定
1.6.1 凝乳活力的测定
凝乳活力测定采用Arima[13]方法,将脱脂乳溶解在浓度为0.01 mol/L的CaCl2溶液中制成10%的脱脂乳溶液,室温下静置30 min后各量取5 mL分装到小试管中,于35℃恒温水浴箱中保温5 min,在35℃下取待测菌液0.5 mL加入到5 mL装有10%脱脂乳溶液的试管中摇匀后开始计时,当开始出现絮状沉淀时立即停止计时。计算公式为
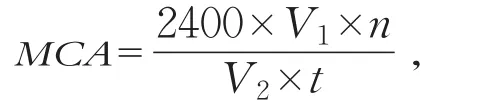
式中:MCA为发酵液凝乳活力(SU/mL);V1为脱脂牛奶溶液体积(mL);t为凝乳时间(s);V2为所加菌液体积(mL);n为菌液稀释倍数。
1.6.2 蛋白水解活力的测定[14]
将2 mL质量分数为1.5%酪蛋白溶液在35℃中保温5 min后,加入0.5 mL在35℃预热好的产凝乳酶菌株发酵液,将两者混匀在35℃中保温60 min,加入2 mL 8%的三氯乙酸终止反应,用滤纸将沉淀过滤出去测定滤液在280 nm处的吸光度值A280。量取0.5 mL在35℃预热好的产凝乳酶菌株发酵液直接与8%的三氯乙酸混匀,再加入2 mL质量分数为1.5%酪蛋白溶液,过滤后取滤液作为空白对照,测定其在280 nm处的吸光度值A280'。计算公式为:

式中:PA为发酵液蛋白水解活力(U/mL)。
1.7 产凝乳酶菌株生长曲线及其发酵液的凝乳活力曲线的测定
1.7.1 生长曲线的测定
取少量产凝乳酶菌株接种于LB液体培养基中,30℃转速为120 r/min振荡培养,每隔3 h测定菌体OD600值,直至菌株生长到衰亡期,实验重复3次。
1.7.2 凝乳活力曲线的测定
取少量产凝乳酶菌株接种于LB液体培养基中,30℃转速为120 r/min条件下振荡12 h,作为活化种子液,以质量分数为3%的接种量接种于LB液体培养基中,装液量为40%(体积分数),在30℃转速为120 r/min下振荡培养,分别在0,12,24,36,48,60,72,84 h时,按照1.6.1和1.6.2方法测定产凝乳酶菌株发酵液的凝乳活力和蛋白水解活力,实验重复3次。
1.8 产凝乳酶菌株发酵液的凝乳效果评价
1.8.1 凝乳效果及质构分析
在凝乳活力曲线中产凝乳酶菌株的最适发酵条件下测定其发酵液的凝乳活性,将酶活力为3.5×105SU/g的商品凝乳酶稀释1 000倍作对照,按照1.6.1的方法分别添加相同量的商品酶与菌株发酵液的离心上清液测定其凝乳时间,并利用TexturePro CT V1.8 Build 31质构仪对凝块进行质构分析,转子直径20 mm,目标距离5.0 mm,触发点负载5.0 g,测试速度为0.5 mm/s,返回速度为0.5 mm/s,循环2次。目的是分析比较产凝乳酶菌株发酵液和商品凝乳酶形成凝块的硬度、黏性、弹性、内聚性、胶着性和咀嚼性。
1.8.2 持水力测定
按照1.6.1的方法分别添加相同量的商品酶与产凝乳酶菌株发酵后的离心上清液至装有5 mL脱脂乳溶液的离心管中,凝乳后进行离心操作,在转速为7 000 r/min,温度为4℃条件下,离心10 min。离心完成后取上清称重,代入公式算得凝块持水力,即

1.8.3 风味物质分析
GC-MS法分析对比产凝乳酶菌株发酵后的离心上清液和商品凝乳酶所形成的凝块风味。量取9 mL脱脂乳溶液加入到50 mL萃取瓶中,分别加入1 mL的菌株发酵后的离心上清液和稀释后的商品凝乳酶,盖好盖子后放在40℃恒温水浴锅中平衡30 min,将进样针插入萃取瓶中40℃吸附30 min后,拔出进样针插入气相色谱进样口中,250℃条件下解析5 min。
(1)GC条件程序升温:初始温度为40℃,保持3 min,然后以5℃/min升温到200℃,保持0 min,再以10℃/min升温到250℃,保持3 min后运行3 min。载气(He),恒定流速为1.2 mL/min,进样口温度250 ℃,分流比5∶1。
(2)质谱条件电子轰击离子源,电子能量70 eV,传输线温度280℃,离子源温度为230℃,四极杆温度为150℃,质量扫描范围m/z为40~250。
2 结果与分析
2.1 产凝乳酶菌株的筛选
利用梯度稀释法和划线分离法从黄酒麦曲中分离纯化得到14株不同菌落形态的纯种菌株,将分离纯化得到的14株菌株分别以三点法点接于酪蛋白平板上[15],通过观察得到两个产生凝乳圈的菌株LB-1和LB-2,其菌体形态如图1所示。
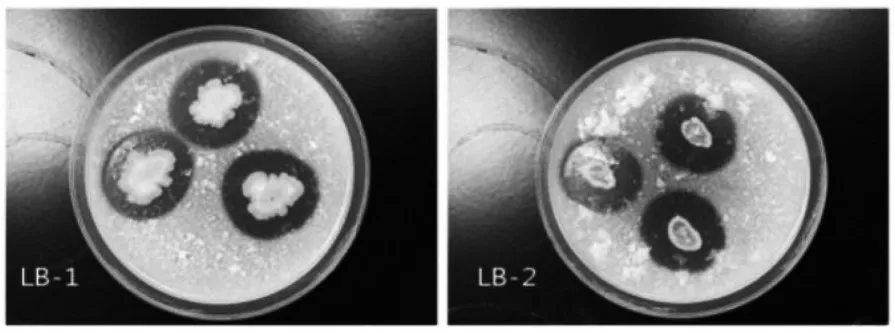
图1 LB-1与LB-2菌株在酪蛋白平板上的菌落形态
由图1可以看出,LB-1与LB-2两株菌均产生较大的凝乳圈以及周围的一些水解圈,且LB-1菌株比LB-2菌株的沉淀圈更厚重。将这两株菌分别接种于LB,YEPD和PDA三种不同的液体培养基中,在30℃120 r/min振荡培养24 h,测定其发酵液的凝乳活力和蛋白水解活力,结果如表1所示。

表1 LB-1与LB-2菌株在不同培养基中发酵的凝乳活力比较菌株
由表1可以看出,两株菌的发酵液均在液体LB培养基中凝乳活力相对较高。其中LB-1菌株发酵液在液体LB培养基中凝乳活力高达296.66 SU/mL,且蛋白水解活力较低;LB-2菌株发酵液在液体LB培养基中凝乳活力为193.65 SU/mL,相对较高。
2.2 产凝乳酶菌株的鉴定
2.2.1 形态学特征
将LB-1与LB-2菌株在LB固体平板上培养24 h后观察其菌落形态有明显差异,LB-1菌株呈乳白色、不透明、不光滑、较干燥;LB-2菌株稍显黄色、有褶皱、表面较湿润。通过革兰氏染色确定LB-1菌株与LB-2菌株均为革兰氏阳性反应,在显微镜下放大倍数为40倍时观察LB-1菌株为长杆状,LB-2菌株为短杆状。菌株形态及革兰氏染色照片分别如图2和图3所示。

图2 LB-1菌株菌落形态及革兰氏染色照片
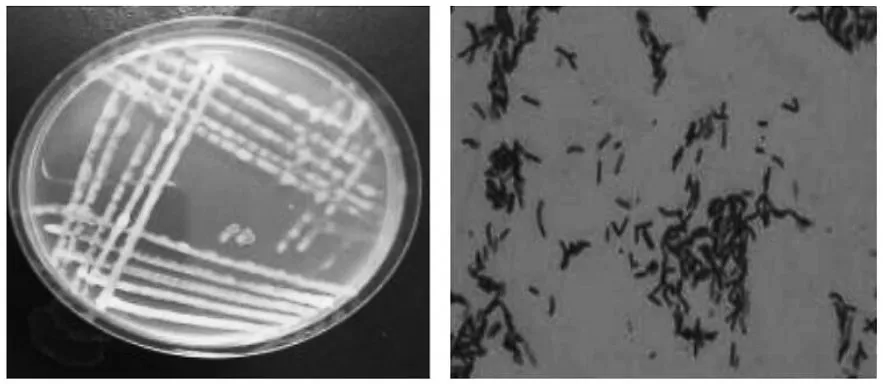
图3 LB-2菌株菌落形态及革兰氏染色照片
2.2.2 API试剂盒法分析菌株生理生化特征
LB-1和LB-2菌株的API试剂盒发酵结果如表2所示。表2中,+为反应结果为阳性;-为反应结果为阴性。

表2 LB-1和LB-2菌株的API生化试剂盒发酵结果
将API试剂条发酵结果提交到apiweb软件中进行比对鉴定,结果显示LB-2菌株与枯草芽孢杆菌相似度高达91.6%,可初步断定其为枯草芽孢杆菌,由于API数据库所含菌株数量有限,未能将LB-1菌株准确鉴定到种,但根据其主要糖反应结果并参考伯杰式细菌鉴定手册[16]可初步确定其为芽孢杆菌属,后续可通过分子生物学实验进一步鉴定。
2.2.3 基于16S rDNA序列的分子生物学鉴定
以LB-1和LB-2菌株全基因组DNA为模板进行PCR扩增后的产物再通过质量分数为1.5%琼脂糖凝胶电泳分析,LB-1和LB-2菌株在约1 500 bp处各有一条特异性条带,如图4所示。

图4 LB-1和LB-2菌株的16S rDNA 1.5%琼脂糖凝胶电泳图
PCR产物测序结果表明,LB-1菌株的16S rDNA序列长度为1 428 bp,LB-2菌株的16S rDNA序列长度为1 445 bp。
2.2.4 基于16S rDNA序列相似性比对及系统发育树分析
分别将LB-1和LB-2菌株的16S rDNA基因序列与在GenBank中序列大小相近的已知菌株的序列进行比对后,选取与LB-1和LB-2菌株序列相似性较高的菌株序列,构建系统发育树,结果如图5和图6所示。由图5和图6可以看出,LB-1菌株与Bacillus meth⁃anolicusPB1(AFEU01000004.1)在同一分支上,LB-2菌株与Bacillus subtilis strain P3(KF758384.1)在同一分支上且它们的置信度支持率分别高达99%和100%,综合上述形态学和生理生化实验结果可将LB-1菌株鉴定为甲醇芽孢杆菌(B.methanolicus),将LB-2菌株鉴定为枯草芽孢杆菌(B.subtilis)。

图5 以16S rDNA序列为基础的LB-1菌株系统发育树

图6 以16S rDNA序列为基础的LB-2菌株系统发育树
2.3 菌株的生长曲线及其发酵液的凝乳活力曲线测定结果
甲醇芽孢杆菌LB-1的生长曲线和发酵液的凝乳活力曲线如图7所示。由图7(a)可知,OD600值显示LB-1菌株在液体培养基中0~6 h生长速率缓慢,这个时期为迟缓期;6~21 h菌株生长迅速,这一阶段为指数期;21~45 h菌株生长速率随时间延长基本保持不变,这一阶段为稳定期;45 h以后菌株生长速率急速下降,这一阶段为衰亡期。由图7(b)可知,LB-1菌株发酵液在对数期凝乳活力快速增加,在稳定期凝乳活力也趋于稳定且在稳定初期凝乳活力达到最大值,随后凝乳活力开始下降,可能原因是培养基中营养成分消耗殆尽以及处于衰亡期的菌株生长速率下降导致其凝乳活力的下降。随着发酵时间的增加蛋白水解活力总体差异不大,特别在发酵24 h时,菌株发酵液的凝乳活力达到最大值随后开始逐渐下降,但其蛋白水解活力相对较小,凝乳活力与蛋白水解活力比值(C/P)为最大值。
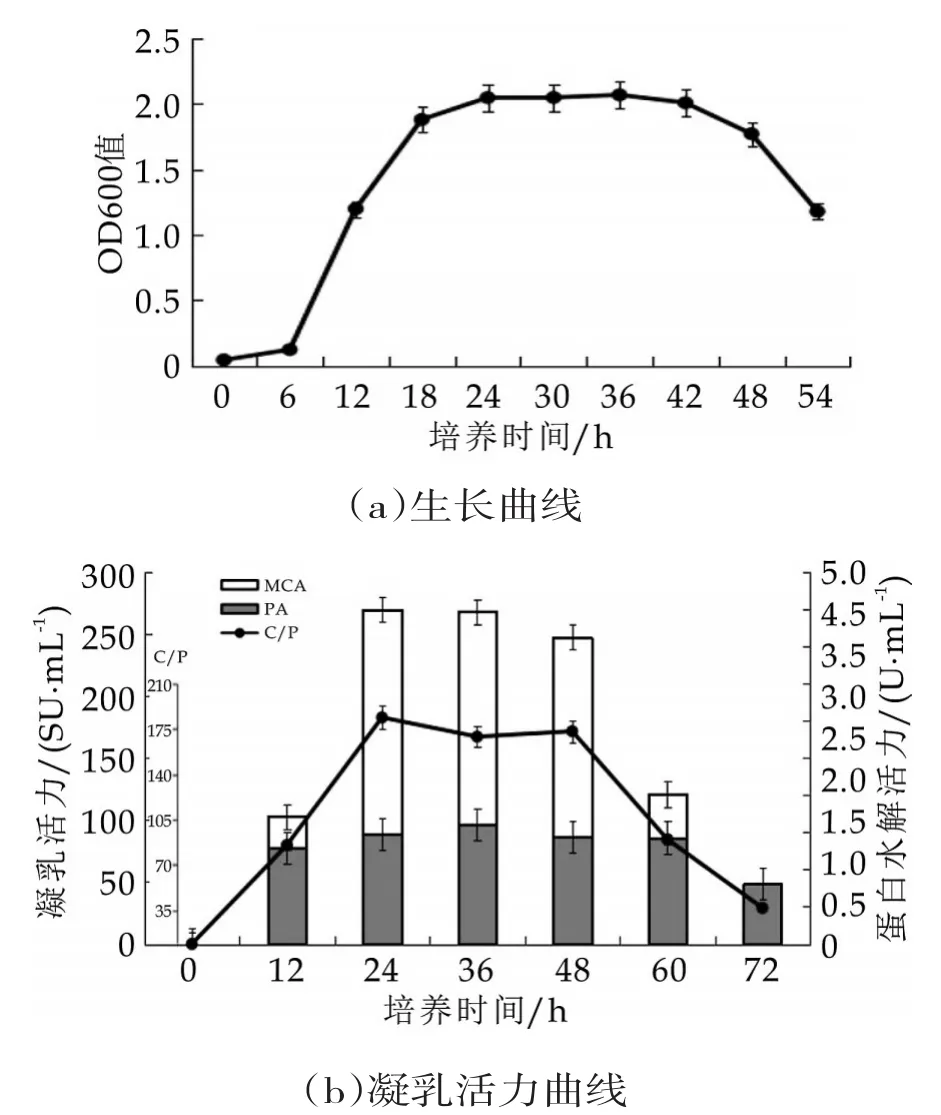
图7 LB-1的生长曲线和发酵液的凝乳活力曲线
枯草芽孢杆菌LB-2的生长曲线及其发酵液的凝乳活力曲线分别如图8(a)和8(b)所示。由图8(a)可知,OD600值显示LB-2菌株在液体培养基中0~6 h生长速率缓慢,这个时期为迟缓期;6~21 h菌株生长迅速增加,这一阶段为指数期;21~27 h菌株生长随时间增加基本保持不变,这一阶段为稳定期,与图7(a)相比,LB-2菌株稳定期相对较短;27 h以后菌株生长速率急速下降,这一阶段为衰亡期。由图8(b)可知,LB-2菌株发酵液在0~24 h凝乳活力迅速增加,在24 h达到最大值后开始下降且在发酵24 h时LB-2菌株发酵液的C/P值最大。

图8 枯草芽孢杆菌LB-2的生长曲线和凝乳活力曲线
2.4 产凝乳酶菌株发酵液所形成凝块的凝乳效果评价
2.4.1 凝乳效果及质构分析结果
对比甲醇芽孢杆菌LB-1和枯草芽孢杆菌LB-2与稀释后的商品凝乳酶形成的凝块如图9所示。

图9 LB-1与LB-2菌株发酵液的凝乳效果
其中LB-1菌株发酵后的离心上清液凝乳时间为98 s,即凝乳活力为244.89 SU/mL,LB-2菌株发酵后的离心上清液凝乳时间为113 s,即凝乳活力为212.39 SU/mL,酶活力为3.5×105SU/g的商品凝乳酶稀释1 000倍后凝乳时间为96 s,即凝乳活力为250 SU/mL。LB-1与LB-2菌株发酵液的凝乳活力与商品凝乳酶很接近。
为了进一步比较甲醇芽孢杆菌LB-1与枯草芽孢杆菌LB-2发酵后的离心上清液与商品凝乳酶形成凝块的硬度、黏性、弹性、内聚性、胶着性、咀嚼性,分别对其进行了质构分析[17],所形成凝块的质构分析结果如表3所示。硬度是第一次压缩时的最大峰值,正的力值和面积越大说明凝块越硬,其中商品凝乳酶所形成的凝块硬度最大为(309.25±0.05)g,LB-1菌株发酵液所形成的凝块硬度居中为(287.85±0.17)g,LB-2菌株发酵液所形成的凝块硬度最小为(246.35±0.13)g,但三者差异不显著(P>0.05),所测硬度指标以第一次硬度为主,因为第二次所测硬度可能会受到第一次测量的影响[18]。黏性是第一次圧缩曲线到达零点到第二次圧缩曲线开始之间的曲线的负面积,LB-2菌株发酵液所形成的凝块黏性最大,数值为(0.055±0.13)mJ。黏性越大的样品活塞上提时粘在探头上的越多,一般较稠的凝块黏性越大,胶着性也主要是描述半固态测试样品的黏性特征。弹性是变形样品在去除压力后恢复到变形前的高度比率,LB-2菌株发酵液所形成的凝块硬度最低其弹性最大。而内聚性越大,说明样品对活塞下压时抵抗力越大[19],也说明凝块爽滑性、细腻度越差,酒曲菌株发酵液形成的凝块内聚性分别为0.44±0.06和0.49±0.03,小于对照组0.565±0.26,所以酒曲菌株发酵液形成的凝块其细腻度优于对照组。
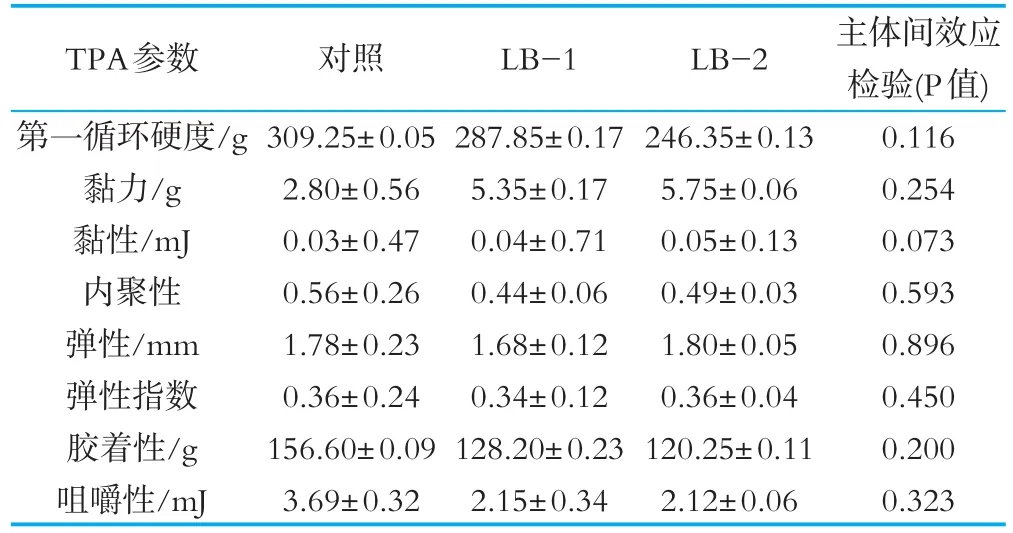
表3 LB-1与LB-2菌株发酵液所形成凝块的质构分析各指标结果
通过整体比较分析,LB-1与LB-2菌株发酵液所形成的凝块质构特性与对照组相比无显著差异(P>0.05)。
2.4.2 持水力分析结果
为了进一步评价甲醇芽孢杆菌LB-1与枯草芽孢杆菌LB-2在干酪制作中的应用潜力,考察其发酵后的离心上清液所形成的凝块阻止水渗出的能力,分别测定了菌株发酵后的离心上清液和商品凝乳酶所形成凝块的持水力,结果如表4所示。

表4 LB-1与LB-2菌株发酵液所形成凝块的持水力测定结果
持水力描述的是由分子构成的机体通过物理方式截留大量的水而阻止水渗出的能力。持水力越大说明机体内固定住的水分越多,凝乳质量越好。由表4可得,酒曲菌株发酵液与商品凝乳酶所形成凝块的持水力数值均较高,且主体间效应检验结果表明三者差异不显著(P>0.05)。综合凝块的质构特性和持水性能进行分析,酒曲菌株发酵液所形成凝块的细腻度、爽滑性优良,持水力高,可用于干酪的生产。
2.4.3 风味物质分析结果
通过GC-MS分析甲醇芽孢杆菌LB-1与枯草芽孢杆菌LB-2发酵后的离心上清液和商品凝乳酶所形成凝块的风味物质[20]如图10所示。
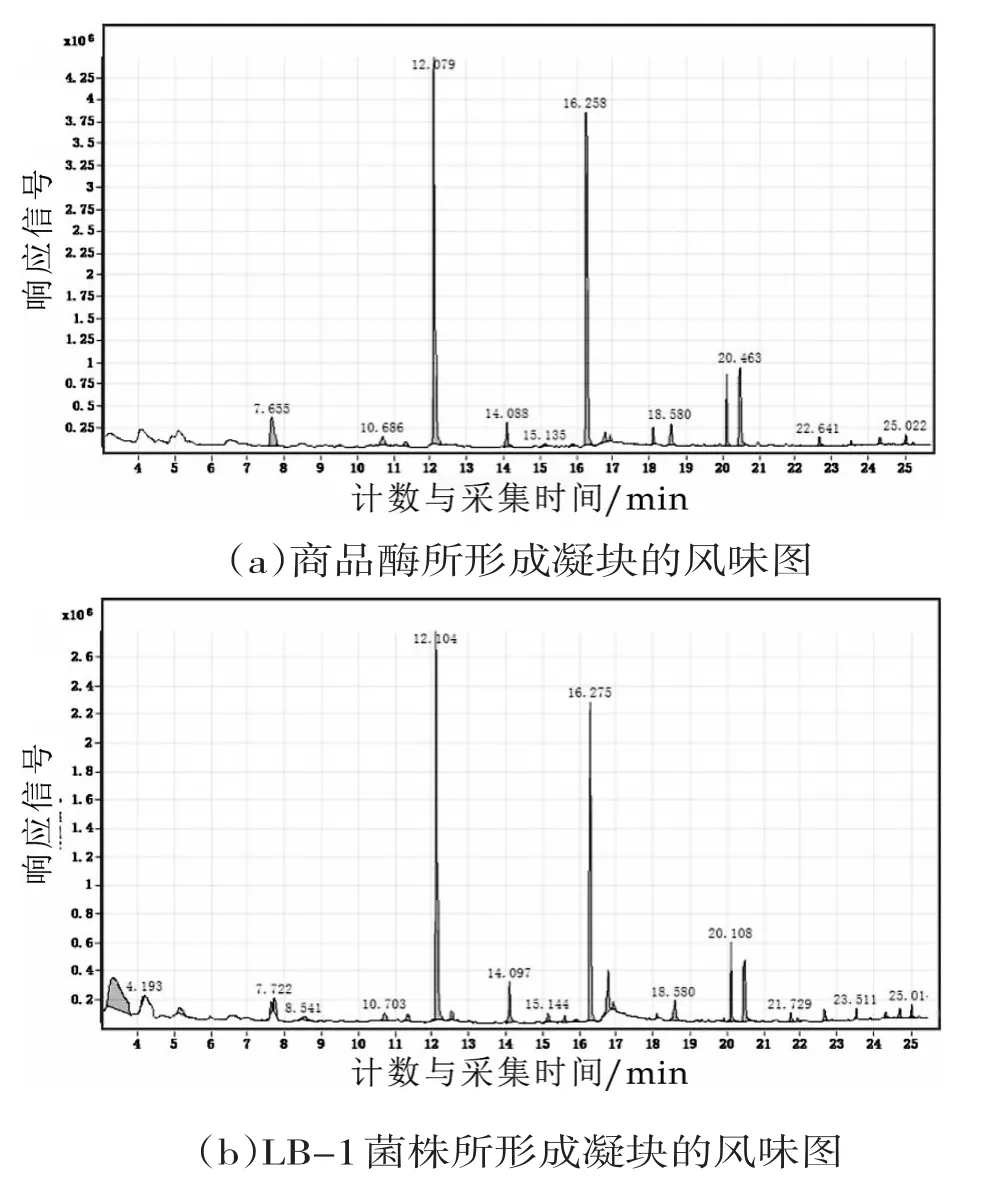
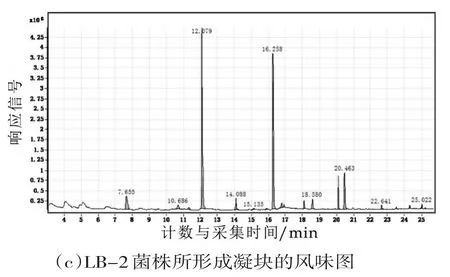
图10 LB-1与LB-2菌株发酵后的离心上清液所形成凝块的风味物质
根据图中LB-1与LB-2菌株发酵后的离心上清液和商品凝乳酶所形成凝块的出峰图谱进行解析,商品凝乳酶形成的凝块中的主要风味物质为辛醛、壬醛、癸醛和庚醛,LB-1菌株发酵液的凝块中主要风味物质为辛醛、壬醛、癸醛和庚醛,LB-2菌株发酵液的凝块中主要风味物质为辛醛、壬醛、癸醛和十三烷,三种凝块中均不含异味,且主要风味物质均为醛类。醛类物质的阈值一般较低,对食品整体风味的贡献较大[21],壬醛普遍存在于干酪中,具有脂肪味和水果的香味。而LB-2菌株发酵液凝块中的十三烷为烃类化合物,主要来源是牛乳本身,并不是在干酪成熟过程中产生的,因此其在所有干酪中的存在较为普遍,但一般由于烃类化合物的芳香阈值较高,这些化合物对干酪风味的贡献较小[22]。后期利用LB-1与LB-2菌株所产的凝乳酶制作干酪,其产品的风味得到了保障。
3 结果与讨论
(1)同样作为凝乳酶的生产者,微生物与动植物相比有体积小,繁殖快,生长周期短,发酵产物易提取等优势[23],因此研究微生物用于生产凝乳酶具有很好的发展前景[24]。Bensmail等利用农副产品作为营养物质通过固态发酵法优化了黑曲霉生产的细胞外蛋白酶凝乳活性的最佳条件[25],张卫兵等对解淀粉芽孢杆菌产凝乳酶条件进行了优化并对其分离提纯做了详细研究[26],均指出其微生物产凝乳酶稳定,具有大规模生产凝乳酶的潜力。
(2)本研究对黄酒麦曲中的微生物进行分离鉴定,最终筛选出了两株产凝乳酶的细菌,分别是甲醇芽孢杆菌(B.methanolicus)和枯草芽孢杆菌(B.subtilis),与同来源于酒曲中的真菌相比具有发酵易于控制,产物易于提取分离等优势,而且根据其凝乳活性曲线,LB-1与LB-2菌株均在发酵24 h时其发酵液凝乳活力达到最大值(269.66±0.78)SU/mL和(187.50±1.4)SU/mL,此时的蛋白水解活力分别为(1.476±0.49)U/mL和(1.29±1.41)U/mL,凝乳活力与蛋白水解活力比值分别为187.50和145.34。目前已报道的产凝乳酶细菌菌株中解淀粉芽孢杆菌(B.amyloliquefaciens)在发酵72 h时其发酵液凝乳活力达到最大值,此时C/P为85.45[27],地衣芽孢杆菌(B.licheniformis)在最佳发酵条件下发酵10 h发酵液的凝乳活力最大仅为24.7 SU/mL[28]。从黄酒麦曲中筛选出的LB-1和LB-2菌株与其相比,不仅发酵周期短而且C/P高。此外,LB-1和LB-2菌株发酵液形成的凝块与商品凝乳酶形成的凝块相比其弹性、硬度、黏性、内聚性等均无明显差异,所含风味物质也基本相同,且无异味存在。
枯草芽孢杆菌(B.subtilis)近些年报道产凝乳酶的文章较多[29],而关于甲醇芽孢杆菌(B.Methanolicus)鲜有报道。曾有研究表明[30]它的最适生长温度为55℃,是典型的嗜热菌株,且能以甲醇为原料合成自身所需营养物质,并能形成内生孢子。在酿造黄酒过程中,发酵环节由于原料的植物细胞壁及细胞间质的果胶中含有甲醇酯,在曲霉的作用下放出甲氧基而生成甲醇,醇类是黄酒的主要风味来源之一[31],因此在黄酒中甲醇的存在促进了以甲醇为营养物质的甲醇芽孢杆菌(B.methanolicus)的生长。曾有文献报道,甲醇芽孢杆菌(B.methanolicus)可用于生产氨基酸[32],但对其用于产凝乳酶在此之前尚未见报道,因此研究甲醇芽孢杆菌(B.methanolicus)用于生产凝乳酶,丰富了凝乳酶产生菌的资源库。在后续试验中可对其培养基和培养条件进一步优化,以提高其发酵液的凝乳活力,降低蛋白水解活力。
(3)本研究利用梯度稀释法和划线纯化法初筛,酪蛋白平板法和液态培养基发酵法复筛后,分离筛选出了两株产凝乳酶的优良细菌菌株,通过形态观察,镜检,生理生化实验并结合分子生物学,最终将这两株菌分别鉴定为甲醇芽孢杆菌(B.methanolicus)LB-1和枯草芽孢杆菌(B.subtilis)LB-2。生长曲线和凝乳活性曲线的研究结果表明,LB-1菌株生长稳定期较长,且在菌株生长稳定初期其发酵液凝乳活力达到最大值(269.66±0.78)SU/mL,此时的蛋白水解活力为(1.476±0.49)U/mL,其C/P为187.50;LB-2菌株生长稳定期较短,也在其稳定期时其发酵液的凝乳活力达到最大值(187.50±1.4)SU/mL,此时的蛋白水解活力为(1.29±1.41)U/mL,其C/P为145.34。两株菌的发酵液形成的凝块与商品凝乳酶形成的凝块相比其质地和风味均无明显差异,且无异味存在,可以作为发酵生产适于干酪加工的凝乳酶的候选菌株。
[1]李亮,吴丹,宿玲恰,等.重组毕赤酵母生产凝乳酶发酵优化[J].食品与生物技术学报,2016,35(5):457-464.DOI:10.3969/j.issn.1673-1689.2016.05.002
[2]KUMARI NARWAL R,BHUSHAN B,PAL A,et al.Purification,physico-chemico-kinetic characterization and thermal inactivation thermodynamics of milk clotting enzyme from Bacillus subtilis MTCC 10422[J].LWT-Food Science and Technology,2016,65:652-660.DOI:10.1016/j.lwt.2015.08.065
[3]AHMED S A,WEHAIDY H R,IBRAHIM O A,et al.Novel milk-clotting enzyme from Bacillus stearothermophilus as a coagu⁃lant in UF-white soft cheese[J].Biocatalysis&Agricultural Biotech⁃nology,2016,7:241-249.DOI:10.1016/j.bcab.2016.06.011
[4]赵爱梅,赵笑,段紫怡,等.酒曲发酵产凝乳酶及其酶学特性研究[J].中国乳品工业,2016,44(2):16-21.DOI:10.3969/j.issn.1001-2230.2016.02.004
[5]王洋怡舟,李柏林,欧杰,等.绍兴黄酒酒曲总DNA的提取及其真菌多样性[J].食品工业科技,2016,37(15).DOI:10.13386/j.issn1002-0306.2016.15.026
[6]刘芸雅,毛健,孟祥勇,等.绍兴黄酒麦曲及发酵过程中细菌群落结构分析[J].中国食品学报,2017,17(1).
[7]任清,侯昌.北宗黄酒麦曲微生物的分离鉴定[J].食品科学,2017,38(4):77-82.DOI:10.7506/spkx1002-6630-201704013
[8]腾军伟,余志坚,陈超,等.影响解淀粉芽孢杆菌GSBa-1产凝乳酶的因素及发酵条件优化研究[J].中国食品添加剂,2016(8):53-62.DOI:10.3969/2j.issn.1006-2513.2016.08.002.DOI:10.13386/j.issn1002-0306.2012.05.093
[9]韩生义,赵淑琴,刘晓丽,等.一株碱性脂肪酶产生菌的筛选、鉴定及酶学性质研究[J].甘肃农业大学学报,2017,52(1):119-125.
[10]张卫兵.甘南牧区产凝乳酶细菌的筛选、产酶条件、酶学特性及应用研究[D].甘肃农业大学,2014.
[11]MILLER R J H,BARBARA C,DYLAN P,et al.Development and evaluation of a novel fast broad-range 16S ribosomal DNA PCR and sequencing assay for diagnosis of bacterial infective endocarditis:multi-year experience in a large Canadian healthcare zone and a liter⁃ature review:[J].BMC Infectious Diseases,2016,16(1):146.
[12]ALLMAN E S,RHODES J A,SULLIVANT S.Statistically Consis⁃tent k-mer Methods for Phylogenetic Tree Reconstruction[J].Jour⁃nal of Computational Biology,2017,10(6).DOI:10.1089/cmb.2015.0216
[13]YU J,TAMURA G,ARIMA K.Milk-clotting Enzyme from Micro⁃organisms[J].Agricultural&Biological Chemistry,1971,35(8):1194-1199.DOI:10.1080/00021369.1971.10860068
[14]薛璐,姜铁民,任发政,等.江米酒凝乳机理的初步研究[J].食品与发 酵 工 业,2006,32(9):37-38.DOI:10.13995/j.cnki.11-1802/ts.2006.09.009
[15]滕国新,全庆阳,王玉林,等.传统清宫乳制品米酒奶(Guan-nai)的微生物学研究:北京食品学会成立二十周年学术论文集,1999[C].
[16]周静,黄晓辉,肖冰梅,等.一株多功能芽孢杆菌的鉴定[J].中国微生态学杂志,2013,25(9):997-1000.DOI:10.13381/j.cnki.cjm.2013.09.001
[17]MORITA A,ARAKI T,IKEGAMI S,et al.Development of Tex⁃ture Evaluation Model Based on Viscoelastic Testing Methods for Cheddar Cheese[J].Japan Journal of Food Engineering,2016,16.
[18]杨述,高昕,许加超,等.不同硬度奶酪的质构及流变特性比较[J].食品科学,2010,31(21):50-53.
[19]王丽霞,王崧瑀,李雅玲.不同工艺参数对高水分Mozzarella干酪微观结构及出品率的影响[J].中国食品添加剂,2017(3).
[20]马艳丽,曹雁平,杨贞耐,等.SPME-GC-MS检测不同中西方奶酪的挥发性风味物质及比较[J].食品科学,2013,34(20):103-107.DOI:10.7506/spkx1002-6630-201320020
[21]KANG H R,HWANG H J,LEE J E,et al.Quantitative analysis of volatile flavor components in Korean alcoholic beverage and Japanese sake using SPME-GC/MS[J].Food Science&Biotechnology,2016,25(4):979-985.DOI:10.1007/s10068-016-0159-7
[22]BEZERRA T K A,ARAǗJO A R R,ARCANJO N M D O,et al.Optimization of the HS-SPME-GC/MS technique for the analysis of volatile compounds in caprine Coalho cheese using response sur⁃face methodology.[J].Food Science&Technology,2016,36(ahead).
[23]MFS C M T,JLL F,ALF P.Partial purification of new milk-clotting enzyme produced by Nocardiopsis sp.[J].Bioresource Technology,2004,93(1):29-35.DOI:10.1016/j.biortech.2003.10.003[24]NARWAL R K,BHUSHAN B,PAL A,et al.Optimization of Up⁃stream Process Parameters for Enhanced Production of Thermostable Milk Clotting Enzyme from Bacillus Subtilis MTCC 10422[J].Jour⁃nal of Food Process Engineering,2016.DOI:10.1111/jfpe.12356
[25]BENSMAIL S,MECHAKRA A,FAZOUANENAIMI F.Optimiza⁃tion of milk-clotting protease production by a local isolate of Asper⁃gillus niger FFB1 in solid-state fermentation.[J].Journal of Microbiol⁃ogy Biotechnology&Food Sciences,2017,4(5):467-472.
[26]张卫兵,梁琪,乔海军,等.紫外线和硫酸二乙酯诱变高产凝乳酶地衣芽孢杆菌的研究[J].食品工业科技,2012,33(5):174-176.
[27]腾军伟,赵笑,杨亚威,等.酒曲中产凝乳酶微生物菌株的分离筛选及鉴定[J].食品科学,2017:1-10.
[28]LI Y,GU Z,LIANG Z,et al.Inducible expression of trehalose syn⁃thase in Bacillus licheniformis[J].Protein Expression&Purification,2017,130:115-122.DOI:10.1016/j/pep.2016.10.005
[29]DUTT K,GUPTA P,SARAN S,et al.Production of Milk-Clot⁃ting Protease from Bacillus subtilis[J].Applied Biochemistry and Bio⁃technology,2009,158(3):761-772.DOI:10.1007/12010-008-8504-9
[30]ARFMAN N,DIJKHUIZEN L,KIRCHHOF G,et al.Bacillus methanolicus sp.nov.,a new species of thermotolerant,metha⁃nol-utilizing,endospore-forming bacteria.[J].International Journal of Systematic Bacteriology,1992,42(3):439.DOI:10.1099/00207713-42-3-439
[31]张雨,冉宇舟,池国红,等.米浆水对黄酒酿造和风味影响的研究[J].酿酒科技,2009,28(11):97-100.
[32]BRAUTASET T,JAKOBSENΦM,JOSEFSEN K D,et al.Bacillus methanolicus:a candidate for industrial production of amino acids from methanol at 50 degrees C[J].Applied Microbiology and Bio⁃technology,2007,74(1):22.DOI:10.1007/s00253-006-0757-z
Isolation and identification of rennet-producing strains from wheat Qu of Chi⁃nese rice wine
LI Liu1,ZHENG Zhe1,ZHAO Xiao1,CAO Yongqiang2,YU Zhijian2,CHEN Chao2,YANG Zhennai1,2
(1.Beijing Advanced Innovation Center for Food Nutrition and Human Health,Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients,Beijing Technology&Business University(BTBU),Beijing 100048,China;2.Dongjun Dairy(Yucheng)Co.,Ltd,Yucheng 251200,China)
In this study,the microbes in the rice wine“wheat Qu”were screened by gradient dilution method and scribing method,fol⁃lowed by casein plate method and liquid culture medium fermentation.Two excellent bacterial strains of LB-1 and LB-2 producing rennet were obtained,which were further identified as Bacillus methanolicus and Bacillus subtilis by morphological observation,physiological and bio⁃chemical experiments and 16S rDNA sequence analysis.According to the enzyme activity curve,the highest milk clotting activity of the en⁃zymes from the two strains were 269.66±0.78 SU/mL and 187.50±1.4 SU/mL at 24 h fermentation,while the proteolytic activity were 1.476±0.49 U/mL and 1.29±1.41 U/mL,respectively.The ratio of milk clotting activity and proteolytic activity(C/P)were 187.50 and 145.34,respectively.Through the curd effect evaluation,the organization structure,texture parameters and flavor substances of the clots formed by the fermentation broth of the strains LB-1 and LB-2 had comparable milk-clotting effect with that of a commercial rennet,and they were suitable for cheese processing.
rice wine wheat Qu;rennet;isolation;identification;curd effect evaluation
Q93-331
A
1001-2230(2017)11-0004-07
2017-06-15
国家自然科学基金青年科学基金项目(31601488)。
李柳(1993-),女,硕士研究生,研究方向为乳品生物技术。
杨贞耐
