水貂阿留申病毒、肠炎病毒与犬瘟热病毒多 重PCR检测方法的建立与应用
2017-12-21王元智闫文卓赵丽丽陈洪岩陆涛峰
马 芹,王元智,闫文卓,赵丽丽,陈洪岩,陆涛峰
(中国农业科学院哈尔滨兽医研究所,黑龙江省实验动物与比较医学重点实验室,哈尔滨 100193)
水貂阿留申病毒、肠炎病毒与犬瘟热病毒多 重PCR检测方法的建立与应用
马 芹,王元智,闫文卓,赵丽丽,陈洪岩,陆涛峰*
(中国农业科学院哈尔滨兽医研究所,黑龙江省实验动物与比较医学重点实验室,哈尔滨 100193)
研究报告
目的水貂阿留申病、病毒性肠炎与犬瘟热并称影响水貂健康的三大疫病,拟建立一种可同时检测三种病毒的多重PCR检测方法。方法针对三种病毒基因保守区分别设计了3对特异性引物,对貂阿留申病毒(ADV)和水貂肠炎病毒(MEV)的DNA模板和犬瘟热病毒(CDV)的RNA模板进行了多重PCR扩增和扩增条件优化。结果PCR可同时扩增出601 bp(ADV)、205 bp(MEV)和451 bp(CDV)的特异性目的条带,敏感性试验表明最低核酸检出量为ADV 每微升2.67×104拷贝、MEV 每微升3.02×104拷贝和CDV每微升1.72×105拷贝。临床样品检测结果表明多重PCR和单一PCR检测结果一致。结论建立的多重PCR检测方法可快速地检测ADV、MEV和CDV单一或混合感染的临床样品。
多重PCR;水貂阿留申病毒;水貂肠炎病毒;犬瘟热病毒
貂作为重要的经济动物,不仅仅具有经济价值[1],同时貂还是流感病毒、SARS、新城疫病毒、貂圆环病毒、阿留申病毒以及肠炎病毒的宿主,其中雪貂对流感病毒十分易感,感染后表现出与人相似的症状,还能产生免疫反应,因此雪貂可作为研究流感病毒最佳的实验动物模型。貂的实验动物化养殖必须保证背景清晰,并对其携带的病原体进行控制,所以需要建立一系列针对貂携带的病原体的检测方法。水貂阿留申病、病毒性肠炎与犬瘟热并称影响貂健康的三大疫病[2-4],给貂养殖造成了极大的影响。水貂阿留申病是由水貂阿留申病毒(Aleutian mink disease parvovirus,ADV,单链DNA病毒)引起的一种慢性消耗性疾病,主要特征为浆细胞增多,γ球蛋白增多和免疫复合物堆积[5,6]。水貂病毒性肠炎是由水貂肠炎病毒(mink enteritis parvovirus,MEV,单链DNA病毒)引起的急性、高度接触性传染病,主要临床症状是强烈腹泻[7,8]。水貂犬瘟热是由犬瘟热病毒(canine distempervirus,CDV,单链RNA病毒)引起的急性、热性、高度接触性传染病[9,10]。临床上这三种病混合感染现象愈发普遍,本试验拟建立多重PCR检测方法同时检测ADV、MEV和CDV,为这三种疫病的单一或混合感染进行快速、准确的诊断。
1 材料和方法
1.1 病毒和样品
水貂阿留申病毒(ADV),貂肠炎病毒(MEV),犬瘟热病毒(CDV)及犬腺病毒(CAV)由本实验室保存;临床病料来自黑龙江省周边发病貂场。
1.2 主要试剂与仪器
EasyPure Viral DNA/RNA Kit试剂盒、EasyScript One-Step RT-PCR SuperMix购自于TransGene Biological Science & Technology;AxyPrep DNA Gel Extraction Kit 购自于Axygen;pMD18-T载体购自宝生物(大连)工程有限公司;PCR仪购于Bio-Rad;电泳仪购于北京市六一仪器厂;凝胶成像分析系统购于Sagecreation;其他常规试剂为分析纯。
1.3 实验方法
1.3.1 引物的设计
依据GenBank收录的ADV、MEV、CDV序列,根据各自保守序列应用Primer 5.0软件设计三对特异性引物,均由哈尔滨博仕生物技术有限公司合成,序列如表1。
1.3.2 病毒DNA/RNA的提取
阿留申病毒的DNA、肠炎病毒的DNA及犬瘟热病毒的RNA模板,按照EasyPure Viral DNA/RNA Kit试剂盒说明书进行提取。
1.3.3 PCR扩增
利用One-Step RT-PCR试剂盒,以提取的DNA和RNA为模板先进行单一PCR扩增,检测引物间的特异性。又将三种模板混合,构建三重PCR扩增体系:R-mix 10 μL,E-mix 1 μL,模板1.5 μL,引物F各0.5 μL,引物R各0.5 μL,ddH2O 4.5 μL。扩增条件为:45℃反转录30 min;94℃预变性5 min,94℃变性30 s,55℃退火30 s,72℃延伸 45 s,40个循环;72℃再延伸10 min。
1.3.4 多重PCR扩增条件的优化
根据设计的引物,计算Tm=(A+T)×2+(G+C)×4,再根据实际情况,设定温度梯度PCR反应(梯度为58℃,57℃,56℃,55℃,54℃),摸索合适的退火温度。将三对引物等量混合,分别加入2、1.5、1、0.5 μL进行PCR扩增,摸索合适的引物浓度,确定最佳的多重PCR扩增条件。
1.3.5 特异性试验
利用上述最佳多重PCR扩增体系和扩增条件,对水貂阿留申病毒、貂肠炎病毒、犬瘟热病毒及犬腺病毒样品进行扩增,验证多重PCR扩增的特异性。

表1 引物信息Tab.1 Primer information

注:A、B和C分别为ADV、CDV和MEV的PCR扩增结果;泳道1为阴性对照; M为DL 2000 marker;泳道2~4分别为MEV、CDV和ADV。图1 单一PCR扩增结果Note.A,B,C were the amplification products of ADV, CDV and MEV PCR, respectively. Line 1 was negative control. M was DL 2000 marker. Lines 2-4 were MEV, CDV and ADV, respectively.Fig.1 Amplification products of single PCR test
1.3.6 敏感性试验
将ADV、MEV、CDV扩增产物(片段分别为601 bp、205 bp和451 bp)与pMD18-T载体连接构建阳性质粒,利用紫外分光光度计测定浓度并换算成质粒拷贝数。将三种阳性质粒等量混合,并进行10倍系列稀释,利用多重PCR进行扩增,检测方法的灵敏性。
1.3.7 临床样品的检测
利用构建的多重PCR方法,对黑龙江省周边貂场疑似水貂阿留申病、貂病毒性肠炎和犬瘟热感染的10份病料进行PCR检测,并与单一PCR检测结果比较。
2 结果
2.1 PCR扩增
单一和多重PCR的扩增产物经琼脂糖凝胶电泳后,三对引物分别扩增出各自的目的条带,即ADV为601 bp,MEV为205 bp,CDV为451 bp(图1),无扩增交叉现象,多重PCR能同时扩增出三条片段大小差异明显的条带,与单一PCR扩增片段大小一致,不存在引物干扰现象(图2),测序结果表明扩增产物为三种病毒的特异性片段。
2.2 多重PCR扩增条件的优化
通过设置不同的退火温度,优化多重PCR扩增条件,结果表明,在58℃、57℃、56℃、55℃和54℃温度下均能扩增出3条目的条带,但当退火温度设为55℃时,扩增条带最亮。通过加入不同体积的引物,优化多重PCR扩增条件,结果表明,在2 μL和1.5 μL引物下能扩增出3条目的条带,1 μL的引物不能扩增出MEV目的条带,0.5 μL的引物不能扩增,当加入1.5 μL体积的引物时,多重PCR扩增结果最佳(图3)。在1.5%的琼脂糖凝胶电泳下扩增条带效果最佳。
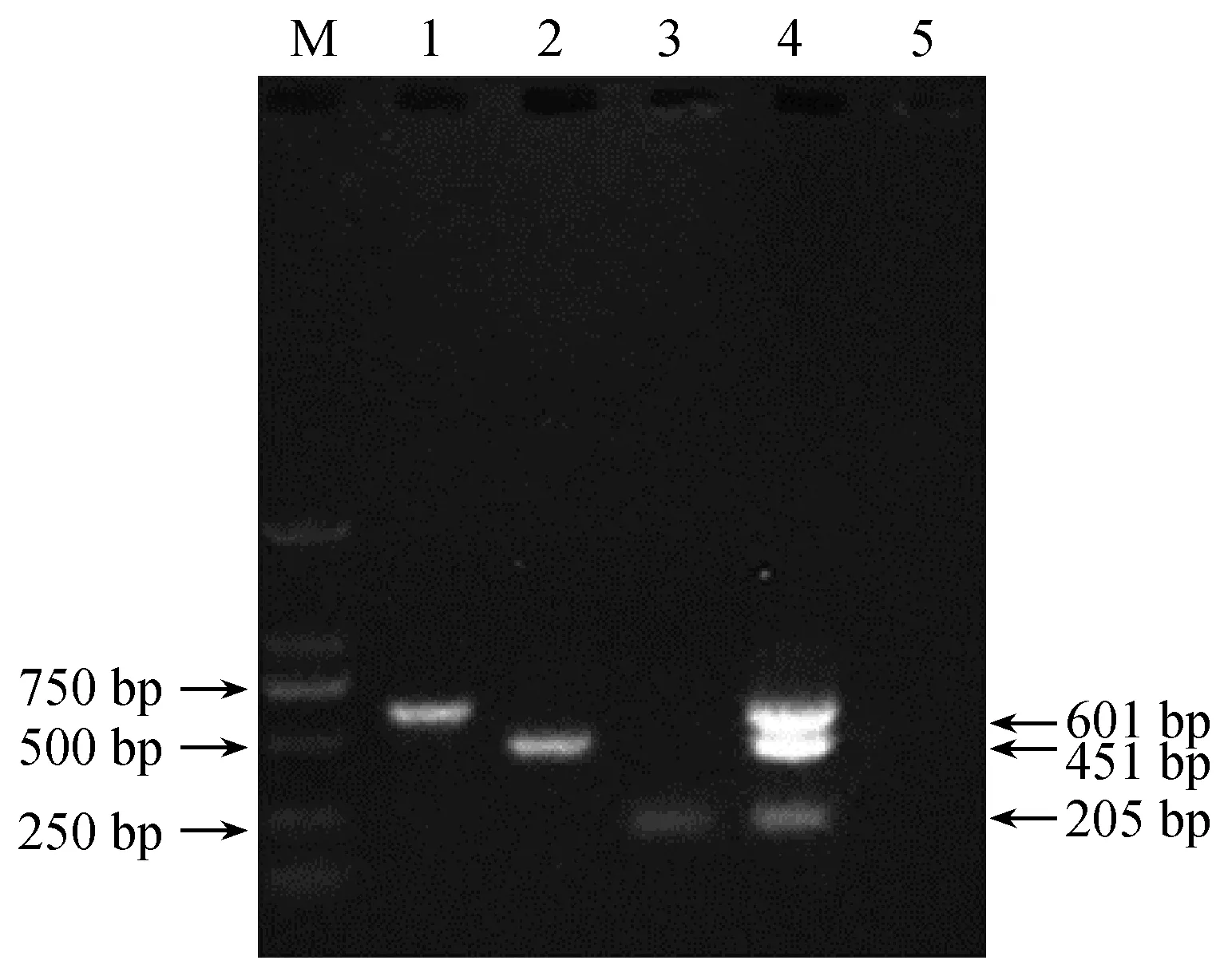
注:泳道1~4分别为ADV、CDV、MEV、ADV+CDV+MEV;泳道5为5:阴性对照;M为DL 2000 Marker。图2 三重PCR扩增结果Note.Line 1-4 was ADV, CDV, MEV, and ADV+CDV+MEV, respectively. Line 5 was the negative control; M was the DL 2000 marker.Fig.2 Amplification products of the multiplex PCR test
2.3 特异性试验
在最佳的多重PCR扩增条件下,只能对含有ADV、CDV及MEV模板的样品扩增出601 bp、451 bp、205 bp条带,CAV样品未扩增出目的条带(图4)。
2.4 敏感性试验
将ADV、MEV、CDV与pMD18-T载体构建的质粒进行测序和序列比对分析,表明成功构建阳性质粒。利用紫外分光光度计测定质粒浓度并换算成拷贝数,ADV的拷贝数为每微升2.67×1010个,MEV的拷贝数为每微升3.02×1010个,CDV的拷贝数为每微升1.72×1010个。将混合的模板进行10倍系列稀释,取不同浓度模板1.5 μL进行多重PCR扩增,结果是拷贝数为每微升105个时能同时扩增出三条目的条带,拷贝数为每微升104个倍时只能扩增出ADV和MEV,不能扩增出CDV,拷贝数为每微升103个时不能扩增出目的条带(图4)。多重PCR最低检测到ADV 每微升2.67×104拷贝、MEV每微升3.02×104拷贝和CDV 每微升1.72×105拷贝。
2.5 临床样品的检测
对来自黑龙江省周边貂场的10份病貂样品进行多重PCR和单一PCR检测,(图5),两种PCR检测结果均发现ADV感染病例有6例,MEV感染病例有5例,CDV感染病例有4例,表明多重PCR 与单一PCR检测结果一致,可以用于临床样品检测。另外,多重PCR检测结果显示三重感染率为20%,ADV和MEV感染率超过50%,临床ADV、MEV和CDV混合感染较严重。

注:A为特异性分析;B为敏感性分析;泳道2、12为阴性对照;M为DL 2000 marker;泳道1、3分别为ADV+CDV+MEV、CAV;泳道4~11阳性质粒浓度分别为每微升107、106、105、104、103、102、101、100拷贝。图4 特异性和敏感性分析Note.A,specificity analysis;B, sensitivity analysis;Lines 2 and 12 were negative control. M, DL 2000 marker. Lines 1 and 3 were ADV+CDV+MEV and CAV, respectively. Lines 4-11 were different concentrations of the positive recombinant plasmids at 107, 106, 105, 104, 103, 102, 101, and 100 copies/μL.Fig.4 Specificity and sensitivity analysis

注:泳道1~10分别为临床样品1~10;M为DL 2000 Marker。图5 临床样品检测Note.Lines 1-10 were clinical samples 1-10. M was DL 2000 marker.Fig.5 Detection of the clinical samples
3 讨论
多重PCR反应体系较为特殊,需在同一个反应条件和反应体系下加入多个模板和多对引物,因此扩增条件要求较高,需摸索最佳的扩增条件,以提高扩增反应的效率。影响扩增效率的主要因素有引物和退火温度[11,12]等。在引物方面,需注意以下几点:(1)引物间不存在互补结构及发卡结构[13],排除引物干扰现象,提高引物的特异性扩增;(2)多条扩增产物片段大小差异明显,在琼脂糖凝胶电泳中可明显区分;(3)引物间的Tm值和GC%含量相近,保证在同一退火温度下能同时扩增出多条产物;(4)多重PCR扩增体系内,引物浓度直接影响扩增的结果,有必要设立引物浓度梯度摸索合适的引物浓度。在扩增温度方面,退火温度对扩增结果影响较大,需设立温度梯度确定最佳的扩增条件。
水貂阿留申病、病毒性肠炎与犬瘟热并称影响水貂健康的三大疫病,临床上多为混合感染[2,14],其中水貂阿留申病毒和病毒性肠炎为DNA病毒,而犬瘟热病毒为RNA病毒,由于三种病毒类型不一致,对多重PCR方法的构建要求较高。本试验采用了DNA/RNA提取试剂盒和一步法扩增试剂盒,将DNA和RNA模板同时在一个扩增体系内扩增,缩短了样品处理和扩增的时间,可更快地获取到检测结果,根据检测结果及时地采取防控措施。本试验设计的三对引物在扩增过程中不存在引物干扰现象,可同时扩增出三条目的片段,最佳的退火温度为55℃;最佳引物体积为1.5 μL;三重PCR敏感性试验表明可检测到每微升2.67×104拷贝的阿留申病毒、每微升3.02×104拷贝的水貂肠炎病毒和每微升1.72×105拷贝的犬瘟热病毒,与杜伟雄[15]的水貂阿留申病毒的敏感性检测相比,敏感度提高了10倍。
多重PCR和单一PCR都具有相当高的敏感性,可以检测出痕量的核酸模板。对于实验动物貂的常规病原检测,本实验建立的多重PCR可同时检测ADV、MEV及CDV三种病原,与单一PCR相比,大大降低了工作量,节约了检测成本,可更快地给出检测结果,及时采取相应的防治措施。有研究[16]报道多重PCR的灵敏度有所下降,但足以达到检测的要求。本实验所建立的三重PCR可在一次反应中对疑似ADV、MEV及CDV感染的水貂进行分子
生物学诊断,且快速、特异、简便和灵敏,具有广阔的应用前景。
[1] 张立垚,周学红,王惠,等. 哥本哈根、赫尔辛基部分品种水貂皮十年拍卖数据分析 [J]. 野生动物学报,2017,1:110-114.
[2] 张卓. 水貂阿留申病毒分离鉴定及其致病性研究和诊断方法的建立 [D]. 东北农业大学,2015.
[3] 钟世勋,迟珊珊,王振,等. 山东规模化养殖场毛皮动物多重感染病原学分析 [J]. 中国兽医学报,2014,11:1770-1777.
[4] 潘德芹. 水貂多重感染的病原学分析及绿脓杆菌松花粉多糖佐剂灭活苗的研制 [D]. 山东农业大学,2014.
[5] Farid AH, Zillig ML, Finley GG, et al. Prevalence of the Aleutian mink disease virus infection in Nova Scotia, Canada [J]. Prev Vet Med, 2012,106: 32-40.
[6] Porter DD, Larsen AE, Porter HG. Aleutian disease of mink [J]. Adv Immunol,1980, 29: 61-86.
[7] 王洋,胡博,马凡舒,等. 水貂病毒性肠炎研究进展 [J]. 特产研究,2016,8(3):67-71.
[8] Mao Y, Su J, Wang J. Roles of three amino acids of capsid proteins in mink enteritis parvovirus replication [J]. Virus Res, 2016, 222: 24-28.
[9] 王宇菲,和彦良,孟相秋,等. 水貂犬瘟热的流行、症状及预防 [J]. 山东畜牧兽医,2016,11(3): 32.
[10] 庄金秋,梅建国,王金良,等. 水貂犬瘟热病毒LD-1株的分离与鉴定 [J]. 中国畜牧兽医,2014,9(4): 226-232.
[11] 何亚鹏,张琪,史怀平,等. 绵羊痘病毒、山羊痘病毒及羊口疮病毒多重PCR检测方法的建立和应用 [J]. 动物医学进展,2017,19(3): 11-15.
[12] 王苗苗,张凡庆,王曼,等. 猪五种繁殖障碍性疫病病原体多重PCR的建立及初步应用 [J]. 动物医学进展,2017,22(3): 27-31.
[13] 尹全,李忆,邓强,等. 一种可同步检测3种外源基因的多重PCR方法 [J]. 山西农业科学,2017,17(1): 37-40, 88.
[14] 潘德芹,朱瑞良,李奕芙,等. 水貂主要病原的分子生物学鉴定及多重感染的病原分析 [J]. 中国兽医学报,2015,16(2): 218-224.
[15] 杜雄伟,李叶,胡传伟. 检测动物产品中水貂阿留申病毒和犬细小病毒复合PCR方法的建立和应用 [J]. 中国动物检疫,2012,12(8): 43-45.
[16] 刘飞,张宝存,张晓华,等. 对虾6种病毒多重PCR检测方法的建立 [J]. 渔业科学进展,2014,19(1): 60-67.
EstablishmentandapplicationofamultiplexPCRassayfordetectionofAleutiandiseaseparvovirus,enteritisparvovirusandcaninedistempervirusinthemink
MA Qin, WANG Yuan-zhi, YAN Wen-zhuo, ZHAO Li-li, CHEN Hong-yan, LU Tao-feng*
(Harbin Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Heilongjiang Provincial Key Laboratory of Laboratory Animal and Comprative Medicine,Harbin 100193, China)
ObjectiveAleutian disease, mink enteritis and canine distemper are the three major diseases affecting health of mink. This study intends to establish a multiplex PCR assay for simultaneously detecting of these three viruses.MethodsAccording to the conservative sequences reported in GenBank, three pairs of specific primers were designed to amplify the DNA templates of Aleutian mink disease parvovirus (ADV), mink enteritis parvovirus (MEV), and RNA templates of canine distemper virus (CDV), and optimized the amplifying conditions.ResultsThe specific objective strips of 601 bp (ADV), 205 bp (MEV) and 451 bp (CDV) were amplified simultaneously. The sensitivity test showed that the lowest nucleic acid detection limits were 2.67×104copies per μL for ADV, 3.02×104copies per μL for MEV, and 1.72×105copies per μL for CDV. The results of test of the clinical samples showed that the multiple PCR and single PCR assay were consistent.ConclusionsThe established multiplex PCR assay in this study can be used to rapidly detect the clinical samples of ADV, MEV and CDV single or mixed infections.
Multiplex PCR; Aleutian mink disease parvovirus; Mink enteritis parvovirus; Canine distemper virus
国家支撑计划项目(2015BA107B02)。
马芹(1990-),女,硕士研究生,专业:预防兽医学。E-mail: 542446515@qq.com
陆涛峰(1982-),男,助理研究员,博士,研究方向:实验动物与比较医学。E-mail: taofenglu@126.com
R-33
A
1671-7856(2017) 12-0097-05
10.3969.j.issn.1671-7856. 2017.12.017
2017-04-20
