姜黄素对沙漠干热环境下大鼠肠黏膜损伤及氧 化应激的影响
2017-12-21刘江伟王金泉许永华李佳佳
董 翔,刘江伟,王金泉,许永华,李佳佳,马 娜
(1.新疆农业大学动物医学学院,乌鲁木齐 830052; 2.新疆军区总医院新疆特殊环境医学重点实验室, 乌鲁木齐 830002)
姜黄素对沙漠干热环境下大鼠肠黏膜损伤及氧 化应激的影响
董 翔1,2,刘江伟2*,王金泉1*,许永华2,李佳佳2,马 娜2
(1.新疆农业大学动物医学学院,乌鲁木齐 830052; 2.新疆军区总医院新疆特殊环境医学重点实验室, 乌鲁木齐 830002)
研究报告
目的探讨姜黄素预处理对沙漠干热环境下大鼠肠黏膜的保护作用。方法雄性SPF级大鼠80只,随机分为生理盐水对照组(NC组)40只、姜黄素预处理组(HDC组)40只。NC组生理盐水灌胃,HDC组200 mg/kg姜黄素灌胃,连续7 d,每天1次。将各组大鼠置于模拟沙漠干热环境的实验舱中,温度:(41±0.5)℃,相对湿度:(10±2)%。在0、50、100、150 min时间点,分别随机取出NC组、HDC组大鼠(每组10只),腹腔注射戊巴比妥钠麻醉,留取回肠样本进行病理学观察评分及氧化应激指标CAT、SOD、MDA的检测。结果在0、50 min时间点,HDC组较NC组病理损伤评分无显著性差异(P> 0.05);在100、150 min时间点,HDC组病理损伤评分较NC组显著降低(P< 0.01)。在50、100、150 min时间点,HDC组CAT、SOD活力较NC组显著升高(P< 0.05或P< 0.01),HDC组MDA含量较NC组显著降低(P< 0.05或P< 0.01)。暴露于干热环境中,NC组肠黏膜病理损伤评分与CAT、SOD活力呈负相关(r=-0.9128,r=-0.9125,均P< 0.01),与MDA含量呈正相关(r=0.9258,P< 0.01)。结论姜黄素预处理对沙漠干热环境下大鼠肠黏膜具有保护作用,其机制可能与姜黄素抑制肠黏膜氧化应激反应有关。
姜黄素;肠黏膜;氧化应激;沙漠干热环境
中暑是由内源性的新陈代谢产热及外源性的高温环境,或两者共同作用下引起的一种继发于热损伤之后的全身炎症反应综合征(SIRS),并有可能引发多器官功能障碍(MODS)甚至死亡[1]。肠道作为人和脊椎动物最大的储菌库和屏障系统是热打击的首发器官,其损伤后造成的内毒素泄露,是诱导热应激向中暑发生发展的始动因素[2]。沙漠干热环境具有气候干燥炎热、体表水分蒸发量大、日照时间长、降雨量少、植被稀疏和紫外线强度高等特点,长时间处于这样的环境中激增了中暑的发病风险[3]。本课题组前期研究表明姜黄素预处理能显著提高大鼠在沙漠干热环境中的生存时间[4],因此我们推测姜黄素可能对大鼠肠黏膜具有保护作用,本研究进一步探讨姜黄素对沙漠干热环境下大鼠肠黏膜损伤及氧化应激的影响,为预防沙漠干热环境下中暑和改善预后提供基础理论依据。
1 材料和方法
1.1 实验动物
SPF级SD雄性大鼠80只,体重210~230 g,购自新疆医科大学实验动物中心[SCXK(新)2016-0003]。实验及相关操作在新疆军区总医院实验动物科SPF级动物实验室进行[SYXK(新)2016-0003]。动物实验均获新疆军区总医院伦理委员会批准,并遵照国家科学委员会要求予以关怀照顾。
1.2 主要试剂与仪器
姜黄素(日本化成株式会社);BCA蛋白检测试剂盒(美国Themo Scientific);MDA、SOD、CAT检测试剂盒(南京建成生物工程研究所)。
西北特殊环境人工实验舱(新疆军区总医院研制);光学显微镜CH20(Olympus);酶标仪M550(日本Bio-Rad)。
1.3 实验方法
1.3.1 动物分组
所购大鼠在SPF级动物实验室适应性饲养7 d,温度:(21±2)℃,相对湿度:(45±5)%。将80只大鼠随机分为2组(每组40只):生理盐水对照组(NC组),生理盐水灌胃;姜黄素预处理组(HDC组),200 mg/kg姜黄素(溶解于0.5%的羧甲基纤维素钠溶液中)灌胃,每天1次,持续7 d,灌胃期间灭菌饲料和水自由摄取。灌胃结束后第1天提前12 h禁食,将各组大鼠置于西北特殊环境人工实验舱中,实验舱模拟沙漠干热环境,温度:(41±0.5)℃,相对湿度:(10±2)%,并禁食禁水。
1.3.2 样本采集
在0、50、100、150 min时间点,分批次随机取出NC组、HDC组大鼠(每组10只)。3%戊巴比妥钠(50 mg/kg)腹腔深度麻醉后,距离回-盲肠交界约1 cm处迅速截取回肠组织学样本2份,一份回肠样本用液氮冰冻后储存于-80°C冰箱,用于氧化应激指标的检测,另一份回肠样本置于4%多聚甲醛溶液中固定,用于苏木素-伊红染色及光学显微镜下病理学观察及评分。
1.3.3 病理学观察及评分
回肠样本固定24 h后,进行石蜡包埋、切片、H&E染色、中性树脂封片。光学显微镜观察大鼠回肠组织病理学变化。每张切片随机选取10个视野,采用Chiu’ s[5]评分标准进行量化,平均10个视野的评分之和,记为每张切片的病理学损伤评分。
1.3.4 肠黏膜CAT、SOD、MDA的测定
从-80℃冰箱取出回肠样本,称量100 mg样本置于玻璃匀浆器中,并加入200 μL预冷的PBS,充分匀浆后加入700 μL预冷的PBS。4℃离心机3500 r/min离心10 min,取上清液即为10%的回肠组织匀浆液。分装后,严格按试剂盒产品说明书提供方法测定回肠组织匀浆液中CAT活力、SOD活力、MDA含量。
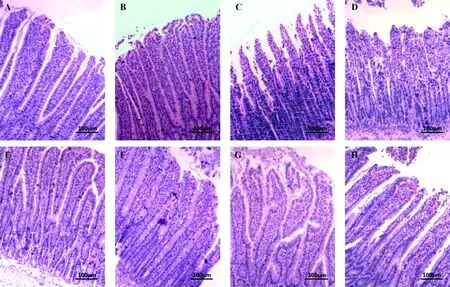
注:(A)0 min NC组;(B)50 min NC组;(C)100 min NC组;(D)150 min NC组;(E)0 min HDC组;(F)50 min HDC组;(G)100 min HDC组;(H)150 min HDC组。图1 回肠病理学损伤变化(Bar=100 μm) (A)NC group, 0 min.(B)NC group, 50 min.C)NC group, 100 min. D)NC group, 150 min.(E)HDC group, 0 min.(F)HDC group, 50 min.(G)HDC group, 100 min.(H)HDC group, 150 min.Fig.1 Pathological changes of the rat ilea
1.4 统计学方法
2 结果
2.1 肠黏膜病理学损伤变化
光学显微镜下观察发现,在0 min时间点,NC组、HDC组肠黏膜上皮细胞完整,无病理学损伤(见图1 A、E)。在50 min时间点,NC组、HDC组病理学变化以固有层顶部毛细血管扩张充血,偶见上皮细胞与固有层之间水肿、间隙增大为主(见图1B、F)。在100 min时间点,NC组肠黏膜部分上皮细胞脱落,固有层裸露(见图1C);HDC组肠黏膜固有层边缘轻度水肿、毛细血管扩张充血,顶部上皮细胞排列紊乱(见图1G)。在150 min时间点,NC组肠黏膜上皮细胞片状坏死脱落,固有层裸露、边缘毛细血管扩张充血,固有层中大量嗜中性粒细胞侵润(见图1D);HDC组肠黏膜顶部固有层边缘毛细血管充血,上皮细胞嗜酸变,偶见顶部上皮细胞脱落(见图1H)。
2.2 肠黏膜病理学损伤评分
如图2所示,NC组、HDC组肠黏膜病理学损伤评分随干热暴露时间的延长呈上升趋势。在0、50 min时间点,NC组较HDC组病理损伤评分差异无显著性(P> 0.05),在100、150 min时间点,HDC组病理损伤评分较NC组均降低(P< 0.01)。

注:与NC组比较,** P< 0.01。图2 回肠病理学损伤评分Note.Compared with the NC group,** P< 0.01.Fig.2 Pathological injury scores of the rat ilea
2.3 肠黏膜CAT、SOD、MDA的变化
如图3-A所示,NC组、HDC组回肠CAT活力随干热暴露时间的延长呈下降趋势。在0 min时间点,组间CAT活力差异无显著性(P> 0.05);在50 min时间点,HDC组CAT活力较NC组升高(P< 0.05);在100 min时间点,HDC组CAT活力较NC组升高(P< 0.01);在150 min时间点,HDC组CAT活力较NC组升高(P< 0.01)。

注:与NC组比较,* P< 0.05,** P< 0.01。图3 回肠氧化应激指标变化 Note.Compared with the the NC group,* P< 0.05,** P< 0.01.Fig.3 Changes of oxidative stress indexes in the rat ilea
如图3-B所示,NC组、HDC组回肠SOD活力随干热暴露时间的延长呈下降趋势。在0 min时间点,组间SOD活力差异无显著性(P> 0.05);在50、100、150 min时间点,HDC组SOD活力较NC组升高(P< 0.01)。
如图3-C所示,NC组、HDC组回肠MDA含量随干热暴露时间的延长呈上升趋势。在0 min时间点,组间MDA含量差异无显著性(P> 0.05);在50 min时间点,HDC组MDA含量较NC组降低(P< 0.05);在100 min时间点,HDC组MDA含量较NC组降低(P< 0.01);在150 min时间点,HDC组MDA含量较NC组降低(P< 0.01)。
2.4 病理学损伤评分与CAT、SOD、MDA的相关性分析
在沙漠干热环境下NC组大鼠回肠病理损伤评分与氧化应激指标CAT、SOD、MDA的相关性分析中,病理学损伤评分与CAT活力呈显著负相关(r=-0.9128,P< 0.01);病理学损伤评分与SOD活力呈显著负相关(r=-0.9125,P< 0.01),病理学损伤评分与MDA含量呈显著正相关(r=0.9258,P< 0.01)。
3 讨论
中暑时心排血量增加,并通过分流胃肠道血液到皮肤和肌肉来最大限度的散发热量[6]。肠黏膜血流量减少、灌注不足及热应激时细胞的高代谢需求产生大量活性氧,将造成肠上皮细胞和基质的氧化应激损伤[7]。ROS产生于细胞的基本生理过程(例如:呼吸),在正常的生理状态下具有调节细胞增殖、生理机能和活性的功能[8],并由超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPX)、硫氧化还蛋白(TRX)、过氧化氢酶(CAT)、谷氧还蛋白(GRX)等抗氧化物酶作为自由基清除剂调节ROS的浓度水平[9]。线粒体处于ATP合成的中心是ROS产生的重要来源,也是对细胞内外环境应激最为敏感的细胞器之一[10]。有证据表明持续的高温,可导致ATP合成减少,细胞内钙离子稳态失衡,线粒体通透性改变,线粒体中产生过量的ROS,损害蛋白质、脂质和DNA,进一步降低线粒体能量合成效率并通过兴奋性级联反应产生更多的氧自由基,并最终导致细胞凋亡或坏死[11]。因此维持ROS产物与抗氧化防御系统之间的动态平衡是保证细胞正常功能必不可少的条件。本研究发现,随着沙漠干热环境下暴露时间的延长,大鼠肠黏膜病理损伤程度不断加重,肠黏膜抗氧化物酶CAT、SOD活力呈下降趋势,脂质过氧化产物MDA含量呈上升趋势,肠黏膜病理损伤评分与CAT、SOD、MDA的活力或含量呈显著相关性,提示暴露于沙漠干热环境导致的氧化应激反应是造成大鼠肠黏膜损伤的重要原因之一。
姜黄多年生姜科属植物,在中国和印度的传统医学中有几百年的应用历史,被广泛的使用在多种疾病的治疗[12]。姜黄素是从干燥姜黄的根茎中提取的一种天然的疏水性多酚类化合物,是其中主要的活性成分。有研究发现姜黄素的烯醇形式具有清除自由基的能力,使姜黄素具有抗氧化性[13]。另有研究认为姜黄素通过化学分子式中的酚羟基及β-二酮以提供质子的方式,调节细胞中多条信号传导通路,发挥其抗氧化的作用[14]。Cucolas等[15]发现姜黄素可以上调小肠中TRAIL的含量,抑制COX-2、NF-κB的表达,减轻肠黏膜缺血再灌注造成的病理损伤和氧化应激。Kim等[16]研究发现姜黄素可通过调节氧化应激和核转录因子E2相关因子2(Nrf2)信号通路上调尿液中的SOD浓度,下调MDA浓度抑制肾脏的氧化应激反应,发挥保护肾脏的作用。Yang等[17]研究发现姜黄素通过抑制Notch信号通路,改善H2O2刺激内皮细胞造成的氧化应激损伤,降低ROS含量和细胞凋亡指数。Salh等[18]发现二硝基苯磺酸(DNB)诱导的小鼠结肠炎模型,可通过饲喂添加含有0.25%姜黄素的饲料,抑制NF-κB通路和p38丝裂原活化蛋白激酶活化,降低结肠iNOS表达和嗜中性粒细胞侵润。但关于姜黄素对沙漠干热环境下中暑大鼠肠黏膜氧化应激损伤的研究尚未见报道,本研究发现在50 min时间点,NC组、HDC组肠黏膜病理学损伤以固有层顶部毛细血管扩张充血,偶见上皮细胞与固有层之间水肿、间隙增大为主,NC组较HDC组病理损伤评分无显著性差异,这可能与热应激早期机体处于代偿期,导致ROS诱发抗氧化能力增强有关。在100、150 min时间点,姜黄素预处理各组肠黏膜病理损伤程度降低,CAT、SOD活力增加,MDA含量降低,提示姜黄素预处理可能通过提高肠黏膜抗氧化物酶活力,抑制ROS过量产生导致的脂质过氧化反应,对肠黏膜具有一定的保护作用。
总之,暴露于沙漠干热环境中大鼠肠黏膜损伤程度随暴露时间的延长而不断加重,而姜黄素预处理对沙漠干热环境下大鼠肠黏膜具有保护作用,其机制可能与姜黄素抑制肠黏膜氧化应激反应有关。
[1] Leon LR, Helwig BG. Heat stroke: Role of the systemic inflammatory response[J]. J Appl Physiol,2010,109:1980-1998.
[2] He S, Liu F, Xu L, et al. Protective effects of ferulic acid against heat stress-induced intestinal epithelial barrier dysfunction in vitro and in vivo[J]. PLoS One,2016,11(2):e0145236.
[3] 董翔,王金泉,刘江伟,等. 沙漠干热环境中暑大鼠血常规及肠黏膜病理学变化[J]. 实验动物科学,2016,33(6):16-19.
[4] 李佳佳,刘江伟,姚刚,等. 姜黄素对沙漠干热环境大鼠生存率影响的实验[J]. 中国比较医学杂志,2015,25(10):24-28.
[5] Tian SY, Guo RX, Wei SC, et al. Curcumin protects against the intestinal ischemia-reperfusion injury: involvement of the tight junction protein ZO-1 and TNF-α related mechanism[J]. Korean J Physiol Pharmacol,2016,20(2):147-152.
[6] Waltz X, Baillot M, Connes P, et al. Effects of hydration level and heat stress on thermoregulatory responses, hematological and blood rheological properties in growing pigs[J]. PLoS One,2014,9(7):e102537.
[7] Chang CK, Chang CP, Liu SY, et al. Oxidative stress and ischemic injuries in heat stroke[J]. Prog Brain Res,2007,162:525-546.
[8] Mittler R. ROS are good[J]. Trends Plant Sci,2017,22(1):11-19.
[9] Tönnies E, Trushina E. Oxidative stress, synaptic dysfunction, and Alzheimer’ s disease[J]. J Alzheimers Dis,2017,57(4):1105-1121.
[10] Okon IS, Zou MH. Mitochondrial ROS and cancer drug resistance: implications for therapy[J]. Pharmacol Res,2015,100:170-174.
[11] Akbarian A, Michiels J, Degroote J, et al. Association between stress and oxidative stress in poultry; mitochondrial dysfunction and dietary interventions with phytochemicals[J]. J Anim Sci Biotechnol,2016,7:37.
[12] Ammon HP, Wahl MA. Pharmacology of curcuma longa[J]. Planta Med,1991,57(1):1-7.
[13] Sharma RA, Gescher AJ, Steward WP. Curcumin: the story so far[J]. Eur J Cancer,2005,41(13):1955-1968.
[14] 李军,熊琨,龚元,等. 基于信号传导通路的姜黄素抗氧化机制研究进展[J]. 中草药,2016,47(13):2373-2380.
[15] Cucolas C, Daneasa AI, Olteanu D, et al. Resveratrol and curcumin as protective agents in an experimental rat model of intestinal ischemia and reperfusion[J]. Can J Physiol Pharmacol,2016,30:1-8.
[16] Kim BH, Lee ES, Choi R, et al. Protective effects of curcumin on renal oxidative stress and lipid metabolism in a rat model of type 2 diabetic nephropathy[J]. Yonsei Med J,2016,57(3):664-673.
[17] Yang Y, Duan W, Liang Z, et al. Curcumin attenuates endothelial cell oxidative stress injury through Notch signaling inhibition[J]. Cell Signal,2013,25(3):615-629.
[18] Brumatti LV, Marcuzzi A, Tricarico PM, et al. Curcumin and inflammatory bowel disease: potential and limits of innovative treatments[J]. Molecules,2014,19:21127-21153.
Protectiveeffectofcurcuminontheintestinalinjuryandoxidativestressinratsindryandhotdesertenvironment
DONG Xiang1,2, LIU Jiang-wei2*, WANG Jin-quan1*, XU Yong-hua2, LI Jia-jia2, MA Na2
(1.College of Veterinary Medicine, Xinjiang Agricultural University, Urumqi 830052, China; 2.The Key Laboratory of Special Environmental Medicine of Xinjiang, General Hospital of Xinjiang Military Region, Urumqi 83000)
ObjectiveTo investigate the protective effect of curcumin pretreatment on the intestinal mucosa in rats in dry and hot desert environment.MethodsEighty male SPF grade rats were randomly divided into saline control group (NC group) and curcumin pretreatment group (HDC group) (40 in each group). Rats in the NC group were gavaged with saline, and rats in the HDC group were gavaged with curcumin (200 mg/kg), once a day for 7days. The rats were placed in a cabin simulating the dry and hot desert environment (41±0.5)℃ and relative humidity of (10±2)%. Rats were randomly taken from each groups (n=10) and sacrificed with 3% sodium pentobarbital intraperitoneally at 0 min, 50 min, 100 min and 150 min time points. The ileal tissue was stained for histological examination and oxidative stress index was detected.ResultsAt time points 0 min and 50 min, the pathological injury scores of the HDC group were not significantly different compared with the NC group (P> 0.05). At time points 100 min and 150 min, the pathological injury scores of the HDC group were significantly decreased compared with the NC group (P< 0.01). At time points 50 min, 100 min and 150 min, the CAT and SOD activity of HDC group were significantly increased compared with the NC group (P< 0.05 orP< 0.01). The MDA content of HDC group were significantly decreased compared with the NC group (P< 0.05 orP< 0.01). Exposed to dry and hot environment, the pathological injury scores of the NC group were negatively correlated with CAT and SOD activity (r=-0.9128,r=-0.9125,P< 0.01), and positively correlated with MDA content (r=0.9258,P< 0.01).ConclusionsCurcumin pretreatment can protect the intestinal mucosa of rats in dry-heat environment of desert, and curcumin can alleviate the pathological damages of intestinal mucosa by inhibiting the oxidative stress in intestinal mucosa.
Curcumin; Intestinal mucosa; Oxidative stress; Dry and hot environment; desert
新疆维吾尔自治区自然科学基金项目(2015211C231)。
董翔(1982-),男,硕士研究生。研究方向:实验动物学。E-mail: 49834420@qq.com
刘江伟(1970-),男,教授,博士后。研究方向:特殊环境医学研究。E-mail: ljw273@sohu.com。
王金泉(1975-),男,教授,博士。研究方向:动物生长发育调控。E-mail: wangjinquan163@163.com。*共同通讯
R-33
A
1671-7856(2017) 12-0028-05
10.3969.j.issn.1671-7856. 2017.12.005
