糖皮质激素诱导小鼠骨质疏松模型构建 方法的研究进展
2017-12-21李啸群苏佳灿
李啸群,钱 进,苏佳灿
(1.第二军医大学附属长海医院学员管理大队,上海 200433; 2.第二军医大学海医四队,上海 200433; 3.第二军医大学附属长海医院创伤骨科,上海 200433; 4.中韩生物医学工程中心,上海 201802)
糖皮质激素诱导小鼠骨质疏松模型构建 方法的研究进展
李啸群1,钱 进2,苏佳灿3,4*
(1.第二军医大学附属长海医院学员管理大队,上海 200433; 2.第二军医大学海医四队,上海 200433; 3.第二军医大学附属长海医院创伤骨科,上海 200433; 4.中韩生物医学工程中心,上海 201802)
研究报告
糖皮质激素是由肾上腺皮质束状带分泌的一类甾体类激素,也可由化学方法人工合成,具有调节糖、脂肪和蛋白质合成和代谢的作用,还具有抑制免疫应答、抗炎、抗毒、抗休克的作用。但长时间应用糖皮质激素会导致骨量下降,甚至严重的骨质疏松,大大增加了骨折的风险。因此,针对激素诱导骨质疏松机制及治疗的探索显得愈发重要。目前,根据给药方式的不同,激素诱导小鼠骨质疏松模型的构建方法主要有植入缓释药物法,口服法和注射法三种。由于任何一种模型都只能与人体骨质疏松的临床表现部分相似,不能完全模拟人体骨质疏松的病理变化,因此每一种构建模型的方法都有其独特的适应面。现有研究表明,激素诱导骨质疏松模型的构建主要是通过调节内分泌,促进骨吸收和抑制成骨细胞,减少骨生成实现的。与其他动物相比,小鼠具有基因组与人类高度同源,近交突变系发达,基因修饰技术成熟,经济实惠等优点,因此,激素诱导的小鼠骨质疏松模型在骨质疏松研究工作中具有非常重要的意义。本文将对激素诱导小鼠骨质疏松模型的构建方法进行综述。
激素诱导;骨质疏松;小鼠;模型
糖皮质激素(glucocorticoid),又名“肾上腺皮质激素”,是由肾上腺皮质分泌的一类甾体类激素,也可由化学方法人工合成,具有调节糖、脂肪和蛋白质合成和代谢的作用,还具有抑制免疫应答、抗炎、抗毒、抗休克的作用。但长时间应用激素会导致骨量下降,甚至严重的骨质疏松,大大增加了骨折的风险。因此,糖皮质激素诱导骨质疏松的机制研究具有非常重要的临床意义。目前激素诱导小鼠骨质疏松的机制主要分为对内分泌代谢和对骨细胞的影响两个方面。
目前,关于激素诱导骨质疏松的机制还并非完全清楚,临床上也还没有理想的防治手段,为更好的探究糖皮质激素诱导的骨质疏松的具体机制及防治方法,常需要构建安全、有效的体内模型来进行实验。小鼠由于基因组与人类接近、近交系发达、易于获取及基因技术相对成熟等特点,是激素诱导骨质疏松模型的重要动物来源,成功的构建激素诱导的小鼠骨质疏松模型,是进行探究糖皮质激素病理作用机制的第一步。
1 激素诱导小鼠骨质疏松模型药物的选择
临床研究显示,连续6个月以上应用糖皮质激素进行治疗,会导致病人出现显著的骨质疏松症状[1]。激素诱导小鼠骨质疏松主要是通过长期给予小鼠超过生理剂量的皮质类固醇激素来制备该模型。激素可以抑制成骨细胞活性,促进骨吸收,使骨形成减少,钙、磷、维生素D等代谢变化,从而导致骨量丢失,诱发骨质疏松[2]。临床上,根据糖皮质激素在机体内的作用时间不同,可将糖皮质激素分为短效、中效和长效三类。不同种类的激素在抗炎作用强度、升血糖作用、盐皮质激素活性和等效计量之间均有所差别[3]。目前,常用小鼠诱导骨质疏松的药物主要有泼尼松、泼尼松龙和地塞米松等具有较强抗炎作用和较长作用时间的中长效药物。
2 激素诱导骨质疏松小鼠种类的选择
一般而言,激素诱导的骨缺失可发生在任何年龄,性别的小鼠之中。但年轻小鼠(年龄小于12周)在激素暴露后,骨密度降低不明显,因此,骨质疏松诱导的小鼠一般应选择年龄较大,骨骼相对发育成熟的小鼠来进行实验(20周及以上)。有研究认为,激素诱导的小鼠骨质疏松模型往往仅伴有骨松质的减少,而骨皮质厚度却少有改变[4, 5]。但Komori等[6]分别研究了通过注射和植入缓释药物诱导的小鼠骨质疏松模型,发现小鼠骨松质增多,而骨皮质减少。因此,他认为激素诱导的小鼠骨质疏松模型骨质的变化可能受到某些人为原因的影响,可选用骨松质较少的高龄小鼠,从而减少骨松质方面的影响,但需注意,选用高龄小鼠的同时又增大了评估激素诱导骨质疏松的难度。同时,应用雄性小鼠可避免由于糖皮质激素作用引起的雌激素变化所带来的影响,但考虑到雄性小鼠之间存在等级制度,雄性小鼠饲养时往往需要分成几个较小的群体甚至单独饲养[7]。
在小鼠种系选择方面,并非所有种系的小鼠都适合应用于糖皮质激素诱导的骨质疏松模型。FVB/N小鼠对激素相对比较敏感,其次要属C57BL/6和Swiss Webster小鼠,这些种系小鼠在激素处理后,可发生明显骨质丢失[6]。Ersek等[8]对12周雌性C57BL/6 J小鼠和CD-1小鼠激素诱导后骨量丢失情况进行了研究对比。结果发现,激素诱导后,CD-1小鼠在股骨弹性和强度方面显著下降,而C57BL/6 J则无明显改变;MCT结果显示,CD-1小鼠激素诱导后出现明显骨质疏松;体外实验发现,C57BL/6 J小鼠成骨细胞和破骨细胞对糖皮质激素的耐受力更强,敏感度较低。因此,相对C57BL/6 J小鼠,CD-1小鼠更适合作为激素诱导骨质疏松的动物模型。作者建议,在进行激素诱导小鼠骨质疏松实验中,要慎重考虑不同种系及其他因素如年龄等对实验的影响[8]。
3 激素诱导小鼠骨质疏松模型的构建方法
与其他动物相比,小鼠的动物模型具有基因组与人类高度同源,近交突变系发达,基因修饰技术成熟,经济实惠等优点,因此,激素诱导的小鼠骨质疏松模型在骨质疏松研究工作中具有非常重要的意义。目前,激素诱导小鼠骨质疏松模型构建方法主要有植入缓释药物、饮水法及注射法三种。
3.1 植入缓释药物诱导骨质疏松
长期接受糖皮质激素的治疗往往会带来一系列严重的并发症,为探究其作用机制,诸多动物骨质疏松模型被用于体内实验。通过在小鼠皮下植入一枚一定释放速率的缓释激素药片,来诱导小鼠骨质疏松是近年来激素诱导骨质疏松最有效也是最常用的体内模型。其具体操作过程为,首先对小鼠实行全麻,将植入部位毛发剃掉(20 mm × 20 mm),然后在皮肤上切开一小口,将事先准备好的缓释药物或者安慰剂植入皮下,再用注射器将药丸推向小鼠肩胛间,最后将皮肤缝合,4~8周后,可通过骨密度的检测确认该模型是否构建成功。一般来说,以每组7~8只为宜,可减少骨密度变化带来的的误差。Thiele等[7]同时对不同种系小鼠给药的剂量和时间给出了参考。(见表1)
与其他模型相比,植入缓释药物诱导骨质疏松模型最大的优点就是其剂量的可控性以及激素作用的持续性,实验结果具有较强说服力[9]。但也有研究者认为,体内植入的缓释药物可能在一周左右的时间内便会释放完毕,因此,往往需要反复打开小鼠皮肤来进行缓释药物植入,而这种反复有创操作可能会对实验结果产生影响[10]。并且,缓释药物往往需要通过进口途径获得,每片缓释药物的价格在$25~45不等,价格昂贵且获取不易,也对实验造成了一定的限制[11]。
3.2 口服法诱导骨质疏松
口服法是指在小鼠饮水中添加一定剂量的糖皮质激素,使小鼠在饮水过程中摄入过量的激素从而诱发骨质疏松。与其他几种方法,尤其是植入法相比,它具有无创、经济、易操作的优点,不失为激素诱导小鼠骨质疏松的一个较理想的模型。
Sylvia等[11]尝试通过饮水法对小鼠骨质疏松状况进行研究,并将其与植入法诱导的骨质疏松进行了对比。他们首先将不同剂量的皮质酯酮(CS)溶解于100%的酒精当中,再将其溶于水,分别配成25、50、75、100 μg/mL的1%酒精溶液,对8周龄小鼠喂养4周,平均每天每只小鼠饮水4.5 mL。实验选取了血浆激素浓度、胰岛素敏感度、体脂量、去脂体重、骨量变化这5项糖皮质激素的主要慢性并发症作为参考指标,与经典植入缓释药物诱导骨质疏松的方法进行了对比。结果发现,50 μg/L浓度激素在各指标中均取得了满意的结果。而在血液动力学方面,饮水组小鼠活动时(夜间)血清浓度明显升高,休息时(白天)则降低;相反的,植入组小鼠在植入后第一天有较高的血清浓度,之后几周血清浓度低于正常。因此,作者建议利用饮水法模型时,取血检测最好在夜间进行。Karatsoreos和Fransson等[12, 13]也使用饮水法对小鼠进行了骨质疏松的诱导,分别对内分泌和β-细胞对小鼠骨质疏松的影响进行了探究。
与经典的植入缓释药物方法相比,直接喂食法诱导骨质疏松具有无创、经济、易操作等优点,尽管其存在给药剂量难以控制的缺点,但由于糖皮质激素引起的副作用具有剂量依赖性的特点,骨量丢失的程度与摄入激素的总量有关[14]。因此,可提前通过预实验,根据不同组内动物饮水量的差别,调整不同组小鼠饮水中药物浓度,从而保证不同组之间摄入相同的药物总剂量。
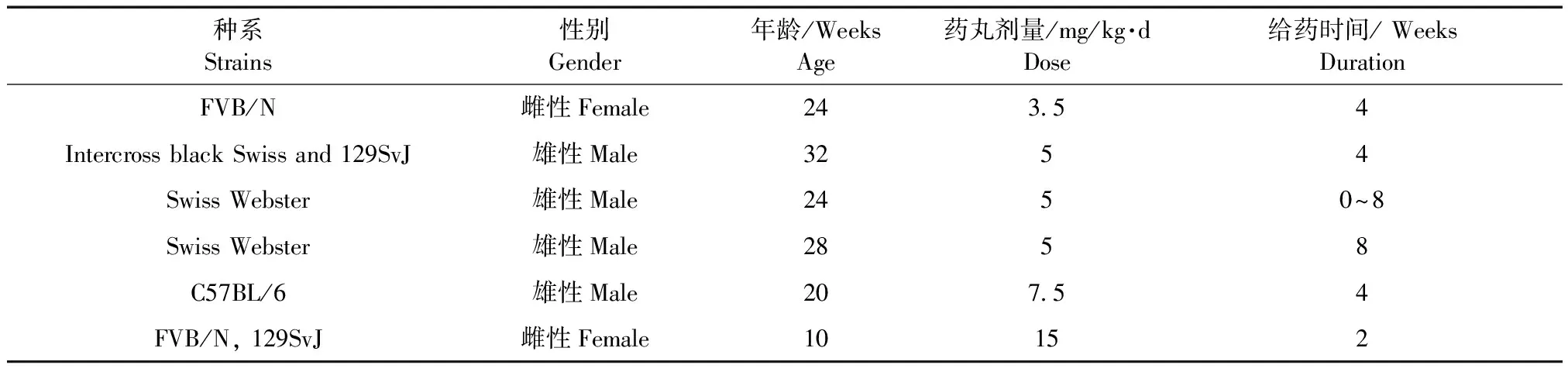
表1 不同种系小鼠激素诱导骨松给药剂量Tab.1 Different glucocorticoid doses used to induce bone loss in different strains of mice
3.3 注射药物诱导骨质疏松
鉴于口服法激素摄入剂量难以控制,缓释药物法价格高昂,操作繁琐等缺点,直接通过注射激素的方法诱导骨质疏松,不仅可以较好的控制药物剂量,也降低了实验的难度,减少了动物的创伤。注射法诱导骨质疏松主要有肌肉注射和腹腔注射两种。Li等[15]使用10周C57BL/6 J小鼠,分为3组,每组10只进行实验,在适应环境一周后,每周通过腹腔注射地塞米松5 mg/kg,每周3次持续12周,完成激素诱导骨质疏松模型的构建。Lu等[16]使用8~12周的C57BL/6和db/db小鼠,每日注射地塞米松1 mg/kg,持续7~14 d,完成了骨质疏松模型的构建。
通过注射或渗透泵的方法来对小鼠给予激素,常常会导致血清激素和血清降钙素原水平过高,因此,实验常缺乏可靠性[17]。且注射给药往往具有一过性的特点,不能很好的模拟激素缓慢持续进入机体的过程,无法模拟某些临床前的实验[18]。但考虑到注射法操作简便,价格低廉,给药剂量相对容易把控,且可通过使用长效糖皮质激素来弥补其给药一过性的缺点。目前,仍有部分研究者使用注射药物法诱导小鼠骨质疏松模型进行激素诱导骨质疏松机制方面的研究[15, 16]。
4 骨质疏松小鼠模型评价指标
探索骨质疏松的原理及机制,不仅需要成熟的骨质疏松动物模型,也需要全面且正确的评价指标。目前骨质疏松小鼠模型构建评价标准主要分为四个方面,分别为骨密度测量、骨组织形态计量、生化指标和生物力学指标[19]。
Micro CT为最主要的骨密度测量方法,它不仅能通过三维图像得到体积骨密度,而且还能测量骨小梁数量、厚度、面积、间隙,可以评价骨的连续性及弹性性能,是目前骨质疏松模型构建成功的金标准[20]。骨组织形态计量是通过显微图像对骨组织切片进行分析,获得骨组织的计量参数,比大部分骨密度测定技术有更高的分辨率,是唯一能够观察骨细胞的方法[21]。生化指标是指分析动物模型的血液或尿液,通过钙、磷、镁等元素或细胞因子的变化来推测骨代谢的情况,使实验具有可持续性[22]。生物力学指标可反映骨结构和宏观力学效应的关系,间接反映骨矿盐分部,骨小梁空间结构,可借此评价骨折风险[23]。
5 总结与展望
随着临床上糖皮质激素的应用所带来的一系列副作用越来越受到人们的重视,激素诱导的小鼠骨质疏松模型在骨质疏松方面的研究中也将起到越来越重要的作用。理想的骨质疏松模型应该是便于建立,易于操作且与人类骨质疏松病理变化相似的,有助于我们对骨质疏松发病机制、演变过程、病理改变进行探索。目前,每一种骨质疏松模型,乃至每一种模型的构建方法,都有其特定的生理病理变化[6]。这就要求研究者们在明确自己的研究内容和侧重点后,选择最合适的模型。
目前,植入缓释药物药物是激素诱导小鼠骨质疏松模型最常用,也是最有效的构建方法,近年来激素诱导的小鼠骨质疏松模型多采用该种方法。它能够有效地模拟临床部病人持续接受糖皮质激素治疗的状况,便于进行临床前研究,但操作较为复杂,实验前,需选用特定种系的小鼠,并根据其年龄确认药物剂量,同时,其缓释药物获得不易,价格昂贵;与植入法相比,饮水法价格低廉,操作简易且无创,且干预后,也能达到预期的骨质疏松效果,但由于每只小鼠饮水量存在差别,虽然可以根据糖皮质激素的剂量依赖性,来对激素浓度进行调整,但总体而言,实验结果相对缺乏说服力;注射法给药操作简易,价格低廉,也便于对给药量进行控制,曾经是激素诱导小鼠骨质疏松最常用的方法,但与植入法相比,它无法做到持续性给药,给药具有一过性的特点,不适合进行严谨的临床前实验,近年来已逐渐被植入法所取代。
[1] Weinstein RS. Glucocorticoid-induced bone disease [J]. N Engl J Med, 2011, 365(1): 62-70.
[2] Liu J,Lu C,Wu X, et al.Targeting osteoblastic casein kinase-2 interacting protein-1 to enhance Smad-dependent BMP signaling and reverse bone formation reduction in glucocorticoid-induced osteoporosis [J]. Sci Rep, 2017, 7: 41295.
[3] Alten R,Wiebe E. Hypothalamic-pituitary-adrenal axis function in patients with rheumatoid arthritis treated with different glucocorticoid approaches [J]. Neuroimmunomodulation, 2015, 22(1-2): 83-88.
[4] Altman A, Hochberg Z, Silbermann M. Interactions between growth hormone and dexamethasone in skeletal growth and bone structure of the young mouse [J]. Calcif Tissue Int,1992, 51(4): 298-304.
[5] Weinstein RS, Jilka RL, Parfitt AM, et al. Inhibition of osteoblastogenesis and promotion of apoptosis of osteoblasts and osteocytes by glucocorticoids - potential mechanisms of their deleterious effects on bone [J]. J Clin Invest, 1998, 102(2): 274-282.
[6] Komori T. Animal models for osteoporosis [J]. Eur J Pharmacol, 2015, 759: 287-294.
[7] Thiele S, Baschant U, Rauch A, et al. Instructions for producing a mouse model of glucocorticoid-induced osteoporosis [J]. Bonekey Rep, 2014, 3: 552.
[8] Ersek A, Santo AI, Vattakuzhi Y, et al. Strain dependent differences in glucocorticoid-induced bone loss between C57BL/6J and CD-1 mice [J]. Sci Rep, 2016, 6: 36513.
[9] Brady CJ, Villanti AC, Law HA, et al. Corticosteroid implants for chronic non-infectious uveitis [J].Cochrane Database Syst Rev, 2016, 2: CD010469.
[10] Yao W, Dai W, Jiang L, et al. Sclerostin-antibody treatment of glucocorticoid-induced osteoporosis maintained bone mass and strength [J]. Osteoporos Int, 2016, 27(1): 283-294.
[11] Gasparini SJ, Weber MC, Henneicke H, et al. Continuous corticosterone delivery via the drinking water or pellet implantation: a comparative study in mice [J]. Steroids, 2016, 116: 76-82.
[12] Karatsoreos IN, Bhagat SM, Bowles NP, et al. Endocrine and physiological changes in response to chronic corticosterone: a potential model of the metabolic syndrome in mouse [J]. Endocrinology, 2010, 151(5): 2117-2127.
[13] Fransson L, Franzen S, Rosengren V, et al. β-cell adaptation in a mouse model of glucocorticoid-induced metabolic syndrome [J]. J Endocrinol, 2013, 219(3): 231-241.
[14] Shi J, Wang L, Zhang H, et al. Glucocorticoids: dose-related effects on osteoclast formation and function via reactive oxygen species and autophagy [J]. Bone, 2015, 79: 222-232.
[15] Li G, Bu J, Zhu Y, et al. Curcumin improves bone microarchitecture in glucocorticoid-induced secondary osteoporosis mice through the activation of microRNA-365 via regulating MMP-9 [J]. Int J Clin Exp Pathol, 2015, 8(12): 15684-15695.
[16] Lu Y, Zhang Z, Xiong X, et al. Glucocorticoids promote hepatic cholestasis in mice by inhibiting the transcriptional activity of the farnesoid X receptor [J]. Gastroenterology, 2012, 143(6): 1630-1640.
[17] Herrmann M, Henneicke H, Street J, et al. The challenge of continuous exogenous glucocorticoid administration in mice [J]. Steroids, 2009, 74(2): 245-249.
[18] Geraets SE, Gosens T. The intra-articular glucocorticoid injection; short-term success with potential side effects [J]. Ned Tijdschr Geneeskd, 2016, 160(0): D814.
[19] 虞惊涛, 马信龙, 马剑雄. 骨质疏松动物模型评价方法 [J]. 中华骨质疏松和骨矿盐疾病杂志, 2014, 7(1): 5.
[20] Liu SP, Liao EY, Chen J, et al. Effects of methylprednisolone on bone mineral density and microarchitecture of trabecular bones in rats with administration time and assessed by micro-computed tomography[J]. Acta Radiol, 2009, 50(1): 93-100.
[21] Akhter MP, Lappe JM, Davies KM, et al. Transmenopausal changes in the trabecular bone structure [J]. Bone, 2007, 41(1): 111-116.
[22] Lee J, Vasikaran S. Current recommendations for laboratory testing and use of bone turnover markers in management of osteoporosis[J]. Ann Lab Med, 2012. 32(2): 105-112.
[23] Jee WS, Yao W. Overview: animal models of osteopenia and osteoporosis [J]. J Musculoskelet Neuronal Interact, 2001, 1(3): 193-207.
Currentstatusofresearchonglucocorticoid-inducedmousemodelsofosteoporosis
LI Xiao-qun1, QIAN Jin2, SU Jia-can3,4*
(1.Graduate Management Unit, Changhai Hospital Affiliated to the Second Military Medical University, Shanghai 200433, China; 2.Second Military Medical University Fourth Battalion of Naval Medicine, Shanghai 200433; 3.Department of Orthopedics, Changhai Hospital Affiliated to the Second Military Medical University, Shanghai 200433. China-South Korea Biomedical Engineering Center, Shanghai 201802)
Glucocorticoid is a kind of steroids hormone secreted by the adrenal cortex zona fasciculate or artificially synthesized. It can mediate the synthesis and metabolism of carbohydrate, lipid and protein and has the function of inhibiting immune response and anti-inflammation, anti-toxic and anti-shock effects. However, long-term intake of corticostereoid hormone will result in bone loss, even severe osteoporosis, and increase the risk of fracture. As a result the research on the mechanisms of osteoporosis become more and more necessary. Now, according to the differences in establishment methods, there are three approaches, i.e. pellet implantation, drinking water and injection. As a result of the only partial similarity between different osteoporosis models and humans, there is a special application of each type of animal model of osteoporosis. The osteoporosis in glucocorticoid-induced model is mainly caused by modulating incretion, promoting bone absorption and inhibiting the osteoblast differentiation. In the meanwhile, compared with the other animal models, genes in mice are closer to humans, and they have many advantages in cost, gene and cell techniques. Therefore, glucocorticoid-induced mouse models of osteoporosis has a great significance in osteoporosis research. This article will review the establishment methods of glucocorticoid-induced mouse models of osteoporosis.
Glucocorticoid; Osteoporosis; Mouse; Model
李啸群(1994-),男,博士研究生,专业:临床医学八年制。E-mail: 958250331@qq.com
苏佳灿(1976-),男,主任医师,教授,博士生导师。研究方向:骨质疏松。E-mail: drsujiacan@163.com
R-33
A
1671-7856(2017) 12-0120-05
10.3969.j.issn.1671-7856. 2017.12.021
2017-06-03
