载脂蛋白J在大鼠颈动脉再狭窄模型中表达规律的研究
2017-12-21杨宁苏斌寇璐董博李杨杨靖宇秦勤
杨宁,苏斌,寇璐,董博,李杨,杨靖宇,秦勤
基础与实验研究
载脂蛋白J在大鼠颈动脉再狭窄模型中表达规律的研究
杨宁,苏斌,寇璐,董博,李杨,杨靖宇,秦勤
目的:研究载脂蛋白J(Apo J)在大鼠颈动脉球囊扩张后血管再狭窄模型中的表达规律。 方法:40只Wistar大鼠随机分为两组:实验组和对照组,每组20只。采用2F Fogarty球囊导管于右侧颈总动脉进行球囊拉伤造模,术后1、2、3、4周共四个时间点,每组每个时间点5只大鼠。在各时间点,取右侧颈总动脉后,采用苏木伊红染色法(HE)观察其形态学变化,免疫组化检测Apo J蛋白表达,实时定量聚合酶链式反应(qRT-PCR)检测Apo J 基因的表达水平。 结果:与对照组各时间点相比,实验组在相同时间点内膜增生明显,Apo J蛋白及基因表达明显上调(P<0.05);且实验组随着损伤时间延长,内膜持续增生至第四周达到最大值,Apo J蛋白及基因表达在第3周达到高峰,第4周有所下降(P<0.05)。 结论:Apo J可能与血管损伤及损伤后内膜增生密切相关,血管中高表达的Apo J主要来源于损伤组织局部的血管平滑肌细胞(VSMC)合成,推测它可能是损伤后的一种代偿,通过抑制VSMC的增值和迁移的活性对再狭窄起保护作用。为寻找新的经皮冠状动脉介入治疗术后血管再狭窄的干预提供新的靶点。
载脂蛋白J 类;颈动脉狭窄;内膜增生
(Chinese Circulation Journal, 2017,32:1222.)
冠心病是严重威胁人类生命健康的重大疾病,其发病率和死亡率亦逐年攀升[1]。目前,经皮冠状动脉腔内血管成形术(PTCA)是治疗冠心病的有效方法之一,但其再狭窄率高达40%,严重影响了PTCA的远期疗效[2]。 虽然药物洗脱支架(DES)及联合双联抗血小板的药物治疗在某种程度上极大的降低了经皮冠状动脉介入治疗(PCI)后血管再狭窄的发生[3],但是,DES置入术后患者再狭窄的发生率仍高于10%[4]。DES球囊损伤诱导血管平滑肌细胞迁移、增值、基质生成及重塑进而导致PCI术后再狭窄。虽然在预防PCI术后血管再狭窄技术方面已有相关研究,但并未取得有意义的进展[5],说明PCI术后再狭窄这一病理生理过程具有复杂性及挑战性。载脂蛋白(Apo J)可分为分泌型(s CLU)和核型(n CLU)两种蛋白[5],主要在肝脏合成,可与高密度脂蛋白、脂质、载脂蛋白A、对氧磷酶等多种生物分子相结合[6],广泛分布于心脏、肾脏、脑组织等多种组织中,通过促进细胞生存、减少氧化应激、促进脂质转运[7]、促进泡沫细胞中胆固醇外流[8]等功能发挥对心血管的保护作用[9]。已有研究报道Apo J参与了动脉粥样硬化斑块的内中膜及血管成形术后再狭窄的进程[10],但其在心血管疾病进程中是保护作用还是致病作用尚存在争议。本研究通过建立Wistar大鼠颈动脉球囊损伤后再狭窄动物模型,检测Apo J在血管再狭窄进程中不同时间点的表达情况,从而探讨Apo J在再狭窄病程中的作用及其可能的机制,为寻找新的PCI术后再狭窄的干预靶点提供实验依据。
1 材料与方法
1.1 实验动物与分组:SPF级雄性Wistar大鼠40只,体重350~400 g,由中国人民解放军军事医学科学院提供。按照随机数表法分为实验组和对照组,每组20只。其中各组再以损伤后的第1、2、3、4周分为四个时间点,每组每个时间点5只。
1.2 建模方法:所有大鼠适应性饲养一周。实验组:手术当天称重,使用10%水合氯醛(0.3 ml/100 g)进行腹腔注射麻醉。颈部备皮,取颈正中切口约2~3 cm,经皮锁骨下静脉穿刺(天津市胸科医院动物实验室提供技术支持)并注射肝素(200 IU/kg)。于原拟定切口切开皮肤,逐层钝性分离,充分暴露颈内动脉、颈外动脉,永久结扎颈外动脉远心端,轻微向头部牵拉血管,用止血夹临时夹闭颈总动脉近心端及颈内动脉起始部。用眼科剪在颈外动脉剪“V”型切口,然后插入2F Fogarty球囊导管(江苏世泰实验器材有限公司,中国)约3 cm,给予2~3个大气压,轻微回拉球囊至动脉切口处,以出现摩擦感而又能拉动球囊为合适压力,以此方法反复损伤3次,撤除2F Fogarty球囊导管,永久结扎颈外动脉近心端,解除颈总动脉、颈内动脉止血夹,观察颈内动脉血流情况,可见明显搏动表明血流通畅。观察术野有无活动性出血,无则逐层缝合伤口,硫酸庆大霉素注射液2万单位肌肉注射预防感染。对照组:进行假手术处理,除不插入2F Fogarty球囊,其他步骤均同实验组。
1.3 实验动物的处死及标本获取:10%水合氯醛(0.3 ml/100 g)腹腔注射麻醉大鼠,将其仰卧固定于动物手术台上,锁骨下静脉穿刺注射10%氯化钾溶液2~3 ml处死动物,沿颈正中切口切开皮肤,逐层分离,暴露右侧颈总动脉,并取下颈总动脉全段,剪下大约0.3 cm放入10%中性福尔马林固定以备苏木伊红染色法(HE) 病理检查,余下血管放入冻存管并放入液氮中速冻,24 h后放入-80℃冰箱中长久保存,为免疫组化和实时定量聚合酶链式反应(qRT-PCR)备用。本实验已通过我院动物伦理审查。
1.4 苏木伊红染色观察颈总动脉血管形态学变化:标本在10%甲醛溶液中固定3~4 h,进行常规脱水、石蜡包埋,间断均匀切片,切片厚度4 μm。HE染色,光学显微镜下观察血管损伤的情况。
1.5 免疫组化检测颈总动脉血管Apo J蛋白的表达:采用免疫组化S-P二步法检测颈总动脉中是否有Apo J蛋白表达。常规切片、烘片、脱蜡、灭活内源性过氧化物酶、蒸馏水冲洗及抗原修复、一抗、二抗孵育、最后二氨基联苯胺(DAB)方法显色。一抗(兔抗人Apo J IgG多克隆抗体,美国Santa Cruz公司)。二抗(快捷型酶标羊抗鼠/兔IgG聚合物,福州迈新生物技术开发公司)。所有照片使用IS Capture系统拍摄并保存,使用Image Pro Plus 6.0进行数据采集及分析。使用平均光密度值(MOD)对Apo J蛋白的阳性表达做半定量分析。在400倍光镜下进行测量,选取血管的中膜及内膜为待测区域,通过测量获得待测区域的面积(Area)及积分光密度值(IOD),以平均光密度值表示Apo J蛋白表达的强弱。MOD计算公式如下:MOD=累积光密度值(sum of IOD)/累积面积(sum of Area)。
1.6 qRT-PCR检测颈总动脉血管中Apo J mRNA的表达:用Trizol一步法提取RNA,然后按试剂盒说明书操作进行逆转录操作。逆转录反应条件:37℃1 h,95℃ 5 min,4℃ 10 min。Apo J引物上游 5’-TAA GGA GAT TCA GAA CGC CG-3’, 下 游 5’-ATC CCT GGT GTC ATC TAG AG-3’;GAPDH 引物上游5’- GTG ATG CTG GTG CCG AGT AG-3’,下游5’-GGT GGC AGT GAT GGC GTG C-3’。 按 SYBR®Premix Ex Taq™system (Perfect Real -time)试剂盒(日本Takara公司)进行Real-time PCR操作。在ABI7500实时定量PCR仪中进行扩增(美国Applied Biosystems公司)。扩增条件:预变性95℃ 30 s,变性 95℃5 s,退火60℃ 34 s,进行40个循环,每个样本设置3个重复。2-ΔΔCt的分析方法比较各组mRNA的差异。
1.7 统计学方法:使用SPSS 20.0软件进行统计分析,计量资料用均数±标准差表示,两组间比较使用独立样本t检验,组内比较采用重复测量资料的方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 建模存活率及成功率:实验组20只大鼠中1只因术中操作不慎压迫气道致窒息死亡,1只因血管切口剪开大小不当,无法插入球囊导管,造模失败,1只因动脉出血于术后12 h死亡,最终存活大鼠17只,存活率85%。实验组病理检查均出现内膜增生增厚,成活的大鼠均造模成功。平均手术时间(34.19±6.09)min。
2.2 形态学检查结果:
2.2.1 各组血管切片形态学显微镜检测及大鼠颈总动脉内膜/中膜面积比(I/M)的比较结果:血管切片形态学显微镜检测详见图1~5。大鼠颈总动脉I/M的比较(表1),对照组的I/M接近于0。实验组1、2、3、4周的I/M较同时间点的对照组均升高,差异均有统计学意义(P<0.05)。实验组损伤后各时间点间的I/M逐渐升高,差异有统计学意义(P<0.05)。
2.2.2 各组大鼠颈总动脉Apo J蛋白表达情况:免疫组化实验结果显示Apo J蛋白主要在细胞浆中表达,对照组血管全层中未见Apo J蛋白的表达,实验组各时间点均可检测到Apo J表达(图6)。
以MOD表示Apo J蛋白表达的情况(表2),对照组的MOD接近于0,实验组各时间点Apo J蛋白的表达均高于其对照组, 3周Apo J蛋白表达最强, 4周表达强度减弱,差异均有统计学意义(P<0.05)。
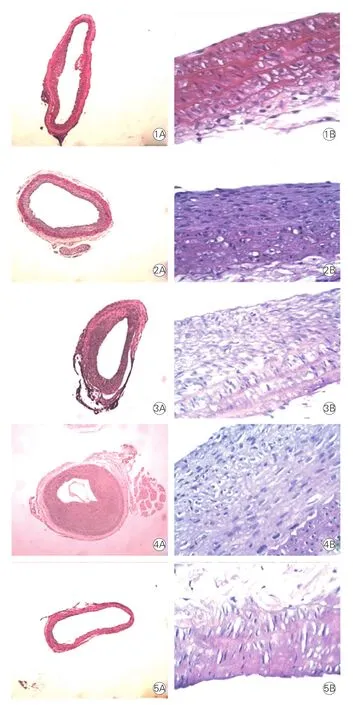
图1 ~5 苏木伊红染色法染色检查各组大鼠颈总动脉血管切片形态意图
表1 各组大鼠颈总动脉I/M的比较
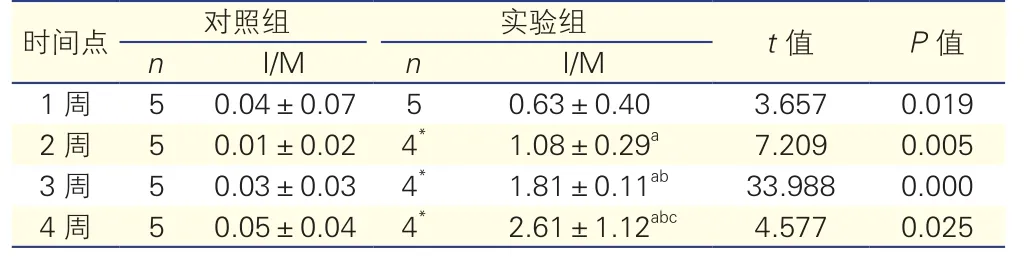
表1 各组大鼠颈总动脉I/M的比较
注: I/M:总动脉内膜/中膜面积比。与实验组1周比较aP<0.05;与实验组2周比较 b P<0.05; 与实验组3周比较 cP<0.05。*:存活大鼠
表2 各组大鼠劲总动脉Apo J蛋白表达水平
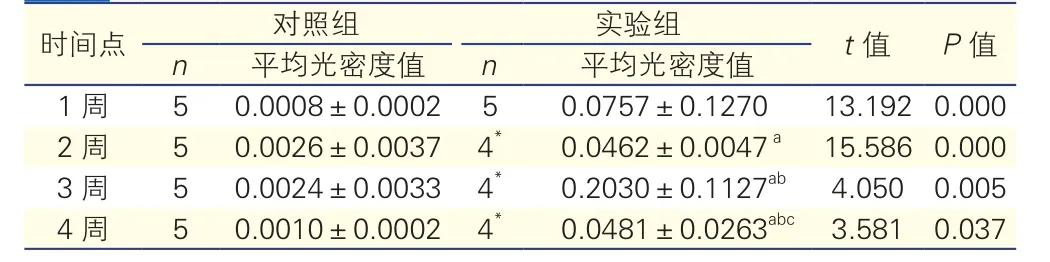
表2 各组大鼠劲总动脉Apo J蛋白表达水平
注: Apo J:载脂蛋白J;与实验组1周比较aP<0.05;与实验组2周比较bP<0.05; 与实验组3周比较 cP<0.05。*:存活大鼠

图6 免疫组化检测各组大鼠颈总动脉Apo J蛋白表达情况(x400)
2.2.3 各组大鼠颈总动脉Apo J mRNA表达情况(表3):与对照组相比,Apo J mRNA在实验组1周未升高(P>0.05), 2周显著升高, 3周达到最高,约为对照组的8倍, 4周开始下降,但仍高于对照组,差异均有统计学意义(P<0.05)。
表3 qRT-PCR比较各组大鼠劲总动脉Apo J mRNA表达水平
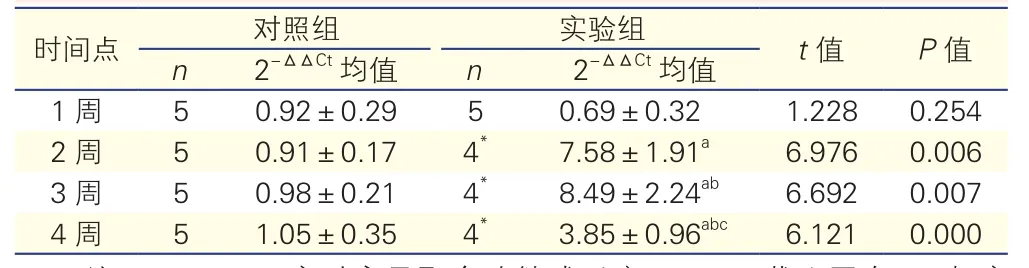
表3 qRT-PCR比较各组大鼠劲总动脉Apo J mRNA表达水平
注:qRT-PCR:实时定量聚合酶链式反应;Apo J:载脂蛋白J。与实验组1周比较aP<0.05;与实验组2周比较 bP<0.05; 与实验组3周比较cP<0.05。*:存活大鼠
3 讨论
目前,大量的研究结果提示Apo J/CLU可以通过抑制p53和p21的表达,刺激敲除CLU-KO小鼠的血管平滑肌细胞(VSMC)增殖和迁移[11],进而促进PCI术后血管再狭窄的发生[12]。而Orlandi等[13]通过诱导Apo J亚型转变的深入研究发现, n CLU对VSMC有促进凋亡、抑制增殖的作用,而Kim等[14]却提出高表达的s CLU能抑制VSMC的迁移、增殖,及抑制细胞的凋亡,但他们的研究并没有直接的证实s CLU和n CLU各自对于VSMC的作用。
VSMC的增殖和迁移是导致PCI术后再狭窄的主要原因。VSMC又分为分化型(收缩型)和未分化型(合成型)两种亚型。正常血管壁中的VSMC为分化型,无DNA的合成及增殖和迁移的能力,细胞中富含肌纤维,主要维持血管的弹性和收缩。心肌细胞及骨骼肌细胞一旦分化后就失去增殖的能力,但是VSMC与这些细胞不同,分化型的VSMC在应激性刺激的诱导下出现表型转化而变为未分化型。未分化型的VSMC肌纤维的含量较少,结构蛋白少,合成和分泌细胞外基质的能力强,有较强的增殖活性和向内膜迁移的生物学特性[15]。VSMC表型的转化使VSMC获得了增殖和迁移的能力,进而导致了PCI术后再狭窄的发生发展。
本研究发现在Wistar大鼠颈动脉球囊损伤术后,血管内膜于第1周时开始出现增生,并于第2周明显可见大量的VSMC向内膜迁移,内膜中的VSMC数量较多,细胞核密集、排列紊乱,提示其转化为增殖活跃状态的未分化型,而与之伴随的是Apo J mRNA的表达水平开始显著升高,其蛋白质的表达水平亦显著升高。第3周时内膜的增生更加明显,I/M面积比进一步的增大,同时Apo J mRNA及蛋白的表达均达到最高,这提示Apo J的表达与平滑肌细胞的增殖、迁移有密切的关系。在第4周时血管内膜增生达到最大,而在其增生内膜的管腔侧仍可发现未分化型的VSMC,但是其管壁侧的VSMC的排列开始趋向于整齐,多平行于管壁排列,细胞核趋向于成熟且数目减少,而细胞外基质开始增多,表明VSMC再次转化为无内分泌及增殖活性的分化型,此时,Apo J mRNA及蛋白的表达水平开始下降,但仍是高于对照组,进一步说明血管增生内膜内的Apo J表达与未分化型的VSMC密切相关。
Apo J是一种应激蛋白,多在有损伤、应激的情况下表达增加。结合本研究的结果,我们认为球囊损伤作为机械刺激,诱导VSMC由分化型向未分化型转变,未分化型的VSMC大量地向内膜迁移并增殖,同时合成和分泌大量含Apo J的细胞外基质。Apo J表达的持续增加可能作为一种应答机制,反馈性地抑制VSMC的增殖和迁移,随着VSMC增殖活性的降低,Apo J的表达开始减少。因此,我们进一步推测Apo J有望作为干预术后血管再狭窄的一个靶点,通过局部或系统地调节Apo J的表达,从而减少血管再狭窄的发生,但需要进一步的研究来证实这些推测。本研究尚存在一些不足之处,实验所使用的抗体主要用于检测s CLU,而未能探讨n CLU在再狭窄过程中的变化,因此,针对不同的Apo J蛋白表达在PCI术后再狭窄进程中的作用及分子机制的研究将是解决PCI术后再狭窄的关键。
[1] 陈伟伟, 高润霖, 刘力生, 等. 《中国心血管病报告2014》概要. 中国循环杂志, 2015, 30: 617-622.
[2] Lee JY, Park DW, Kim YH, et al. Incidence, predictors, treatment,and long-term prognosis of patients with restenosis after drugeluting stent implantation for unprotected left main coronary artery disease. J Am Coll Cardio, 2011, 57: 1349-1358.
[3] 叶慧明, 卢明瑜, 王伟民, 等. 冠状动脉旋磨术联合药物洗脱支架治疗冠状动脉严重钙化病变的临床研究. 中国循环杂志, 2012, 27:258-261.
[4] 陆元喜, 李浪. 支架内再狭窄的治疗进展. 中国循环杂志, 2016,31: 515-517.
[5] 郑晓梅, 刘亮, 李小刚. 载脂蛋白J在脑血管疾病中的研究进展.华西医学, 2009, 12: 3268-3270.
[6] Park S, Mathis KW, Lee IK. The physiological roles of apolipoprotein J/clusterin in metabolic and cardiovascular diseases. Rev Endocr Metab Disord, 2014, 15: 45-53.
[7] Daimon M, Oizumi T, Karasawa S, et al. Association of the clusterin gene polymorphisms with type 2 diabetes mellitus. Metabolism. 2011,60: 815-822.
[8] Riwanto M, Roherer L, Roschitzki B, et al. Altered activation of endothelial anti- and proapoptotic pathyways by high-density lipoprotein from patients with coronary artery disease: role of highdensity lipoprotein-proteome remodeling. Circulation, 2013, 127:891-904.
[9] O'Neill F, Riwanto M, Charakida M, et al. Structural and functional changes in HDL with low grade and chronic inflammation. Int J Cardiol, 2015, 188: 111-116.
[10] Yang N, Qin Q. Apolipoprotein J: A new predictor and therapeutic target in cardiovascular disease? Chin Med J, 2015, 128: 2530-2540.
[11] Millis AJ, Luciani M, McCue HM, et al. Clusterin regulates vascular smooth muscle cell nodule formation and migration. J Cell Physiol,2001, 186: 210-219.
[12] Shirasawa T, Miyata M, Eto H, et al. Deficiency of clusterin inhibits neointimal hyperplasia after vascular injury. J Atheroscler Thromb,2009, 16: 772-781.
[13] Orlandi A, Pucci S, Ciucci A, et al. Modulationg of clusterin isoforms is associated with all-trans retinoic acid-induced proliferative arrest and apoptosis of intimal smooth muscle cells. Arterioscler Thromb Vasc Biolo, 2005, 25: 348-353.
[14] Kim HJ, Yoo EK, Kim JY, et al. Protective role of clusterin/apolipoprotein J against neointimal hyperplasia via antiproliferative effect on vascular smooth muscle cells and cytoprotective effect on endothelial cells. Arterioscler Thromb Vasc Biol, 2009, 29: 1558-1565.
[15] Chistiakov DA, Sobenin IA, Orekhov AN, et al. Human miR-221/222 in physiological and atherosclerotic vascular remodeling. Biomed Res Int, 2015, 2015: 354517.
Expression Pattern of Apolipoprotein J in Rat’s Model of Carotid Artery Restenosis
YANG Ning, SU Bin, KOU Lu, DONG Bo, LI Yang, YANG Jing-yu, QIN Qin.
Department of Cardiology, Tianjin Chest Hospital, Tianjin (300051), China
QIN Qin, Email: qinqin6351@163.com
Objective: To study the expression pattern of apolipoprotein J (Apo J) in rat’s model of vascular restenosis after cartid balloon dilation.
Methods: A total of 40 Wistar rats were randomly divided into 2 groups: Experimental group, the rat’s model of carotid artery injury was established by 2 F Fogarty balloon catheter scratching in right carotid artery and Control group, the rats received sham operation without catheter scratching. n=20 in each group. Right carotid artery tissue was taken at 1, 2, 3, 4 weeks after the operation respectively and 5 rats were used for each time point. The morphological changes were measured by HE staining, protein and gene expressions of Apo J were examined by immunohistochemistry and qRT-PCR.
Results: Compared with Control group, at each time point Experimental group had obvious intimal hyperplasia and upregulated protein and gene expressions of Apo J, P<0.05. In Experimental group, with prolonged time of injury, consistent endometrial hyperplasia was observed and it reached the maximum at 4 weeks after operation; the peak protein and gene expressions of Apo J was found at 3 weeks after operation, then decreased at certain point at 4 weeks after operation, P<0.05.
Conclusion: Apo J might be closely related to intimal hyperplasia after vascular injury, high expression of vascular Apo J was mainly derived from vascular smooth muscle cell synthesis, it could be a kind of compensation with protective role and might be used as a new biological target for treating vascular retenosis after percutaneous coronary intervention.
Apolipoprotein J; Carotid stenosis; Intimal hyperplasia
天津市卫计委重点攻关项目(13KG131);天津市卫计委科技基金重点项目(2015KR07)
300051 天津市胸科医院 心内科
杨宁 主治医师 硕士 主要从事冠心病防治的临床与基础研究 Email:mengshateng@163.com 通讯作者:秦勤 Email:qinqin6351@163.com
R541
A
1000-3614(2017)12-1222-05
10.3969/j.issn.1000-3614.2017. 12.019
2016-12-25)
(编辑:曹洪红)
