腱糖蛋白-C在载脂蛋白E基因敲除小鼠动脉粥样硬化斑块不同时期表达的变化
2017-12-21李燕宋佳成严海浪黄君文陆钰马占龙施海彬
李燕,宋佳成,严海浪,黄君文,陆钰,马占龙,施海彬
基础与实验研究
腱糖蛋白-C在载脂蛋白E基因敲除小鼠动脉粥样硬化斑块不同时期表达的变化
李燕,宋佳成,严海浪,黄君文,陆钰,马占龙,施海彬
目的:探讨腱糖蛋白-C(TN-C) 在载脂蛋白E基因敲除(ApoE-/-)小鼠动脉粥样硬化斑块形成过程中不同时期表达的动态变化。 方法:取雄性SPF级ApoE-/-小鼠50只(模型组),高脂饲料喂养,建立小鼠动脉粥样硬化模型,雄性SPF级野生型C57BL/6小鼠50只为对照组,同样高脂饮食。分别于喂养4、8、16、24、32周时处死小鼠,检测血脂,显微镜观察斑块病理改变并进行定量分析,免疫组化方法检测动脉粥样硬化斑块内TN-C表达。 结果:模型组小鼠总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C) 水平均高于对照组小鼠(P均<0.05)。随着造模时间的进展,模型组小鼠斑块面积及斑块面积/管腔面积比值不断增加,各时期比较差异均有统计学意义(P均<0.05)。模型组小鼠斑块内TN-C表达量随着动脉粥样硬化进展而增多,32周小鼠斑块内部TN-C表达升高最显著,高于 8、16、24 周小鼠(分别为 0.49±0.07 vs 0.04±0.02、0.12±0.03、0.21±0.04,P<0.05)。 结论:TN-C的表达量随着斑块进展不断增加,可能与动脉粥样硬化进展及斑块不稳定性有关。
动脉粥样硬化;载脂蛋白E类;小鼠,基因敲除;腱糖蛋白
(Chinese Circulation Journal, 2017,32:1217.)
动脉粥样硬化(AS)是一种以进行性脂质沉积、炎性细胞浸润及纤维组织增生为特征的慢性炎症过程,是引起急性心脑血管事件的主要原因。腱糖蛋白-C(TN-C)是一种细胞外基质糖蛋白,主要由巨噬细胞和平滑肌细胞合成,参与了AS相关的诸多细胞生理病理过程,包括促进各种细胞的增殖、迁移和凋亡[1]。TN-C在动脉血管壁损伤时的表达增高,对于AS斑块的形成及破溃具有重要作用[2]。对AS不同时期斑块内TN-C的表达进行动态病理学观察,有利于AS进展程度的分析,并可早期发现易损斑块,为AS的预防和治疗提供新的参考指标。
1 材料与方法
动物模型建立:雄性SPF级载脂蛋白E基因敲除(ApoE-/-)小鼠(8周龄,体重 20~22 g,n=50,模型组),购自北京维通利华实验动物技术有限公司;雄性SPF级野生型C57BL/6小鼠(8周龄,体重20~22 g,n=50,C57BL/6小鼠为同源对照鼠为对照组,购自南京医科大学动物中心)。两组小鼠均给予高脂饮食(经典“西方膳食”[3],胆固醇0.15%,脂肪21%,购自北京科奥协力饲料有限公司)喂养,饲养于南京医科大学动物中心,动物饲养环境温度为22℃~25℃,相对湿度60%,光-暗周期12 h,自由饮水和进食。分别于饲养4、8、16、24、32周后进行血脂水平测定和病理学观察,检测动脉粥样硬化模型建立情况。
主要试剂及仪器:抗鼠Tenascin-C抗体(Invitrogen公司,美国),Envision试剂盒(Dako公司,美国),全自动生化分析仪(Beckman Coulter AU5800, 美国),显微镜(Olympus BX43,日本)。
观察指标:(1)血脂测定:两组小鼠分别于饲养4、8、16、24、32周时处死,处死前12 h禁食不禁水。采用10%水合氯醛(0.3 ml/100 g)麻醉后,摘眼球取血,常规静置血液30 min后,离心15 min,离心力1 307×g,离心后取上清,-80℃冰箱保存。采用全自动生化分析仪测定血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C) 含量。(2)主动脉组织病理检查:小鼠眼球采血后,过量麻醉处死小鼠,取出主动脉,用生理盐水冲洗干净,剪下邻近主动脉弓的降主动脉1.0~1.5 cm放入10%甲醛中固定,常规石蜡包埋备用。苏木素伊红染色(HE染色):各时期分别取5只(共25只)小鼠石蜡块用切片机进行连续切片,切片厚度3 µm。每间隔5张切片取1张进行HE染色,普通光镜观察血管及斑块的形态结构,进行病理形态学描述;每个标本共取3张切片用Image Pro Plus 6.0软件测量,取斑块面积平均值代表每只小鼠的主动脉斑块面积。免疫组织化学分析:剩余的25只小鼠石蜡块用于免疫组化分析,免疫组化染色采用Envision法,将切片常规脱蜡至水,微波抗原修复,磷酸盐缓冲液(PBS,主要成分:磷酸二氢钠、磷酸氢二钠、氯化钠,浓度:0.01 mol/L,pH:7.4)冲洗3 min×3次,切片置于湿盒中,滴入一抗(稀释度为1:100),置于37℃孵育箱孵育1 h,PBS冲洗3 min×3次;滴入Envision,置于37℃孵育箱孵育30 min,PBS冲洗3 min×3次,经二氨基联苯胺(DAB)染色,镜下控制染色时间,自来水冲洗终止反应,苏木素复染,脱水,烤干,中性树胶封片备用。利用光学显微镜观察斑块内TN-C表达及分布情况,棕黄色为TN-C表达阳性,并用Image Pro Plus 6.0软件计算阳性面积比(阳性反应面积/总测量面积),具体方法为每张切片随机选取2个视野测量,取平均值代表各标本的阳性面积比值。
统计学分析:采用SPSS 21.0软件进行统计学分析。计量资料采用均数±标准差表示。采用独立样本t检验对各组血脂水平进行比较。模型组组内各时期TN-C表达量比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
两组小鼠不同时期血脂水平比较(表1)
表1 两组小鼠不同时期血脂水平(mmol/L, n=50,
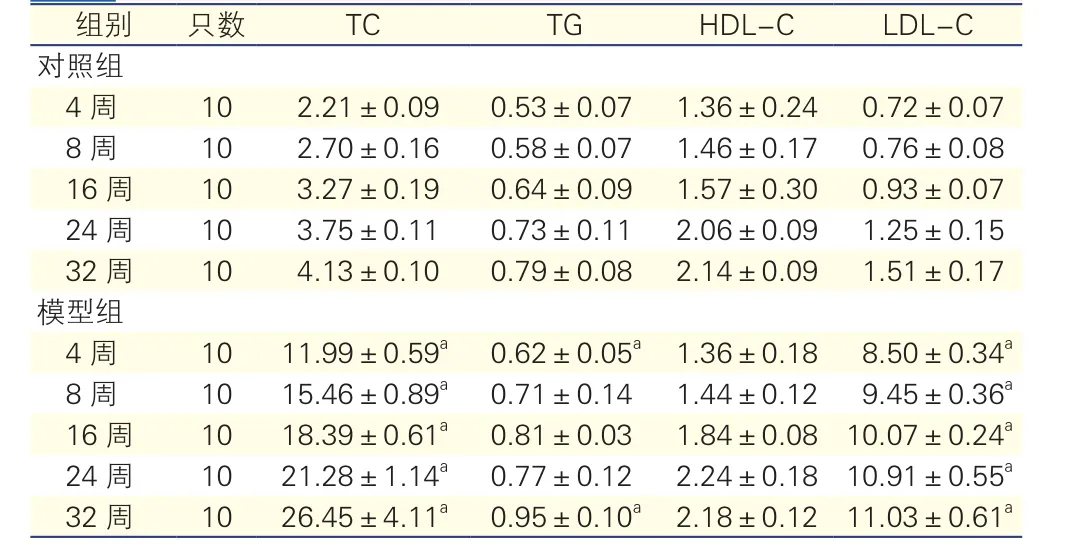
表1 两组小鼠不同时期血脂水平(mmol/L, n=50,
注:TC:血清总胆固醇;TG:甘油三酯;HDL-C:高密度脂蛋白胆固醇;LDL-C:低密度脂蛋白胆固醇。对照组:高脂喂养的C57BL/6小鼠;模型组:高脂喂养的ApoE基因敲除小鼠。与同周龄对照组比较aP<0.05
模型组ApoE-/-小 鼠 TC、LDL-C水平均较同周龄对照组小鼠升高(P<0.05);模型组小鼠除第4周及32周TG水平较对照组升高外(P<0.05), 其余时期两组TG、HDL-C水平均无统计学差异(P>0.05)。
两组小鼠主动脉HE染色形态学改变(图1)
光镜下,对照组小鼠主动脉内膜完整,内皮细胞及平滑肌细胞排列整齐规则,无AS斑块形成(图 1A)。模型组小鼠AS 4周内膜较对照组小鼠稍增厚,管腔内径未见明显异常(图1B);模型组小鼠AS 8周可见内膜增厚,脂质沉积,脂纹形成及血管内皮突起(图 1C);模型组小鼠AS 16周可见明显粥样斑块形成,胶原沉积,覆盖脂质成份形成纤维帽(图 1D);模型组小鼠AS 24周斑块深部有柳叶状胆固醇结晶堆积,纤维帽明显变薄,斑块隆起明显(图 1E); 模型组小鼠AS 32周斑块面积进一步增大,深部可见坏死物质,管腔明显狭窄(图 1F)。
模型组小鼠AS斑块面积比较(表2): 从喂养4~32周动态观察结果来看,对照组小鼠均无斑块形成,而模型组小鼠自喂养8周起均有斑块形成,并且随着时间延长,模型组小鼠斑块面积大小和斑块面积/管腔面积比值呈增长趋势,并且各时期相比差异均有统计学意义(P均<0.05)。
两组小鼠AS斑块内TN-C免疫组化结果比较:光镜下观察各组小鼠主动脉TN-C免疫组化染色,对照组小鼠主动脉几乎无TN-C的表达,模型组小鼠除第4周无表达外,其余各阶段均有TN-C表达(图2)。各时期阳性面积比结果(图3):AS 32周小鼠斑块内部TN-C表达升高最显著,高于8、16、24周小鼠 (分别为 0.49±0.07 vs 0.04±0.02、0.12±0.03、0.21±0.04),两两比较差异均有统计学意义(P<0.05)。
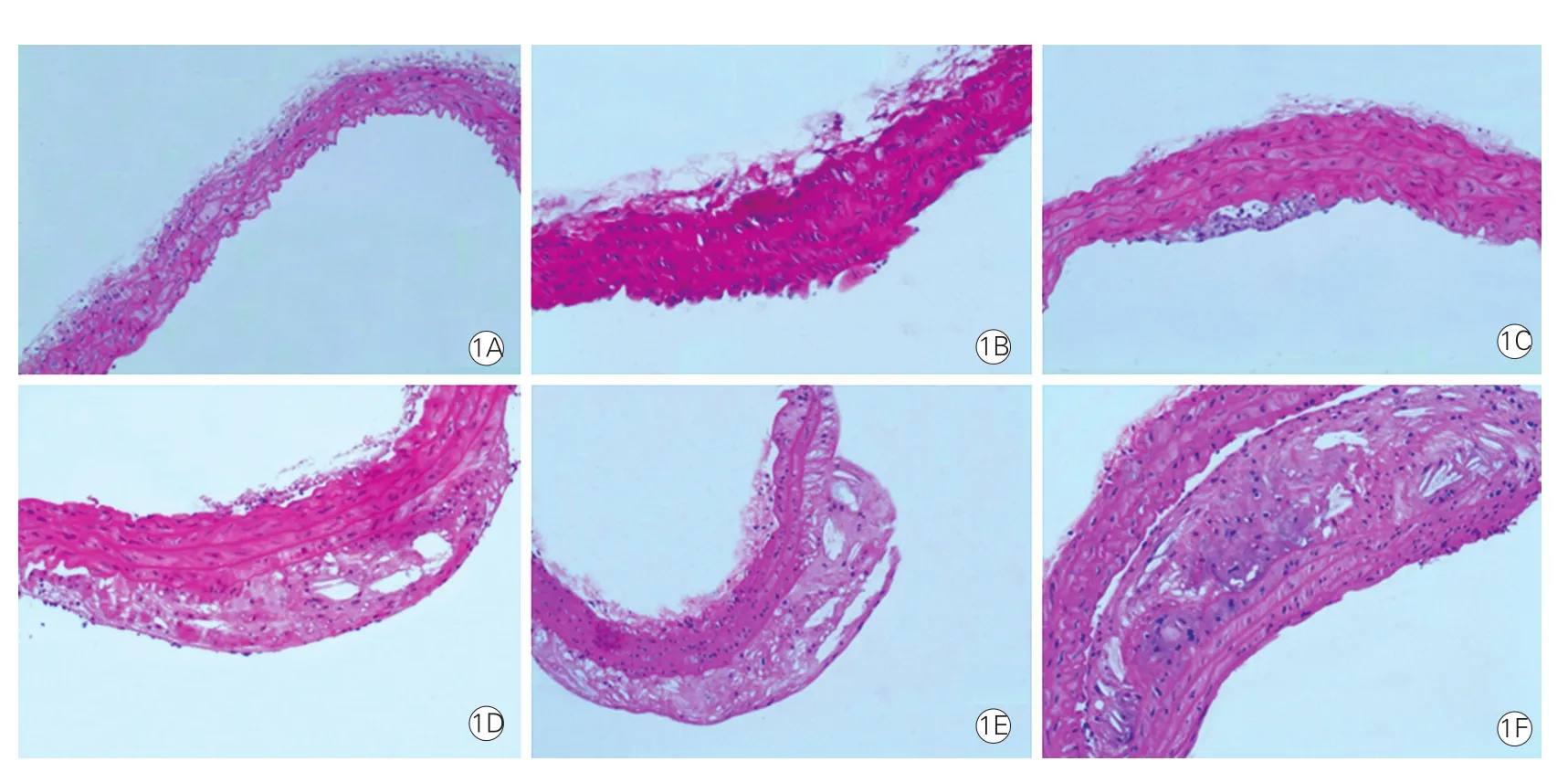
图1 各时期主动脉病理改变(苏木素伊红染色, ×100)
表2 模型组小鼠各时期主动脉斑块面积、管腔面积及斑块面积/管腔面积

表2 模型组小鼠各时期主动脉斑块面积、管腔面积及斑块面积/管腔面积
注:模型组:高脂喂养的载脂蛋白E基因敲除小鼠;*:同项各周小鼠比较P均<0.05。采用带拍照功能的光学显微镜观察HE切片斑块形成情况,并采集图片,使用Image Pro Plus 6.0软件测量图片中斑块面积及管腔面积
4周 5 0 0.81±0.08 0

图2 免疫组化分析模型组各时期斑块内TN-C表达
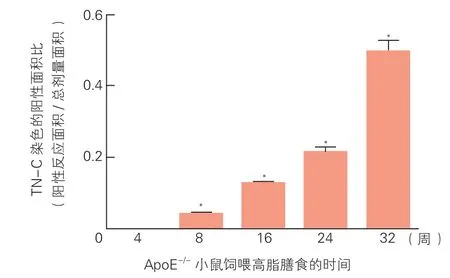
图3 模型组高脂喂养的ApoE-/-小鼠各时期TN-C表达量的半定量分析比较(各时期n=5)
3 讨论
ApoE-/-小鼠是目前公认的研究AS疾病的最经典动物模型之一,ApoE-/-小鼠可自发形成AS,与人类AS形成过程相似[4],高脂饮食则可加速AS进程。本研究采用高脂饮食喂养ApoE-/-小鼠,成功建立了AS模型,与既往研究常用损伤颈总动脉的方法建立AS模型不同[5],本研究未予外界物理损伤干预,充分模拟了正常人的AS过程,对于研究AS疾病具有较高的参考价值。研究发现,TC及LDL-C水平随时间延长而持续性增高。ApoE-/-小鼠8周时已有脂纹形成,16周时纤维斑块形成,斑块表面有较厚的纤维帽,斑块内含脂质、巨噬细胞等,随着时间延长,可见斑块纤维帽变薄甚至断裂,斑块内大量炎症细胞和脂质沉积,形成不稳定斑块。AS斑块的整个发展过程与既往研究相一致[6,7]。
TN-C是一种细胞外血管基质糖蛋白,是TN家族中发现最早也是最重要的一个成员。最新研究发现:TN-C参与了血管重塑的一系列生理、病理过程,其暂时性表达上调与内膜增生、肺动脉高压、AS、脑血管痉挛及血管再生等密切相关[8-10]。通常情况下,TN-C在成人体内极少表达或不表达,但在组织损伤时表达增高,组织修复完成时表达下调。既往研究表明,AS患者的冠状动脉斑块中TN-C表达水平增高[11],同时冠心病患者血清中TN-C水平也明显升高[12,13]。此外动物实验表明高脂喂养的ApoE-/-小鼠AS斑块中可检测到TN-C的高表达[14,15]。本研究结果较既往相似,TN-C在AS斑块的各时期均有不同水平的表达。
TN-C已成为研究心血管疾病的一个热点,但其在AS斑块发展过程中的动态表达鲜有报道。本研究观察ApoE-/-小鼠AS发展的各个阶段,通过比较对照组与模型组小鼠脂纹期、纤维斑块期、以及粥样斑块形成期等不同时期的小鼠主动脉TN-C表达量的差异,分析TN-C与AS 疾病严重程度的关系。本研究发现,AS早期脂纹形成,主要由泡沫细胞组成,TN-C表达量很少,纤维斑块时期,斑块主要由纤维成分组成,TN-C表达仍较少,随着AS的进展,尤其在富含脂质及纤维帽断裂的不稳定斑块中,TN-C的表达明显升高。由此证明TN-C主要表达于脂质核的周围及破裂的纤维帽中,而在以厚的纤维成分为主的稳定斑块中很少表达。巨噬细胞是TN-C的主要来源之一,理论上,巨噬细胞可通过两种机制增加炎性组织中TN-C的表达:通过多种生长因子及细胞因子介导;或是TN-C基因直接合成[11]。AS是一种持续性的慢性炎症过程,随着进程延长,AS进展,巨噬细胞浸润增加,斑块的不稳定性增加[16,17],TN-C表达随之升高。由此推测,在AS发展过程中,血管壁的炎症反应产生一系列细胞因子及炎性介质,刺激巨噬细胞表达TN-C,并且TN-C的表达与AS炎症程度相关,AS程度越重,或是斑块越不稳定,TN-C表达量越高。
综上所述,高脂饮食诱导了小鼠体内氧化应激水平的升高,诱导炎症反应,促进泡沫细胞形成,逐步导致内皮损伤、纤维斑块形成、粥样斑块形成。在此过程中,我们认为TN-C是参与其中的重要因素之一,AS病变进展时,TN-C表达水平明显增高,可提示斑块的不稳定性增高,而不稳定斑块与心脑血管疾病的发生密切相关。因此,对于AS发展过程中TN-C动态表达变化的研究可帮助寻找预防和治疗AS疾病新的切入点。
[1] Jones PL, Jones FS. Tenascin-C in development and disease: gene regulation and cell function. Matrix Biol, 2000, 19: 581-596.
[2] Imanaka-Yoshida K. Tenascin-C in cardiovascular tissue remodeling:from development to inflammation and repair. Circ J, 2012, 76: 2513-2520.
[3] Plump AS, Smith JD, Hayek T, et al. Severe hypercholesterolemia and atherosclerosis in apolipoprotein E-deficient mice created by homologous recombination in ES cells. Cell, 1992, 71: 343-353.
[4] Bot I, de Vries H, Korporaal SJ, et a1. Adenosine A2B receptor agonism inhibits neointimal lesion development after arterial injury in apolipoprotein E-deficient mice. Arterioscler Thromb Vasc Biol, 2012,32: 2197-2205.
[5] 余飞, 黄东雅, 堵翠, 等. ApoE-/-小鼠颈总动脉粥样硬化动物模型的建立. 中华实验外科杂志, 2013, 30: 401-402.
[6] 盛冲霄, 黎红华, 刘康, 等. 大鼠动脉粥样硬化病变各阶段内皮依赖性舒张功能以及亲环素A表达的变化. 中国循环杂志, 2015,30: 576-579.
[7] 刘剑刚, 董国菊, 史大卓, 等. 载脂蛋白E基因敲除小鼠不同周龄动脉粥样硬化的病理变化. 中国动脉硬化杂志, 2005, 13: 689-692.
[8] Imanaka-Yoshida K, Yoshida T, Miyagawa-Tomita S. Tenascin-C in development and disease of blood vessels. Anat Rec (Hoboken), 2014,297: 1747-1757.
[9] Fujimoto M, Shiba M, Kawakita F, et al. Epidermal growth factorlike repeats of tenascin-C-induced constriction of cerebral arteries via activation of epidermal growth factor receptors in rats. Brain Res,2016, 1642: 436-444.
[10] Midwood KS, Hussenet T, Langlois B, et al. Advances in tenascin-C biology. Cell Mol Life Sci, 2011, 68: 3175-3199.
[11] Wallner K, Li C, Shah PK, et al. Tenascin-C is expressed in macrophage-rich human coronary atherosclerotic plaque. Circulation,1999, 99: 1284-1289.
[12] Yang JH, Ren F. Clinical implications of tenascin-C and OX40 ligand in patients with acute coronary syndrome. Biomed Rep, 2014, 2: 132-136.
[13] Ozmen Yildiz P, Yildiz I, Ozmen C, et al. Relation between coronary artery calcium score and serum tenascin-C level in patients without known coronary artery disease. Acta Cardiol, 2015, 70: 633-639.
[14] Golledge J, Clancy P, Maguire J, et al. The role of tenascin C in cardiovascular disease. Cardiovasc Res, 2011, 92: 19-28.
[15] von Lukowicz T, Silacci M, Wyss MT, et al. Human antibody against C domain of tenascin-C visualizes murine atherosclerotic plaques ex vivo. J Nucl Med, 2007, 48: 582-587.
[16] 白瑞娜, 郗瑞席, 冯志博. 巨噬细胞与动脉粥样硬化-亚型及功能.中国循环杂志, 2014, 29: 393-395.
[17] 张小娟, 任满意, 曹晓青, 等. 趋化因子受体6基因敲除对载脂蛋白E基因敲除小鼠动脉粥样硬化斑块形成的影响. 中国循环杂志,2014, 29: 300-303.
Dynamic Expressions of Tenascin-C at Different Phases of Atherosclerosis in ApoE-/-Mice
LI Yan, SONG Jia-cheng, YAN Hai-lang, HUANG Jun-wen, LU Yu, MA Zhan-long, SHI Hai-bin.
Department of Radiology, The First Affiliated Hospital of Nanjing Medical University, Nanjing (210029), Jiangsu, China
MA Zhan-long, Email: mazhanlong@126.com
Objective: To investigate the dynamic expressions of tenascin-C (TN-C) at different phases of atherosclerosis in ApoE-/-mice.
Methods: Our research included in 2 groups: ApoE-/-group, n=50 SPF male mice with ApoE-/-and Control group, n=50 wild male C57BL/6 mice. Atherosclerosis model was established by high fat diet in both groups. The mice were sacrificed at 4, 8, 16, 24 and 32 weeks, blood lipids were examined, pathologic changes of plaque were observed by microscope for quantitative analysis and TN-C expressions in atherosclerosis plaque were measured by immunohistochemistry.
Results: Compared with Control group, ApoE-/-group had elevated blood levels of total cholesterol (TC) and low density lipoprotein cholesterol (LDL-C), both P<0.05. In ApoE-/-group, plaque area and the ratio of plaque area/lumen area were increasing upon prolonged modeling time, all P<0.05; TN-C expressions were increasing by progress of atherosclerosis,the highest TN-C expression was found at 32 weeks of modeling (0.49±0.07) which was higher than it was at 8 weeks(0.04±0.02), 16 weeks (0.12±0.03) and 24 weeks (0.21±0.04), all P<0.05.
Conclusion: TN-C expression was increasing with plaque progress which might be related to the development of atherosclerosis and plaque instability.
Atherosclerosis; Apolipoprotein E; Mice, knockout; Tenascin
国家自然科学基金面上项目(81471723);江苏省自然科学基金面上项目(BK20131446)
210029 江苏省南京市,南京医科大学第一附属医院 放射科(李燕、宋佳成、黄君文、陆钰、马占龙、施海彬);南京医科大学附属江苏盛泽医院 放射科(严海浪)
李燕 硕士研究生 主要从事分子影像研究 Email:liyan_stu@126.com 通讯作者:马占龙 Email:mazhanlong@126.com
R541.4
A
1000-3614(2017)12-1217-05
10.3969/j.issn.1000-3614.2017.12.018
2016-12-27)
(编辑:梅平)
